LPS对A549和Hela细胞SPLUNC1蛋白表达的影响
2019-10-08曹留霞武涧松
曹留霞,武涧松,陈 洁
上腭、肺及鼻咽上皮克隆(palate, lung and nasal epithelium clone, PLUNC),是一类由呼吸道黏膜特异分泌且与固有免疫应答密切相关的蛋白家族,短的上腭、肺及鼻咽上皮克隆1(short palate, lung and nasal epithelium clone 1, SPLUNC1)是新近发现的PLUNC家族成员,与杀菌渗透增强蛋白结构类似[1,2],能够对各种理化生刺激做出反应,与脂多糖结合,参与抗微生物和抗肿瘤的免疫过程[3,4]。近年来,其在呼吸道疾病和肿瘤发生发展中的作用已引起越来越多的关注。SPLUNC1主要在黏膜上皮、腺上皮等内胚层起源上皮组织中表达。已有研究表明,SPLUNC1在小细胞肺癌中呈高表达现象,可能参与非小细胞肺癌的早期防御[5,6]。然而,SPLUNC1是否在人宫颈癌上皮细胞中表达、炎性反应与SPLUNC1表达是否存在关联等问题尚未见报道。本研究就SPLUNC1在A549、Hela细胞中的表达特点及其与炎性刺激的反应关系进行初步观察,探讨SPLUNC1的潜在应用价值。
1 材料与方法
1.1 主要材料 人肺腺癌A549细胞、人子宫颈癌Hela细胞由青岛大学医学院附属医院中心实验室提供,DMEM-1640培养液和胎牛血清购自HYCLONE公司,0.25 %胰酶、DAB显色剂等试剂购自化晟科技有限公司,大肠杆菌LPS购自Sigma公司,CCK-8细胞增殖检测试剂盒购自BestBio公司,一抗兔抗人SPLUNC1多克隆抗体购自美国Abcam公司,二抗PV-9000试剂盒购自博奥森公司。
1.2 实验方法
1.2.1 细胞培养及增殖活性检测(CCK-8法) A549、Hela细胞复苏后于含胎牛血清的10% DMEM-1640培养液中,37 ℃、体积分数为0.05的CO2培养箱中培养、扩增,取指数生长期细胞,计数、接种于96孔板培养12 h,100 μl/孔,细胞浓度7×103/100 μl。两类细胞均随机分为对照组和LPS组,对照组只加入培养液,实验组同时分别加入终浓度为5、10、20、40、80 mg/L的LPS,并设空白对照组(等体积的培养液中无细胞),对照组、空白对照组及每个浓度组均设5个复孔。恒温37 ℃、5 % CO2饱和湿度下分五批分别培养3、6、12、24、48 h后取出培养板,PBS冲洗10 min×3次,加入10 μl CCK-8试剂,按照CCK-8说明操作,酶标仪测490 nm处各孔的吸光度值(A490值),细胞相对增值率(P%)=(实验组A490-空白组A490)/(对照组A490-空白组A490)×100 %。
1.2.2 SPLUNC1免疫组织化学分析 将浓度为5×108/L的A549、Hela细胞等量接种于预先含有多聚赖氨酸包被小玻片的平皿中培养24 h,随机分为对照组和实验组,每组设5个平皿,对照组只加入培养液,实验组分别另加入两类细胞各自最佳效应浓度的LPS,恒温37℃、5% CO2饱和湿度下孵育一个最佳效应周期后取出。冷丙酮溶液室温固定30 min,PBS冲洗10 min×3次,0.1 %TritonX-100室温孵育30 min,PBS冲洗后3%过氧化氢37 ℃孵育15 min,滴加一抗SPLUNC1(1∶100)4 ℃过夜,生物素标记的二抗依次37 ℃孵育3 h,PBS充分冲洗,DAB染色、苏木精复染、乙醇脱水、二甲苯透明、中型树胶封片。以细胞内呈现黄色或棕褐色颗粒为阳性反应,随机计数300个细胞,Image-pro Plus软件量化分析阳性信号荧光强度(signal intensity, SI),以SI代表SPLUNC1的相对表达量。

2 结 果
2.1 LPS与细胞增殖的时效和量效关系 在不同浓度LPS作用下随着时间的延长(图1A),A549细胞吸光度值OD逐渐增大,6 h已有较为突出的显色,12 h时最大,其后明显下降,细胞相对增殖率的时间反应特征与OD类似(图1B),12 h为LPS刺激A549细胞的最佳处理时间,在整个观察期间,20 mg/L的LPS刺激A549细胞增殖的效应最强,为最佳效应浓度。Hela细胞的OD值随LPS作用时间延长逐渐增大,12 h即达到或接近峰值(图2A),但12~24 h改变幅度微小,24 h后则明显下降,可以认为12~24 h均为合适的处理时间,可供选择的时间范围较宽,增殖率的时间反应特征同样也与OD类似(图2B),40 mg/L的LPS为Hela细胞的最佳效应浓度。
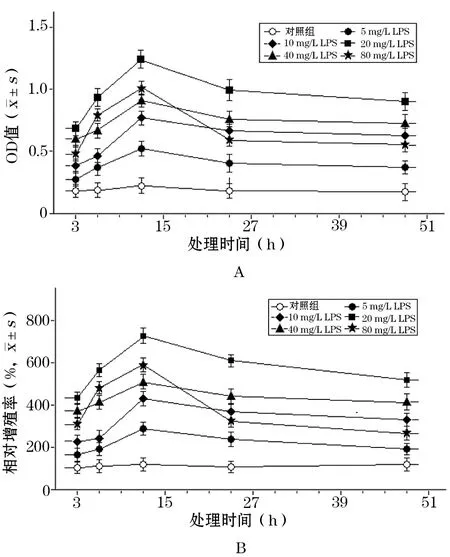
图1 LPS对A549细胞增殖的影响(CCK-8法)
2.2 LPS刺激前后SPLUNC1表达的变化 分别以20 mg/L、40 mg/L的LPS与A549细胞和Hela细胞共孵育12 h。SPLUNC1免疫组化染色显示,对照组A549、Hela细胞胞质及部分胞核呈现黄色,LPS实验组A549、Hela细胞呈现黄棕色(图3),两组均呈阳性表达;蛋白信号荧光强度检测显示,LPS刺激后A549、Hela细胞SPLUNC1的荧光强度(SI)分别为264.25±13.03和345.17±12.81,均显著高于对照组(130.54±11.97,145.52±12.35,P<0.05),两类细胞SPLUNC1的相对表达均明显上调。不同细胞间的比较显示,对照组两类细胞SI差异无统计学意义,实验组Hela细胞SI高于A549细胞(P<0.05)。

图2 LPS对Hela细胞增殖的影响(CCK-8法)

图3 A549细胞、Hela细胞SPLUNC1蛋白免疫组化染色(×400)
A.A549细胞(对照组);B.A549细胞(实验组);C.Hela细胞(对照组);D.Hela细胞(实验组)
2.3 LPS刺激A549、Hela细胞SPLUNC1表达的效应差别 以LPS处理后SPLUNC1蛋白信号强度(SI)的增量值(Δ)为参数,量化观察LPS对两类细胞SPLUNC1表达的效应,ΔSI=SI实验组-SI对照组,在A549细胞ΔSI=133.71±9.55,Hela细胞ΔSI=199.65±10.26,两类细胞ΔSI比较,差异有统计学意义(t=23.59,P<0.05),Hela细胞ΔSI明显高于A549细胞ΔSI。
3 讨 论
肺癌是全球范围内发病率和病死率最高的恶性肿瘤[7],宫颈癌已成为妇女第二大常见恶性肿瘤,其发病呈逐年上升和年轻化的趋势[8],严重威胁人类健康。炎性反应与癌症的发生、发展及预后关系密切[9,10],被认为是很多肿瘤的驱动,甚至是始发因素,不仅促进肿瘤发生,甚至“协助”癌细胞的转移[11],近年来,多项研究从流行病学、临床和基础实验的角度证实了炎性反应在肺癌[12]和宫颈癌[13,14]中的重要作用。基于新近发现,探讨新的“炎-癌”机制,寻找早期诊断标志物和干预靶点对深化两类癌症发病机制的认知、指导临床防治意义重大。
SPLUNC1是新发现的呼吸道特异性天然免疫分子,生理上主要参与宿主的呼吸道防御反应,其表达呈现出一定的组织特异性,主要见于呼吸道内胚层上皮,但其具体分泌部位及其他内胚层起源的上皮是否也存在分泌仍待更多深入细致的研究,浆液细胞、黏液细胞、导管细胞和杯状细胞等外分泌组织似乎都能检测到SPLUNC1的表达[15];病理上已有研究报道了SPLUNC1与呼吸道疾病和部分肿瘤的关联性[ 6]。Zhang等[16]课题组证实SPLUNC1下调microRNA-141表达,影响鼻咽癌细胞的凋亡、生长、转移和侵袭过程,推测SPLUNC1可能是一种抗癌因子,在非小细胞肺癌中Teeguarden等[5,6]发现SPLUNC1高表达的现象,Benlloch 等[17]则认为SPLUNCl是一种有效的非小细胞肺癌诊断标记物。
作为一种表面分泌蛋白,SPLUNC1不仅可以将病原微生物表面的病原相关分子模式递呈给宿主免疫细胞表面的模式识别受体,启动免疫应答,还可以产生抗菌活性物质来协助抵御外来物质的入侵[4,6,18]。宫颈上皮为内胚层起源的上皮,所处组织与外界环境相通,具有外分泌功能,其癌变与炎性反应存在很大相关性,研究证实,包括HPV在内的病原体的持续感染是宫颈癌发病的主要原因[13,14]。本研究细胞增殖实验显示,不同浓度的LPS对Hela细胞均显示了不同程度的增殖活性,且呈现浓度越高,增殖活性越高的趋势,进一步提示炎性反应在宫颈上皮细胞癌变增殖过程中的重要作用。免疫组化分析可见,Hela细胞中SPLUNC1呈阳性表达,在LPS炎性反应模型中其相对表达量显著上调,提示SPLUNC1不仅特异表达于呼吸道黏膜,在宫颈癌上皮细胞中也存在表达,炎性刺激后表达的上调表明SPLUNC1可能是宫颈癌“炎-癌”过程中的重要反应因子,结合其表面分泌免疫蛋白的特征,推测SPLUNC1的分泌可能是宫颈上皮癌变过程中的一种自我防御机制或预警信号,监测SPLUNC1表达或表达量的异常可能有助于宫颈癌的早期发现。
腺癌是非小细胞肺癌的一种类型,炎性反应与腺癌的发生、发展及预后都有着密切的关系[9-12]。腺癌主要起源于较小的支气管黏膜黏液上皮,这些上皮能够分泌SPLUNC1,参与形成黏膜免疫屏障。本研究发现,A549细胞中SPLUNC1呈阳性表达,在LPS炎性反应模型中表达上调,表明SPLUNC1在腺癌细胞分泌,炎性刺激癌细胞增殖的同时,SPLUNC1分泌增加,提示SPLUNC1可能参与到腺癌的病变过程中。综述其生物特性[6、19]和生物效应[6、17、20]的报道,支持SPLUNCl可能是一种抗癌因子,可以作为非小细胞肺癌诊断标记物的判断,但其抗癌机制及表达的调控尚缺乏足够的数据支持,对肺癌细胞的凋亡、生长、转移和侵袭过程的影响尚不清楚,有待于进一步深入探讨。此外,本文不同类型细胞SPLUNC1表达的比较显示,Hela细胞和A549细胞SPLUNC1的本底表达并无差异,但LPS刺激后Hela细胞SPLUNC1表达明显高于A549细胞,其表达的增量(Δ)也较A549细胞高,这可能与细胞种系或实验条件的差别有关[21-22],揭示其差异化表达的分子机制有助于深化对SPLUNC1生物功能和表达调控的认知。
需要指出的是,本研究的报道只是基于实验中的发现,研究结论的外推尚缺乏充分完整的证据链加以支撑,进一步的研究应在细胞学研究中匹配正常的细胞株系,引入SPLUNC1与炎性刺激量效关系和分子机制的设计,并开展组织水平的检测和在体的实验观察。
