丹参和藏丹参毛状根MYB和bHLH转录因子基因表达差异研究
2019-09-24王艳婷郭妍宏王飞艳方誉民夏鹏国梁宗锁杨东风
王艳婷,郭妍宏,王飞艳,方誉民,夏鹏国,梁宗锁,杨东风
(浙江理工大学生命科学与医药学院,浙江省植物次生代谢调控重点实验室,浙江 杭州 310018)
丹参是唇形科鼠尾草属植物丹参(SalviamiltiorrhizaBunge)干燥根和根茎,具有保护心脑血管、抗肿瘤、抗氧化、抗炎、抗纤维化等作用[1-2]。藏丹参(SalviacastaneaDiels f.tomentosaStib)产于西藏林芝地区,当地医师把它的根和根茎作为丹参的替代品使用[3]。二氢丹参酮Ⅰ(dihydrotanshinone Ⅰ)、隐丹参酮(cryptotanshinone)、丹参酮Ⅰ(tanshinone Ⅰ)和丹参酮ⅡA(tanshinone ⅡA)等丹参酮和迷迭香酸(rosmarinic acid)、咖啡酸(caffeic acid)和丹酚酸B(salvianolicacid B)等酚酸是丹参的活性成分[4]。萜类化合物是植物次生代谢物质中最大的一个家族,其生物合成途径包括发生在胞质的甲羟戊酸途径(MVA)和发生在质体的赤藓糖磷酸途径(MEP)[5]。酚酸生物合成与苯丙烷途径和酪氨酸途径有关。藏丹参和丹参活性成分相似,但含量差异较大。丹参的丹酚酸B含量更高,藏丹参丹参酮ⅡA和迷迭香酸的含量更高[6],然而两种丹参活性物质积累差异的形成机制尚不明确。
转录因子可以整合内部(通常是发育)和外部(环境)信号来调节酶基因表达,从而控制次级代谢物的特定积累[7]。MYB和bHLH转录因子广泛参与苯丙烷类代谢途径和萜类代谢途径的调控,欧芹、玉米、金鱼草、拟南芥、苦荞麦和矮牵牛中黄酮类的合成均受MYB转录因子的调控[7-9],MYB转录因子也参与调控了丹参、拟南芥、火炬松中萜类化合物的合成[10-12];金鱼草、龙胆中黄酮类的合成均受bHLH转录因子的调控[13-14];bHLH转录因子调控红豆杉和丹参中萜类成分,长春花和黄连中生物碱类成分的积累,也已有报道[15-19]。本文通过比较紫花丹参和藏丹参毛状根中MYB和bHLH基因表达的差异,分析可能参与调控丹参酮和丹酚酸的转录因子基因,以期揭示藏丹参和紫花丹参次生代谢的差异机制,为丹参酮和丹酚酸的合成及其调控奠定基础。
1 材料与方法
1.1 材料与仪器
材料:发根农杆菌ATCC15834侵染丹参和藏丹参无菌苗获得丹参和藏丹参毛状根(种质来源由浙江理工大学生命科学学院梁宗锁教授鉴定)。
基因和蛋白序列:GenBank数据库中搜索(https://www.ncbi.nlm.nih.gov/)。
试剂:多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司),反转录试剂盒 PrimeScriptTMRT reagent Kit和荧光定量PCR试剂盒SYBR Premix ExTaqTMⅡ(TaKaRa公司),荧光定量PCR引物由杭州擎科梓熙生物技术有限公司合成。
仪器:荧光定量PCR仪(QuantStudio 6 Flex,ABI)。
1.2 蛋白序列系统进化分析
采用MEGA7.0中的NJ(Neighbor-joining)法构建系统发育进化树,参数选择Bootstrap为1 000。
1.3 实验方法
1.3.1 丹参毛状根培养
配制MS液体培养基,调pH值至5.8;0.2 g新鲜的毛状根被转至培养基中,在恒温摇床中暗培养(25 ℃、110 r·min-1)24 d后采样。
1.3.2 基因表达分析
参照多糖多酚植物总RNA提取试剂盒说明书提取总RNA后进行反转录(PrimeScriptTMRT reagent Kit)。采用SYBR Premix ExTaqTMⅡ进行荧光定量PCR反应,引物序列见表1,SmActin基因用作内参。反应条件为:95 ℃、30 s;95 ℃、5 s,58 ℃、30 s,40个循环。基因表达分析用比较CT法(2-ΔΔCT)。
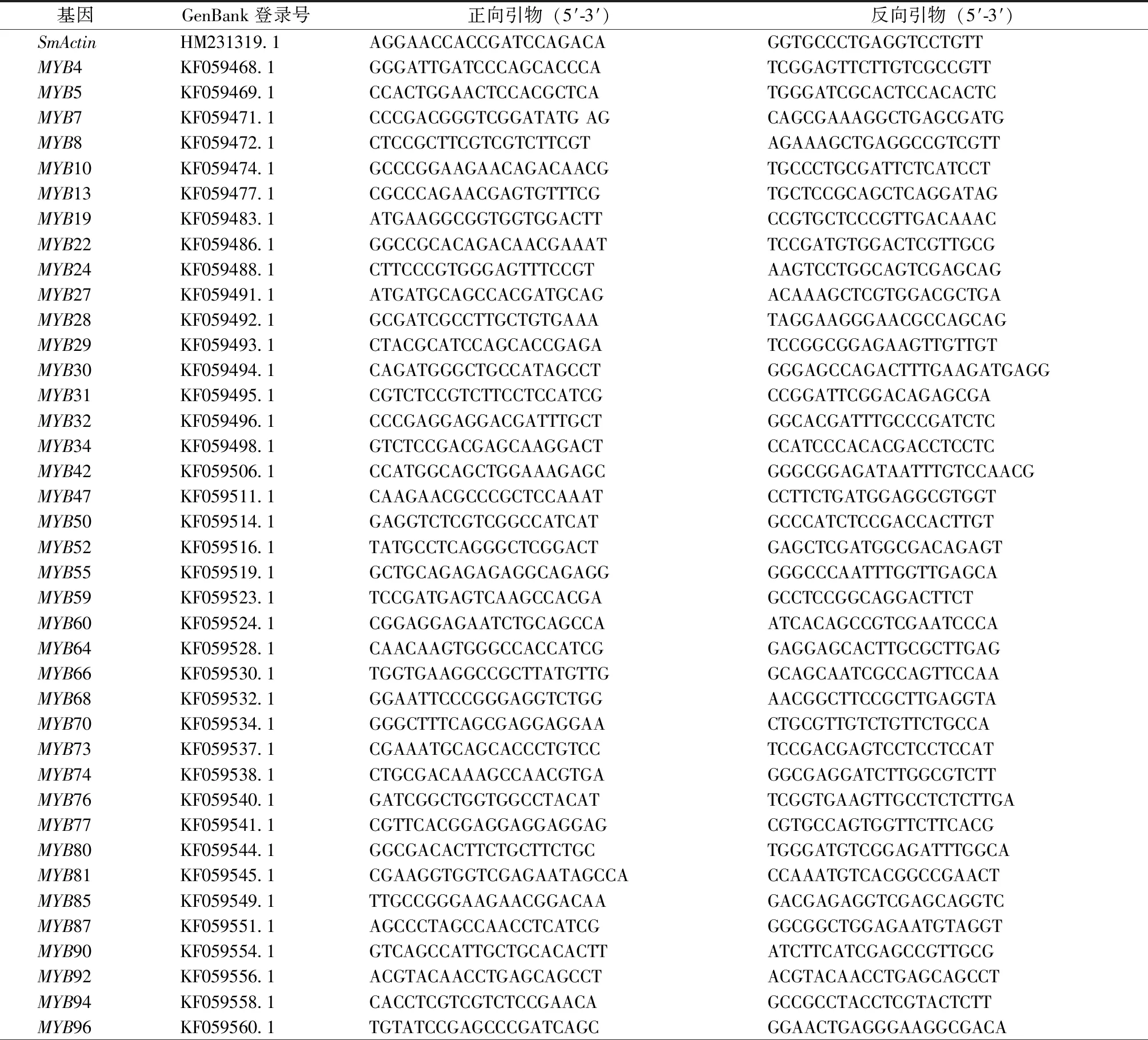
表1 实时荧光定量PCR引物

表1(续)
1.3.3 数据分析
使用GraphPad Prism7作图,数据以平均值±标准差表示,3个生物学重复。
2 结果与讨论
2.1 藏丹参和丹参毛状根中MYB表达差异
MYB转录因子不仅仅在植物细胞形态及模式建成、生长发育、逆境胁迫的应答中发挥重要的作用,在生理活动代谢、初生和次生代谢反应的调节也扮演者重要角色[20]。自从第一个MYB转录因子MYBC1(和细胞色素合成有关)在玉米中被鉴定[21],各类MYB基因从各种植物中分离鉴定。截至2019年3月17日,NCBI(National Center for Biotechnology Information)中MYB基因已至59 586条。MYB是调节丹参酮和丹酚酸的调控因子。为了研究不同的转录因子在藏丹参和丹参的表达差异,对47个MYB转录因子基因进行了基因表达分析。结果表明,24个MYB(SmMYB60、SmMYB98、SmMYB87、SmMYB29等)在丹参中的表达显著高于藏丹参,其中SmMYB60表达高达藏丹参的1 726.23倍,SmMYB98表达高达707.33倍(图1中a)。SmMYB42、SmMYB34、SmMYB107、SmMYB85等4个MYB基因(图1中c)在藏丹参中表达较高,分别高达丹参2.45、4.24、5.95、114.90倍。SmMYB96、SmMYB94、SmMYB80、SmMYB64等19个基因(图1中b)表达在两种丹参中表达差异不显著。
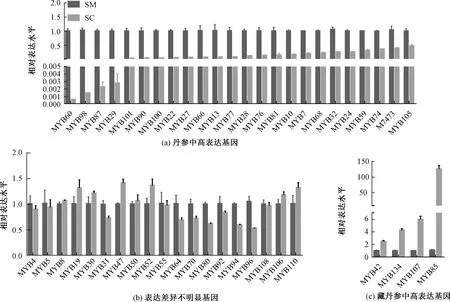
SM,丹参;SC,藏丹参。图3同。图1 MYB基因的表达模式
Li等[11]首次对丹参中MYB转录因子做了系统的分析,他们报道了110个R2R3-MYB基因,并且预测第4、5和20亚组的SmMYB可能参与调控了萜类化合物生物合成[11]。SmMYB36转录因子基因是一个典型的R2R3转录因子,SmMYB36含有第四和第五亚族特有的DNEI结构,团队前期克隆得到了SmMYB36转录因子基因,发现过表达SmMYB36促进了丹参酮的积累,但抑制了丹参中酚酸和类黄酮的生物合成[22]。序列分析SmMYB36和SmMYB34进化树在同一分支(图2),实验表明,SmMYB34在藏丹参中的表达量是丹参的4.43倍,SmMYB34可能与藏丹参对丹参酮的高积累有关。SmMYB39转录因子基因[23]和Li等[11]注释的SmMYB76基因属于同一条基因,为第4亚组[11],研究表明,SmMYB76可以抑制丹酚酸的积累。在本研究中SmMYB76和SmMYB28在同一分支(图2),与前人研究一致[11],本实验中它在丹参中的表达量是藏丹参的8.18倍,这很可能与藏丹参低丹酚酸B积累有关。
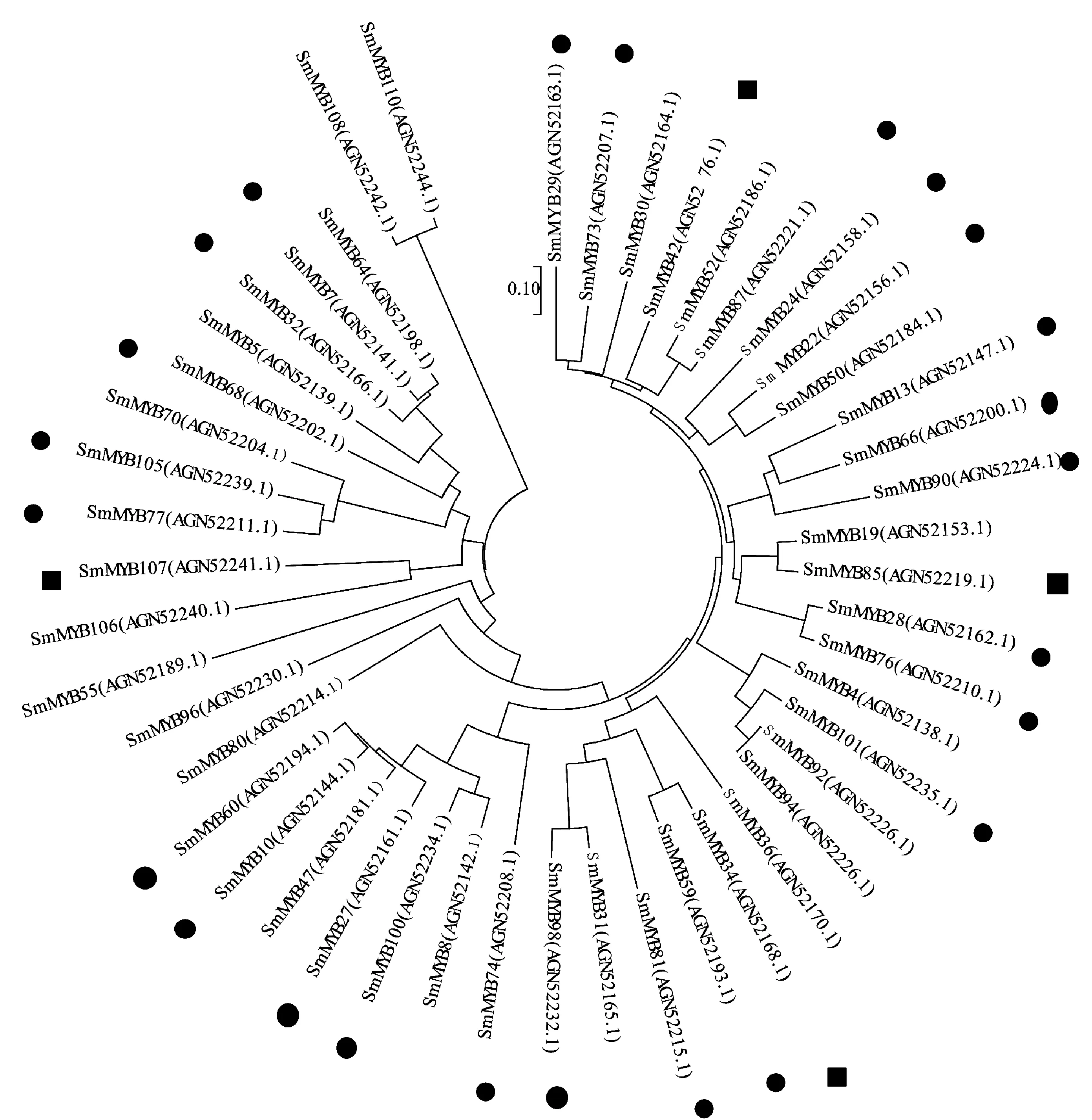
●丹参中表达量较高;■藏丹参中表达量较高。图4同。图2 丹参MYB转录因子系统进化树
丁庆倩等[24]从大豆中鉴定出一个在胁迫条件下明显上调的MYB类转录因子SiMYB42。藏丹参(海拔2 900~3 500 m林芝地区)相对丹参(平原)面临更多的高UV-B辐射等逆境压力[25]。研究发现,酵母提取物和水解乳蛋白可以提高藏丹参和丹参中丹参酮的含量,并且藏丹参对酵母提取物的影响反应更大[26-27]。在玉米种MYB42与木质素含量的负调节有关[28],木质素和酚酸生物合成都源于苯丙烷途径。在本实验中SmMYB42在藏丹参中的表达量是丹参的2.45倍,根据这些,推测SmMYB42在酚酸的积累过程发挥着重要的作用。
研究发现,过表达SmMYB98b毛状根株系中丹参酮含量和丹参酮合成通路关键酶基因的表达都有所提高。干扰SmMYB98b毛状根株系中丹参酮含量和丹参酮合成通路关键酶基因的表达都被抑制[29]。在本实验中在丹参中的表达量高达藏丹参的707.33倍,SmMYB98可能酚酸的积累过程也扮演重要的角色。在草莓中FaMYB10正调节花青素的积累[30],花青素等酮类的合成与酚酸的合成都依赖于PAL途径,本实验中SmMYB10在丹参中的表达量高达藏丹参的6.12倍,MYB10转录因子基因也可能是酚酸积累的一个重要调控因子。在苹果中MYB22过表达株系花青素的积累和CHS、CHI、F3H等花青素通路关键酶基因的表达都被抑制,本实验中SmMYB22在丹参中的表达量高达藏丹参的16.79倍,SmMYB22可能与藏丹参高迷迭香酸积累有关。
2.2 藏丹参和丹参毛状根bHLH表达差异
bHLH转录因子家族是植物中最大的转录因子家族之一,参与调控了黄酮类化合物,生物碱和萜类化合物的生物合成。已发现10 907多个bHLH转录因子,已经完成系统性鉴定和分类的有拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)和烟草(NicotianatabacumL.)等[31-33]。为了研究不同的转录因子在藏丹参和丹参的表达差异,对47个bHLH转录因子进行了分析。结果表明,15个SmbHLH(SmbHLH69、SmbHLH33、SmbHLH123、SmbHLH96等)在丹参中的表达量显著高于藏丹参,其中SmbHLH69表达高达藏丹参的1 727.61倍,SmbHLH33高达29.72倍(图3中b)。SmbHLH48、SmbHLH46、SmbHLH79、SmbHLH108、SmbHLH73和SmbHLH77等6个bHLH基因(图3中c)在藏丹参中表达量较高,分别高达丹参中表达量的2.51、3.36、8.95、12.36、34.02和124.67倍。SmbHLH121、SmbHLH10、SmbHLH29、SmbHLH26等26个基因(图3中a)在两种丹参中表达量差异不显著。
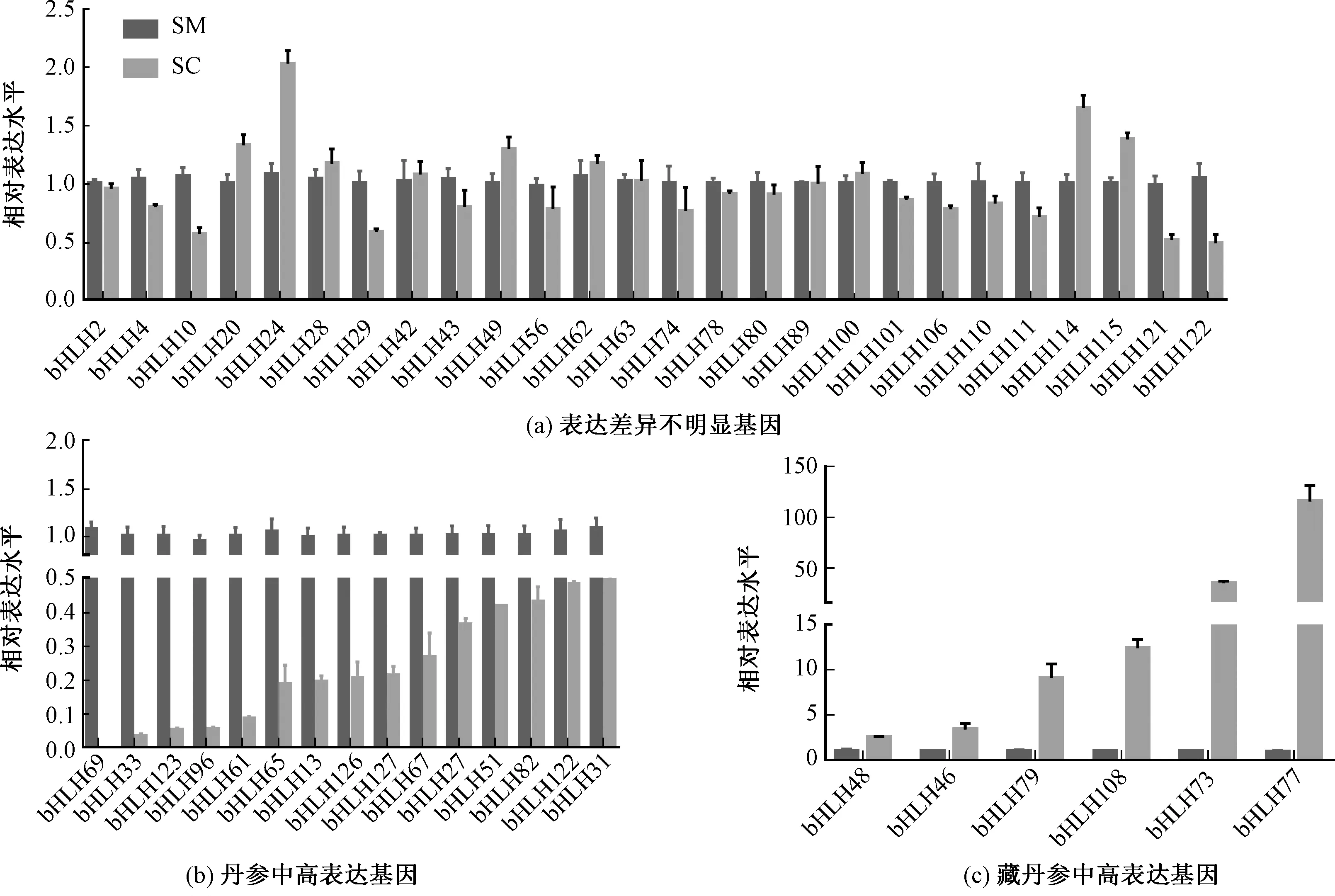
图3 bHLH 基因的表达模式
Zhang等[34]从丹参基因组中筛选出127个bHLH转录因子并进行了系统的分析。他们预测7个可能调节丹参酮生物合成的基因,分别为SmbHLH37(亚族R)、SmbHLH51(亚族R)、SmbHLH53(亚族R)、SmbHLH60(亚族W)、SmbHLH74(亚族H)、SmbHLH92(亚族P)和SmbHLH103(亚族P)。丹参SmbHLH10转录因子基因,它和SmbHLH83基因属于同一条基因[35-36],前期研究表明,SmbHLH83可以促进丹参酮的的积累[23],在本研究的进化树中单独一个分支(图4),但它在藏丹参和丹参中表达量差异不显著,推测SmbHLH83可能不是藏丹参和丹参次生代谢产物积累差异的主要原因。前人的研究表明,SmbHLH48和SmbHLH74同属亚族H[34],bHLH48和SmbHLH74序列相似,并且bHLH48在藏丹参中的表达量是丹参的2.51倍,bHLH48可能和藏丹参高丹参酮积累有关。
拟南芥MYC2[35]调节倍半萜合酶基因表达,并且丹参酮和倍半萜烯都是萜类化合物[35]。构建邻接系统发育树时发现bHLH51[34]和NtMYC2a,NtMYC2b和CrMYC2在相同的亚家族,并且SmbHLH51在根中表达水平比在其他3个器官的表达水平高,在用茉莉酸处理后呈上调的趋势。SmbHLH51在丹参中的表达量是藏丹参的2.78倍,SmbHLH51在丹参酮生物合成中具有一定的调节作用。梨的红色是花青素积累的结果,SmbHLH33参与花色素苷生物合成的差异调节[36],定量结果显示SmbHLH33在丹参中的表达量高达藏丹参的29.72倍,苯丙烷代谢也是黄酮类化合物(例如花青素、黄酮、黄酮醇及其糖苷)的上游途径,花青素都与酚酸生物合成共享相同的前体[37],SmbHLH33可能参与迷迭香酸和丹酚酸B的生物合成。拟南芥中miR393靶向转录因子bHLH77和生长素受体TIR1,AFB(1,2,3)[38],生长素在植物的生长发育中发挥着重要的作用,SmbHLH77在藏丹参中的表达量高达丹参的155.41倍,可能间接的调节丹参次生代谢物质的积累。AtbHLH122转录因子可以调控ABA的积累来参与植物适应逆境胁迫。有研究表明,施用适量的赤霉素能促进丹参的生长和丹参根中丹参酮类物质的积累。SmbHLH122在丹参中表达量仅仅是藏丹参的2.16倍,暗示转录因子可能不是藏丹参高丹参酮积累的关键转录因子[39]。
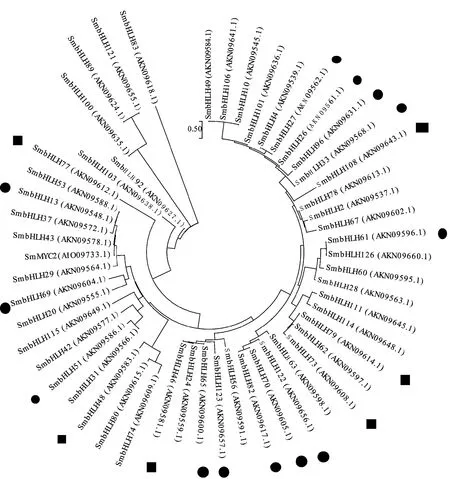
图4 丹参bHLH转录因子系统进化树
3 小结
本研究采用荧光定量PCR分析了MYB和bHLH转录因子在藏丹参与丹参毛状根中的表达差异,结果表明:有24个MYB(SmMYB60、SmMYB98、SmMYB87、SmMYB29等)和15个SmbHLH(SmbHLH69、SmbHLH33、SmbHLH123、SmbHLH96等)在丹参中高表达,有4个MYB(SmMYB96、SmMYB94、SmMYB80、SmMYB64)和6个SmbHLH(SmbHLH48、SmbHLH46、SmbHLH79、SmbHLH108、SmbHLH73和SmbHLH77)在藏丹参中高表达。这些差异表达的转录因子可能参与调控了丹参酮和丹酚酸的积累,导致藏丹参和丹参次生代谢的差异。但是这些转录因子是如何参与代谢目前还不太清楚,需要做进一步的研究。本研究为揭示丹参和藏丹参的差异以及丹酚酸、丹参酮的生物合成机制奠定了基础。
