microRNA-125b对胰腺癌侵袭转移的影响及其机制*
2019-09-20许伟先何志伟喻超田舍陈世裕潘耀振孙诚谊
许伟先,何志伟,喻超,田舍,陈世裕,潘耀振,孙诚谊**
(1.贵州医科大学,贵州 贵阳 550004;2.贵州医科大学附院 肝胆外科,贵州 贵阳 550004;3.贵州医科大学 肝胆胰脾重点实验室,贵州贵阳 550004;4.贵州省肝胆胰脾疾病研究所,贵州 贵阳 550004)
胰腺癌(pancreatic caner,PC)是一种恶性程度极高、早期不易诊断、预后极差的消化系统肿瘤[1],由于PC早期发病症状隐匿、进展迅速,大多数PC患者在明确诊断前就已经发生了远处转移,丧失了根治性手术治疗的机会;即使接受手术治疗,患者5年生存率仍远低于其他恶性肿瘤。导致PC预后极差的主要原因是PC的早期侵袭及转移能力较强[2],且其发生发展的分子机制仍未明确[3]。最近研究表明,miRNA在多种肿瘤中存在不同程度的异常表达,并在肿瘤的发生进展中起到了尤为重要的作用[4]。microRNA(miRNA)是一种非编码小RNA分子,由19~25个核苷酸组成,通过与靶基因结合可抑制相关蛋白质的翻译或促使其降解;miRNA还与其靶基因形成复杂的生物信息调控网络,参与细胞增殖、凋亡、细胞运动及代谢等多种生物学功能[5-7]。miR125b在多种肿瘤中低表达、且发挥着重要的生物学功能,然而其在PC中的研究目前尚未清楚[8-11]。本研究通过在PC细胞中过表达miR-125b,初步探究miR-125b在PC细胞侵袭转移中扮演的角色及其机制。
1 材料与方法
1.1 细胞株及主要试剂
人PC细胞株 PANC-1细胞及胰腺正常导管上皮细胞株均由华中科技大学附属同济医院胆胰外科实验室馈赠,高糖DMEM培养基、胎牛血清购自美国赛默飞世尔公司,miR-125b过表达载体(miR-125b mimic)及空白载体(miR-125b NC)购自广州锐博生物科技有限公司,PCR相关试剂购自上海生工生物有限公司,Matrigel基质胶购自美国 BD公司,E- cadherin及Vimentin抗体购自美国 CST公司,Transwell小室及六孔板购自美国 Corning公司,细胞骨架探针购自美国 Sigma公司。
1.2 方法
1.2.1细胞培养 将细胞在培养箱10%胎牛血清的培养基、37 ℃、5% CO2恒温中培养,视细胞的生长情况更换新鲜培养基传代培养或继续培养。
1.2.2转染 将生长良好的PANC-1细胞进行胰酶消化后并制成5×108/L的细胞悬液,分别接种于两个6 cm培养皿,待细胞长满至70%(处于对数生长期)时,分别将 miR-125 b mimic和miR-125b NC转染入相应的培养皿培养4~6 h,再更换培养液后继续培养48 h,提取细胞 RNA,采用实时荧光定量聚合酶链反应验证转染效率后进行后续实验。
1.2.3细胞划痕实验 将生长良好的 PANC-1细胞种植于六孔板,待细胞长满至60%时进行转染,待细胞长满时、垂直划线,并分别在倒置显微镜下观察0、24、48及72 h时细胞生长状况。研究设立阴性对照组(NC组,即转染miR-125b NC的PANC-1细胞)及空白对照组(BC组,即胰腺正常导管上皮细胞)。
1.2.4Transwell小室侵袭及迁徙实验 提前30 min将 Matrigel基质胶与培养基(不含胎牛血清)按1∶8稀释,于小室上室铺胶,置于37 ℃培养箱,选取生长良好的PANC-1细胞制备细胞悬液,采用不含胎牛血清培养基重悬细胞,计数并调整密度为2×108/L,每个小室中加入细胞悬液200 μL,加入含10%胎牛血清培养基700 μL至下室,培养箱中恒温培养24~36 h,用磷酸盐缓冲液洗涤2次,4%的多聚甲醛固定30 min,0.1%结晶紫染色30 min,棉签去除上室面细胞,晾干、拍照。Mage J软件处理图片数据。
1.2.5细胞骨架免疫荧光转染实验 取生长处于对数期的过表达miR-125b PANC-1及转染空载体miR-125b PANC-1细胞重悬,调整细胞密度为1.5×108/L,用共聚焦培养皿继续培养,待其贴壁后固定、破膜、封闭,荧光染色2 h,碱性磷酸盐缓冲液进行洗涤,重复3次,DAPI染色5~10 min后,再次脱色并封片,置于共聚焦激光显微镜下观察。
1.2.6上皮-间质细胞转化(EMT)相关蛋白表达 收集转染72 h时的 PANC-1细胞,按照蛋白提取试剂盒说明提取蛋白,取30 μg蛋白样品上样,然后电泳、转膜、封闭、一抗4℃过夜、洗膜、二抗孵育2 h、再洗膜、加入ECL试剂显影,在暗室中压片获得显影后的底片,在成像系统中照相,用Mage J软件计算条带相对灰度值,实验重复3次。
1.3 统计学处理
2 结果
2.1 miR-125b对PANC-1细胞迁移能力的影响
如图1所示,72 h时过表达miR-125 b的PANC-1细胞细胞相对迁移率为(53±8.16)%,显著低于NC组(76.84±9.28)%,差异有统计学意义(P<0.05)。
2.2 miR-125b对PANC-1细胞侵袭迁移能力的影响
如图2显示,在PCPANC-1细胞中,BC组及NC组发生侵袭转移的细胞数量显著高于miR-125 b组,差异具有统计学意义(P<0.05)。
2.3 miR-125b对PANC-1细胞骨架的影响
如图3所示,过表达miR-25b PC PANC-1细胞中的F-肌动蛋白形态紊乱、且方向杂乱,提示其运动能力和极性的缺失,迁移能力减弱。
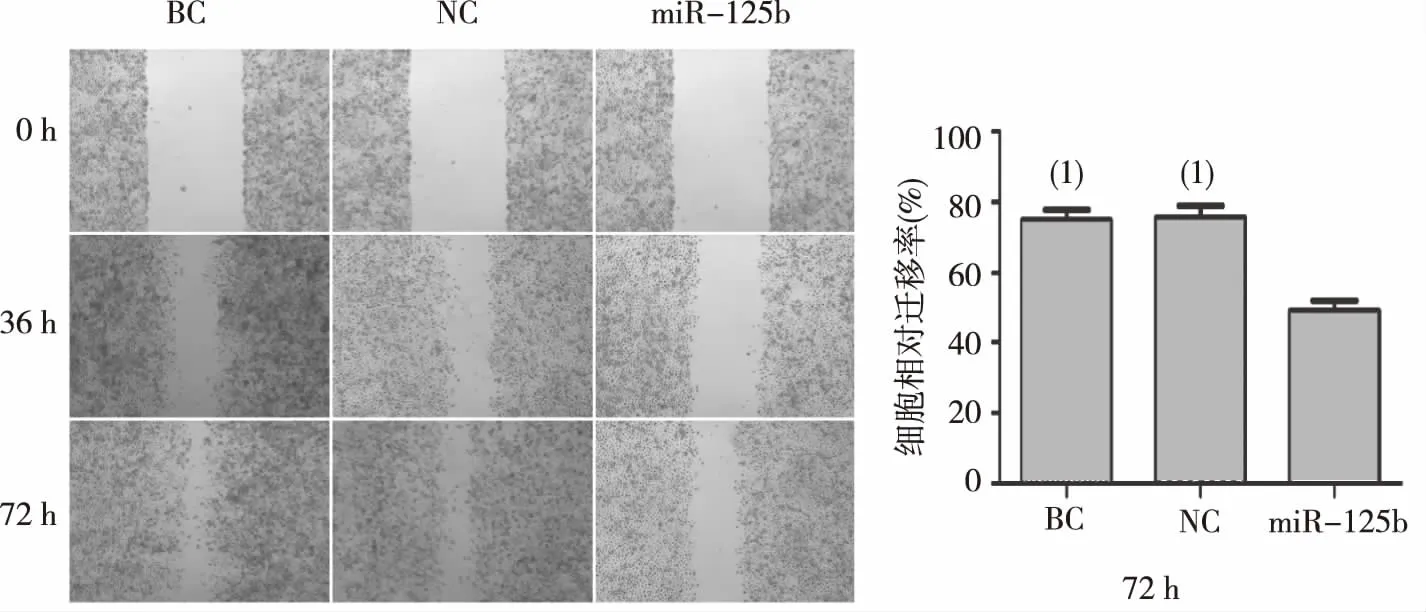
注:(1)与miR-125b组比较,P<0.05。图1 miR-125b对PANC-1细胞迁移能力的影响(细胞划痕实验)Fig.1 Effect of miR-125b expression on migration of pancreatic cancer cells
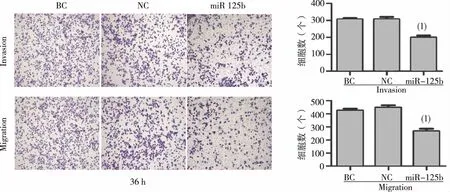
注:(1)与BC组及NC组比较,P<0.05图2 miR-125b对PANC-1细胞迁移、侵袭能力的影响(Transwell实验)Fig.2 Effects of miR-125b expression on migration and invasion of pancreatic cancer cells
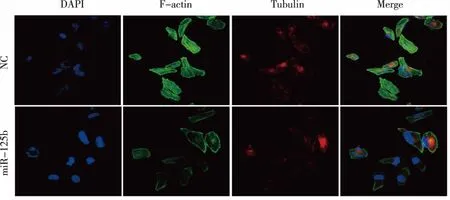
图3 过表达miR-125b对PANC-1细胞骨架的影响(细胞骨架免疫荧光实验)Fig.3 Effect of miR-125b expression on the cytoskeleton of pancreatic cancer cells
2.4 E-cadherin及Vimentin蛋白表达
如图4结果显示,与NC组比较,转染miR-125b mimic后的PANC-1细胞中E-cadherin表达显著上调,而Vimentin表达显著下调(P<0.05)。提示PANC-1细胞在过表达miR-125b后,细胞EMT受到抑制,这可能是细胞侵袭能力下降的机制之一。
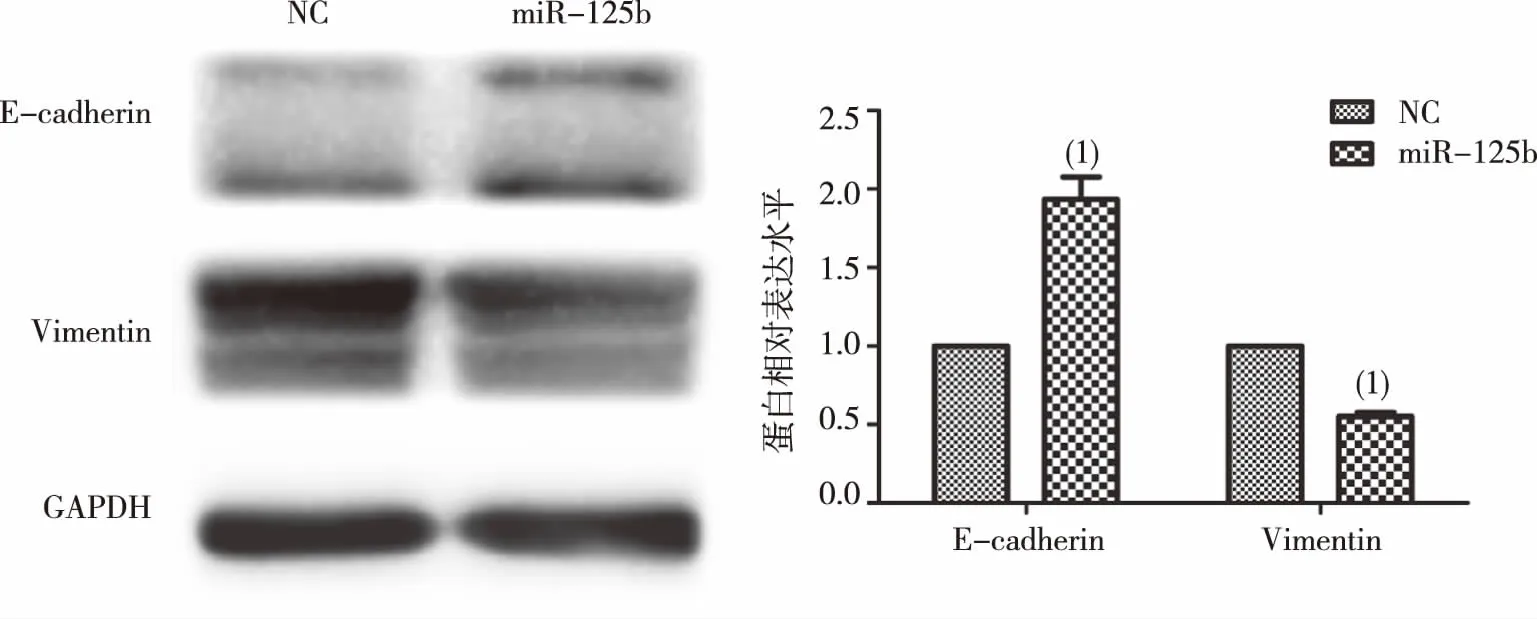
注:(1)与NC组比较,P<0.05。图4 miR-125b对PANC-1细胞侵袭转移相关蛋白表达水平的影响(Western blot实验)Fig.4 Effect of miR-125b on the expression of E-cadherin and vimentin
3 讨论
PC是发病隐匿,较难早期诊断的消化道最常见的恶性肿瘤之一,很大一部分原因是其解剖位置较深及侵袭转移能力较强[13]。近年来PC发生发展可能存在的相关机制已引起了本研究小组的高度关注,并已通过组织芯片技术筛选出几组在PC中表达有显著差异的 miRNAs,并就 miRNAs在PC的增殖、侵袭、“干性”等多方面进行了初步研究[4]。miRNA是一种约由19~25个核苷酸组成的非编码小RNA分子,可以通过结合靶基因mRAN的方式对基因的表达进行调控。研究发现,miRNA通过转录后调控影响肿瘤的生长情况。越来越多的研究发现,miRNA在包括肿瘤在内的多种疾病中有着至关重要的地位。 MiR-125 b在乳腺癌[15]、胃癌[16]、肺癌[17]等肿瘤是低表达的,并有研究表明其能影响上述肿瘤的增殖、侵袭转移,表明其在肿瘤的发生发展可能存在至关重要的影响。有研究表明,miR-125b在胃癌中直接靶向作用于MCL1从而抑制肿瘤的增殖与侵袭转移[18]。本课题组也发现,miR-137、miR-1181、miR-29c分别与PC侵袭转移能力,化疗耐药及干样表型相关[19-22]。然而miR-125b在PC中究竟起到什么作用,目前仍未有明确的结论。本研究通过上调细胞中miR-125b的表达来观察PC细胞侵袭能力的变化,同时发现上调miR-125b后,细胞EMT过程受到抑制。但miR-125b影响PC侵袭转移的具体机制仍需要进一步研究。
本研究首先构建 miR-125 b mimic并转染PC细胞系 PANC-1,上调 miR-125 b在PC细胞系 PANC-1中的表达,并通过 Transwell、细胞划痕实验得出过表达 miR-125 b后,PANC-1细胞相对于阴性对照组细胞迁移率明显降低,空白组及对照组差异无统计学意义,初步证实上调miR-125 b对PC细胞的侵袭及迁移能力有显著抑制作用;通过激光共聚焦观察对照组与过表达组细胞骨架发现,上调miR-125 b后,运动结构缺如,细胞骨架形态杂乱,细胞极性消失,迁移能力减弱,细胞运动能力下降。最后,通过 western blot检测miR-125 b对PC细胞 EMT相关蛋白的影响,即过表达miR-125 b,E-cadherin显著增加,而Vimentin表达减少,细胞上皮间质化受到抑制,细胞侵袭能力可能下降。
综上,miR-125b可能通过影响细胞EMT,进一步抑制PC细胞的侵袭转移,从而为PC的诊疗提供新的靶点。然而PC细胞侵袭转移能力受miR-125b调控的具体通路机制仍然不明,需要进一步探讨。
