生长调节剂对红豆杉内生真菌产紫杉醇的影响
2019-09-17赵赟鑫张欢张颜青
赵赟鑫 张欢 张颜青
摘要:根据紫杉醇的结构特点和红豆杉中紫杉醇的合成机制,选取4种生长调节剂,研究其对红豆杉内生真菌合成紫杉醇的影响。结果表明,在发酵过程的第10天,补加下列任一生长调节剂,使发酵液中初始浓度分别达到水杨酸20.0 mg/L,茉莉酸甲酯100.0 μmol/L,赤霉素2.0 mg/L,矮壮素2.0 mg/L,均能提高紫杉醇产量。同时,在发酵过程的第10天补加蔗糖,在含量不高于15 g/L时,对紫杉醇的积累和菌丝体生长具有促进作用,但是高于此浓度时,菌丝体生长受抑制,紫杉醇含量降低。
关键词:红豆杉;紫杉醇;内生真菌;生长调节剂
中图分类号: Q939.9 文献标志码: A 文章编号:1002-1302(2019)07-0120-04
近年来,红豆杉产紫杉醇的研究进展很快,国内外利用内生真菌产紫杉醇的研究报道逐渐增多,目前内生真菌产紫杉醇的含量普遍偏低,国内外学者也正在不断探索能够提高内生真菌产紫杉醇产量的途径[1-2]。
诱导子是一种能诱导植物细胞中一种或多种反应并形成特征性自身防御反应的分子,是能够引起植物过敏反应的物质,其在与植物的相互作用中,能够快速、高度专一和选择性地活化植物次级代谢途径中特定酶的基因或改变次级代谢途径中催化酶的酶活力,诱导植物形成新酶,进而活化特定次生代謝途径,引起反应速率和次级代谢途径通量的改变,从而积累特定目的次级的代谢物,因此可以利用诱导子来提高植物次生代谢产物的产量[3]。
紫杉醇是红豆杉属植物及其内生真菌产生的次级代谢产物,非生物或生物诱导子可诱导细胞产生抗逆反应,启动次级代谢途径,进而合成大量的紫杉醇。通常,诱导子对红豆杉细胞的生长均有抑制作用,因而添加时间、添加浓度对诱导子作用的最终效果非常关键[4]。添加代谢抑制剂,以抑制一些与紫杉醇生物合成无关的次级代谢途径为目的,通过添加某些代谢旁路抑制剂,将细胞的物质和能量导向紫杉醇生物合成途径,从而提高紫杉醇的产量。当然,代谢抑制剂也存在一个最佳添加浓度和最佳添加时间[5]。
大量研究表明,在对数生长末期添加前体物质、诱导子及代谢抑制剂的效果最好,因为此时细胞已得到较好的增殖,而且在此阶段,植物细胞接受生长调节物质的信号能力最强[6]。
作者采用课题组自行分离的紫杉醇高产菌株绿僵菌(Metarhizium anisopliae) LB-10[7],在对其培养基组成和配比[8]、发酵条件研究[9]的基础上,根据紫杉醇的结构特点和红豆杉中紫杉醇的合成机制,选取4种生长调节剂,研究其对红豆杉内生真菌合成紫杉醇的影响。
1 材料与方法
1.1 材料
1.1.1 菌株 红豆杉内生真菌Metarhizium anisopliae LB-10是分离自陕西省汉中市留坝县野生红豆杉的高产紫杉醇内生真菌。
1.1.2 培养基 斜面培养基:马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,水1 L,pH值自然;种子培养基:马铃薯葡萄糖肉汤(PDB)培养基:马铃薯200 g,葡萄糖20.0 g,水1.0 L,pH值6.0~8.0;发酵液:葡萄糖50.0 g/L,NH4NO3 6.0 g/L,无水MgSO4 0.3 g/L,KH2PO4 0.5 g/L,维生素B1 5.0×10-2 g/L。
1.1.3 药品与试剂 紫杉醇标准品(≥98%)、乙酸乙酯、甲醇、葡萄糖、NH4NO3、KH2PO4、MgSO4·7H2O、苯甲酸钠、苯丙氨酸、乙酸钠、酪氨酸。
1.1.4 主要仪器 高效液相色谱仪(LC 2000),旋转蒸发仪(RV-10,IKA),电子天平(TB-214),双层恒温干燥培养振荡器(ZHWY-2102C),人工气候箱(LRH-250-G-S),数控超声波清洗仪(KQ-5200-DE)。
1.2 方法
1.2.1 培养方法 种子液培养方法:在新鲜斜面上取 5 mm×5 mm大小的已纯化的菌块,接种到装有50 mL发酵培养基的250 mL三角瓶中,于25 ℃、180 r/min摇床培养 3 d。
发酵培养:将培养好的种子液混匀,按3%接种量接种到装有330 mL发酵培养基的500 mL三角瓶中,每次提取所用发酵液的量为1 000 mL,于28 ℃、180 r/min摇床培养10 d。
1.2.2 紫杉醇样品的提取 通过对培养10 d的发酵液进行抽滤,使其分离为菌液和菌丝体2个部分,菌丝用乙酸乙酯在超声条件下萃取,菌液用乙酸乙酯通过分液漏斗萃取,分别重复3次,合并收集到的乙酸乙酯相,并用双层滤纸过滤,滤液在40 ℃下旋转蒸发至干,样品用甲醇溶解并且定容至 10.0 mL,检测。
1.2.3 紫杉醇的HPLC检测 紫杉醇标准品用甲醇定容至10.0 mL,配制成0.01~0.16 mg/mL的浓度梯度,绘制标准曲线。精确称取紫杉醇标准品4.0 mg,甲醇定容至10.0 mL,从而得到母液浓度为0.4 mg/mL,将母液依次稀释成浓度梯度为0.01、0.02、0.04、0.08、0.16 mg/mL,取20.0 μL进样(N=5),得到回归方程为y=6.087 8+3 589.391 3x,r=0.999 222。建立标准曲线,如图1所示,采用外标法测定内生真菌发酵产物的乙酸乙酯抽提物中紫杉醇的含量。
色谱条件:水-甲醇-乙腈(体积比33 ∶ 35 ∶ 32)为流动相,检测波长为228 nm,流速为1.0 mL/min,进样量为 20.0 μL,柱温为室温,色谱柱:C18(4.6 mm×150 mm)。
紫杉醇含量的计算公式:发酵液中紫杉醇含量(μg/L)=[甲醇中紫杉醇含量(mg/mL)×溶解提取物所用甲醇体积(mL)×106]/提取时所取发酵液体积(mL)。
每次提取的紫杉醇均做3个平行样,分别经HPLC测定并通过公式计算发酵液中紫杉醇的含量,求其平均值。
1.2.4 生物量的测定 取一定体积的发酵液4 800 r/min离心20 min,菌丝体用蒸馏水洗涤2次,收集菌丝体,置于80 ℃烘箱中烘干至恒质量,称量,计算菌丝体生物量。
1.2.5 添加诱导子的研究方法 以水杨酸为诱导子,采用蒸馏水作为助溶剂,在菌株LB-10对数生长末期即第10天,添加水杨酸水溶液,使发酵液中其初始浓度分别达到5.0、10.0、20.0、40.0、80.0 mg/L,并作空白对照,研究水杨酸对菌株LB-10菌丝体生物量和紫杉醇生物合成的影响。
以茉莉酸甲酯为诱导子,采用乙醇作为助溶剂,在菌株LB-10对数生长末期即第10天,添加茉莉酸甲酯醇溶液,使发酵液中其初始浓度分别达到50.0、75.0、100.0、125.0、150.0 μmol/L,并作空白对照,研究茉莉酸甲酯对菌株LB-10菌丝体生物量和紫杉醇生物合成的影响。
1.2.6 添加抑制剂的研究方法 以赤霉素为抑制剂,采用蒸馏水为助溶剂,在菌株LB-10对数生长末期即第10天,添加赤霉素水溶液,使发酵液中其初始浓度分别达到0.5、1.0、2.0、4.0、8.0 mg/L,并作空白对照,研究赤霉素对菌株LB-10菌丝体生物量和紫杉醇生物合成的影响。
以矮壮素为抑制剂,采用蒸馏水为助溶剂,在菌株LB-10对数生长末期即第10天,添加矮壮素水溶液,使发酵液中其初始浓度分别达到0.5、1.0、2.0、4.0、8.0 mg/L,并作空白对照,研究矮壮素对菌株LB-10菌丝体生物量和紫杉醇生物合成的影响。
1.2.7 培养基中补加蔗糖的研究方法 在菌株LB-10对数生长末期即第10天,添加蔗糖水溶液,使发酵液中其初始浓度分别达到5.0、10.0、15.0、20.0、25.0 g/L,并作空白对照,研究补加蔗糖对菌株LB-10菌丝体生物量和紫杉醇生物合成的影响。
2 结果与分析
2.1 诱导子的影响
2.1.1 水杨酸的影响 水杨酸是酚类化合物,为白色结晶性粉末,易溶于水,微溶于乙醇和乙醚。主要作为植物抗病反应的重要信号分子,能够激活多种与抗病相关的植物防御机制。涉及并参与系统获得抗性反应和植物过敏反应,在植物抗病反应中起重要的作用。水杨酸可分为内源水杨酸和外源水杨酸,前者能够诱导与抗病蛋白有关基因的表达,而后者则主要诱导防御反应的产生[10]。试验结果如图2所示。
由图2可知,在0~20 mg/L浓度范围,水杨酸对紫杉醇合成有明显的促进作用,在20 mg/L时紫杉醇含量达到 986.1 μg/L,继续增加浓度后紫杉醇含量开始下降。而且水杨酸含量在高于5.0 mg/L后,对菌丝体生长具有明显的抑制作用。由于水杨酸诱导细胞产生过敏反应,能够提高与次生代谢物合成相关酶的活性[11],从而促进细胞积累紫杉醇,所以水杨酸对紫杉醇合成具有显著性影响,但过高浓度的水杨酸会严重影响细胞的生长,反而使紫杉醇含量下降,因而须选择合适的水杨酸添加剂量。
2.1.2 茉莉酸甲酯的影响 茉莉酸类作为与损伤相关的植物激素和信号分子,在自然界广泛存在,其主要代表物为茉莉酸和茉莉酸甲酯,茉莉酸甲酯的外源应用能够激发防御植物基因的表达,诱导植物的化学防御,产生与机械损伤和昆虫取食相似的效果[12]。由图3可知,茉莉酸甲酯浓度在0~100 μmol/L 范围内时,随着浓度的升高,紫杉醇含量也逐渐增高,在添加 100 μmol/L 时,紫杉醇含量达到996.2 μg/L,但继续提高浓度,生物合成紫杉醇含量下降,而且在试验范围内,茉莉酸甲酯對菌丝体生长有明显的抑制作用。在茉莉酸甲酯的诱导作用下,菌丝体生长和紫杉醇的合成呈负相关关系。由于茉莉酸甲酯可激活特定防御基因的转录和翻译[13],最终促进次级代谢产物的合成,所以茉莉酸甲酯对紫杉醇合成是一种非常有效的诱导子。但由于茉莉酸甲酯会影响菌丝体的生长,反而使紫杉醇含量下降,因而须选择合适的茉莉酸甲酯添加剂量。
2.2 抑制剂的影响
2.2.1 赤霉素的影响 赤霉素是双萜类化合物,化学结构比较复杂,易溶于水,其最突出的生理效应是能显著地促进茎的伸长、能够引起某些植物形成单性果实和诱导长日植物在短日条件下开花,对某些生理现象有时有抑制作用[14]。由图4可知,在0~2.0 mg/L浓度范围内,赤霉素对紫杉醇合成有一定的促进作用,在2.0 mg/L时紫杉醇含量达到 1 015.2 μg/L,继续增加浓度后紫杉醇含量逐渐下降,而且赤霉素在低浓度下对菌丝体生长具有一定的促进作用,但当浓度高于0.5 mg/L时,对生物量的积累具有明显的抑制作用。由于赤霉素类化合物与紫杉醇具有一个同样的赤霉烷二萜母核,所以甲羟戊酸途径是其合成途径,并且也是由牻牛儿基焦磷酸(GGPP)环合而成[15]。在甲羟戊酸途径中的许多酶活性是受其代谢产物的反馈抑制,而赤霉素也有相似的作用,那么添加的赤霉素可能会抑制由GGPP合成赤霉素类化合物,为紫杉醇的合成提供更多的基础物质,从而提高紫杉醇的生物合成量;由于赤霉素浓度的提高,对菌丝体生长具有明显的抑制作用,导致紫杉醇含量下降。
2.2.2 矮壮素的影响 矮壮素即氯化氯胆碱,是一种能够与赤霉素发生拮抗作用的生长调节物质,属于甾体合成代谢抑制剂[16],其生理作用是控制植株的营养生长和生殖生长,使植株的间节缩短、矮壮并抗倒伏。由图5可知,在0~2.0 mg/L 浓度范围内,矮壮素对紫杉醇合成有一定的促进作用,在2.0 mg/L时紫杉醇含量最高,达到1 032.5 μg/L,继续增加浓度后紫杉醇含量逐渐下降。而且还发现矮壮素对菌株LB-10的菌丝体生长有明显的抑制作用。由于矮壮素可以抑制赤霉素合成途径中的环化步骤,此作用与上述假设的赤霉素反馈抑制作用基本相同。同时,矮壮素能抑制固醇的合成,而固醇抑制甲羟戊酸途径中限速酶3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMG-CoA)的活性[17],所以添加矮壮素能够间接地提高HMG-CoA的活性,从而促进甲羟戊酸途径的代谢,间接地促进紫杉烷类化合物和紫杉醇的合成。随着矮壮素浓度的增加,会对菌丝体生长产生明显地抑制,从而限制了紫杉醇含量的增加。
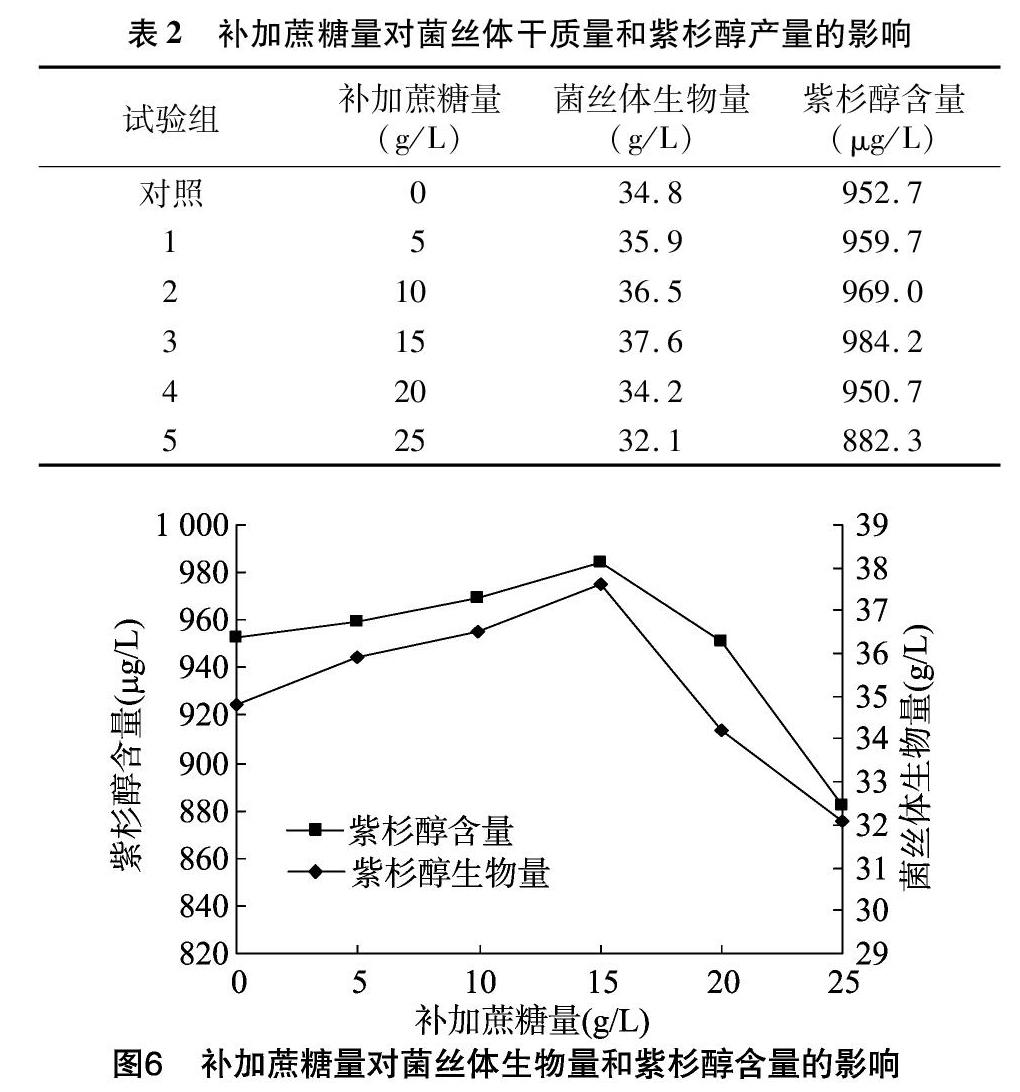
2.3 培养基补加蔗糖的研究
微生物培养基中经常使用蔗糖作为碳源,它的主要作用就是用于合成微生物细胞物质以及提供能量,蔗糖在微生物体内经常被降解成果糖和葡萄糖,其中果糖对细胞培养后期合成紫杉醇有促进作用,而葡萄糖主要是在细胞的前期生长中利于获得大量的细胞。在培养到第10天时,营养物质基本已消耗殆尽,考虑在此时添加不同浓度的蔗糖,使其发酵液中的蔗糖浓度范围在0~25 g/L之间。由表2、图6可知,在发酵液中蔗糖浓度为15 g/L时,菌体能快速生长和繁殖,紫杉醇产量和生物量最高,其中紫杉醇含量达到984.2 μg/L,而第5试验组的发酵液与对照组相比,其发酵液的黏度较大,呈糊状,紫杉醇含量也比较低。间隔补加蔗糖,随着蔗糖浓度的提高,其渗透压相应地提高,导致膜蛋白降解,从而增加了菌体的通透性,使得代谢产物更多地向胞外释放,促进代谢产物的生物合成速率,进而提高其产量,但在后期,由于过高的蔗糖浓度和大量的菌丝体量导致发酵液黏度明显增加,使菌丝体呼吸困难,从而抑制了紫杉醇的生物合成量。因此补加的蔗糖量一定要根据菌株的特性和发酵条件适量添加。
3 结论与讨论
代谢调控是通过定向改良细胞的代谢特性,对特定的生化反应进行修饰,从而实现合成新产物或提高目的产物的产率以及减少副产物的产率。在正常的生理条件下,微生物总是通过协调系统最经济地吸收和利用营养物质,用于合成细胞结构,进行生长和繁殖,一般不积累中间代谢产物。代谢人工调控就是打破微生物的代谢控制体系,使代谢朝着人们希望的方向进行。因此,在了解紫杉醇生物合成途径和催化各步反应酶的特性后,有目的地控制培养条件,通过添加重要的前体物质、诱导子及抑制剂,对关键酶的活性进行调节,抑制其他无用的旁路途径,是完全可以提高紫杉醇产量的。
本研究根据红豆杉紫杉醇的合成机制和紫杉醇的结构特点,选取水杨酸、茉莉酸甲酯、赤霉素和矮壮素分别作为生长调节剂,研究其对Metarhizium anisopliae LB-10合成紫杉醇的影响。结果表明,在发酵过程中第10天补加下列任一生长调节剂,使发酵液中初始浓度分别达到水杨酸20.0 mg/L、茉莉酸甲酯100.0 μmol/L、赤霉素2.0 mg/L、矮壮素2.0 mg/L,均能提高紫杉醇产量。
通过研究在液体发酵过程中补加蔗糖对菌株LB-10的紫杉醇含量和菌丝体生物量的影响。结果显示,蔗糖含量在不高于15 g/L时,对紫杉醇积累和菌丝体生长具有促进作用,但是高于此浓度时,菌丝体生长受抑制,进而降低了紫杉醇含量。
紫杉醇具有细胞毒害作用[18],通常不会大量地合成,只有在特殊环境胁迫条件下,初生代谢受到抑制,次生代谢产物才会大量合成。在试验过程中,笔者所在课题组发现添加某些生长调节剂,在紫杉醇产量较高时,生物量却较低。这就造成紫杉醇生物合成和菌丝体生长之间的矛盾,所以找到二者最佳平衡点是接下来须要解决的问题,也是实现工业化生产的必要条件。
参考文献:
[1]张 欢,赵赟鑫,高 文,等. 紫杉醇生产现状的分析与对策[J]. 中国现代中药,2016,18(1):126-130.
[2]赵赟鑫,高 文,张 欢,等. 提高红豆杉内生真菌及紫杉醇含量的途经分析[J]. 陕西农业科学,2015,61(10):13-17.
[3]施中东,未作君,元英进. 南方红豆杉细胞培养合成紫杉醇诱导子浓度的优化[J]. 天然产物研究与开发,2000,12(4):36-40.
[4]Ketehum R E B,Gibson D M,Croteau R B,et al. The kineties of taxoid accumulation in cell suspension cultures of taxus following elieitation with methyl jasmonate[J]. Bioteehnol Bioeng,1999,62(1):97-105.
[5]梅興国,吴奇君,江振然,等. 东北红豆杉细胞培养生产紫杉醇的调控研究Ⅱ——交互作用对东北红豆杉细胞培养生产紫杉醇的影响分析[J]. 生命科学研究,2002,6(2):152-155.
[6]周忠强,梅兴国,吴奇君. 前体、诱导子及抑制剂对细胞培养生产紫杉醇的调节作用[J]. 天然产物研究与开发,2002,14(2):19-21.
[7]耿 直,刘开辉,赵赟鑫,等. 一株产紫杉醇中国红豆杉内生真菌的分离和鉴定[J]. 微生物学通报,2010,37(2):199-203.
[8]赵赟鑫,张 欢,邓百万,等. 红豆杉内生真菌产紫杉醇的培养基优化[J]. 江苏农业科学,2014,42(11):389-392.
[9]张 欢,赵赟鑫,李昭莹,等. 红豆杉内生真菌产紫杉醇的发酵条件优化研究[J]. 江苏农业科学,2018,46(21):306-309.
[10]郑爱珍,王启明. 水杨酸与植物逆境胁迫[J]. 安徽农业科学,2006,34(5):844-845.
[11]梅国兴,张舟宁,苏湘鄂,等. 水杨酸对红豆杉细胞的诱导作用[J]. 生物技术,2000,10(6):90-92.
[12]薛仁镐,金圣爱. 茉莉酸甲酯:一种重要的植物信号转导分子[J]. 生物技术通讯,2006,17(6):985-988.
[13]余龙江,朱 敏,周 莹,等. 茉莉酸甲酯对紫杉醇生物合成的诱导作用[J]. 天然产物研究与开发,1998,11(5):1-7.
[14]黄先忠,蒋才富,廖立力,等. 赤霉素作用机理的分子基础与调控模式研究[J]. 植物学通报,2006,23(5):499-510.
[15]卢利方,冯仁军,张银东. 赤霉素信号转导的分子生物学研究进展[J]. 生命科学研究,2005,9(4):66-71.
[16]周忠强,梅国兴,吴奇君. 前体、诱导子及抑制剂对细胞培养生产紫杉醇的调节作用[J]. 天然产物研究与开发,2001,14(2):19-21.
[17]Hamill J D,Parr A J,Rhodes M J C,et al. New routes to plant secondary products[J]. Bio Technology,1987,5(8):800-804.
[18]李宗霆. 植物激素及其免疫检测技术[M]. 南京:江苏科学技术出版社,1996.窦允清,王振华,张金珠,等. 水肥耦合对滴灌加工番茄生理生长及产量的影响[J]. 江苏农业科学,2019,47(7):124-129.
