利用LEAFYCOTYLEDON2转录因子提升植物营养器官内油脂含量的研究综述
2019-09-17薛金嫚刘华陈亚东
薛金嫚 刘华 陈亚东
摘要:近年来,由于传统油料作物种植耕地受限,在植物营养器官内合成和储存油脂已成为新的全球研究热点。研究表明,在植物营养器官中通过基因工程手段调控参与种子中油脂合成的相关基因,会有效提升其甘油三脂含量和脂肪酸组成。LEAFY COTYLEDON 2(LEC2)是具有B3结构域的DNA结合蛋白家族的成员,参与调控胚胎发生、种子储藏蛋白合成、脂肪酸代谢等重要生物学过程。近年来,许多研究都选择该转录因子作为改造植物营养组织产油的关键因子,笔者对上述研究作了简要的综述,并探讨了目前仍存在的问题和可能的解决对策。本文可为今后利用基因工程手段调控植物营养器官内的油脂含量提供了一定的参考。
关键词:LEC2;植物;营养器官;油脂合成
中图分类号: S188 文献标志码: A 文章编号:1002-1302(2019)07-0011-03
随着全球人口增加,工业化进程加快,全球面临食用油和化工原油短缺的严峻局面[1-2]。植物油脂除了提供人类及动物的营养,也普遍用于肥皂、表面活性剂、化妆品、涂料、润滑油以及生物柴油的生产。在過去的半个世纪,人们通过各种尝试来提高和改变油料作物的农艺和品质性状[3-5]。近年来,由于气候变化、环境污染、耕地受限,研究者逐渐认识到仅利用油料作物的种子来生产植物油已难以满足日益增长的市场需求[6]。在自然状态下,叶片、茎秆等营养器官作为能量合成和运输的“源”器官,累积的中性油脂含量非常低下。仅在一些逆境胁迫条件下,植物营养组织内会合成少量的油脂,但无法形成大量的累积。由于植物的营养组织具有生物量大、生长周期短、收获指数高的优点,近年来探索在植物营养组织内合成和储存油脂,作为传统植物油生产体系的补充,已成为国外的研究热点。目前一般从调控叶绿体内脂肪酸合成、加强内质网上甘油三脂的组装和促进胞质内油滴形成这3个方面进行研究,选择改造上述过程中的1个(或多个)关键酶基因或转录因子。如在烟草幼苗中过表达拟南芥中的二酰甘油酰基转移酶基因(DGAT1),可使甘油三酯(TAG)含量增加至1%干质量[7],而在转基因烟草叶片中,TAG含量达到干质量的 1.5%[8]。在拟南芥CGI58脂酶的突变体叶片中,TAG的含量可达到干质量的0.03%~0.22%,同时亚油酸、亚麻酸等多不饱和脂肪酸含量升高[9-10]。而与此类似的是,在烟草内共表达WRI1和DGAT对烟草叶片内TAG的积累有协同作用[11]。而在拟南芥中过表达WRI1和DGAT可使其营养器官中TAG含量达到干质量的2%~3%[12]。Kelly等进一步研究发现,在拟南芥SDP1脂酶突变体中共表达WRI1和DGAT基因,可以使叶片中的TAG含量达到干质量的5%,根中TAG含量达到干质量的8%[12]。上述研究表明,通过调控TAG合成过程中的1个或多个关键酶,植物营养器官完全可以作为产油和储油的“工厂”来生产和累积油脂。
除了选择油脂合成代谢的关键酶基因进行改造以外,众多研究者还选择了不同来源的LEC2(LEAFY COTYLEDON2)转录因子来进行改造。LEC2是一个具有B3结构域的DNA结合蛋白,它参与调控了种子储藏蛋白代谢、胚胎形成和脂肪酸代谢等重要生物学过程[13]。2004年,LEC2在拟南芥中被首次报道,过量表达AtLEC2,促进了体细胞胚胎的形成,使转基因植物营养组织出现了胚性发育现象。基因芯片数据还表明,AtLEC2能够诱导下游大量参与合成储藏蛋白、油体和脂肪酸的重要基因表达。最近研究还发现,LEC2对脂肪酸合成的调控作用,极有可能是通过调控AtWRI1转录因子来间接完成的[14-16]。通过分析近年来发表的文献,将利用LEC2来改造植物营养组织含油量的研究分为两大类,即单独改变LEC2转录因子表达量的研究和组合表达LEC2转录因子的研究。
1 单独过表达LEC2对植物营养组织油脂合成的影响
脂肪酸供应是影响甘油三酯合成的主要因素[17]。在植物中,脂肪酸的合成发生在叶绿体中,其转录水平的调控被认为是主要的调控途径[18-19]。LEC2是参与调节脂肪酸合成的主要转录因子之一,近年常被用于提升并优化植物种子内的油脂含量和脂肪酸组成[20]。Mendoza等首次在拟南芥中过表达AtLEC2,发现在叶片内积累了种子特异的mRNA,这些基因与甘油三酯的积累及油滴的形成密切相关;与此同时,在含有蔗糖的培养基中诱导LEC2表达的拟南芥第1个叶片的甘油三酯含量有所增加[21],说明过表达LEC2可提升营养组织内的油脂含量。有趣的是,Slocombe等分析了3~4周龄、生长在土壤中的过表达AtLEC2拟南芥植株的叶片油脂含量,结果却发现其甘油三酯含量明显低于野生型[22]。上述差异可能是由培养基中的碳源供给不同而造成的,暗示着LEC2驱动的营养组织内的油脂合成需要充足和稳定的碳水化合物供给。
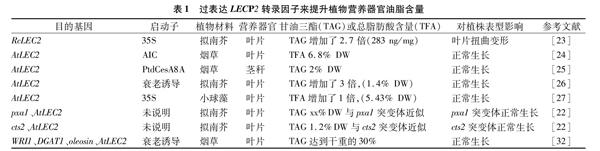
另外,由于LEC2参与了植物的胚性发育,而组成型过表达LEC2的转基因植株,往往出现生长缓慢、叶片卷曲的表型。Kim等在拟南芥中用35S强启动子驱动过表达来自蓖麻的LEC2转录因子,结果发现转基因拟南芥中的TAG含量分别达到了野生型的2.8倍(283 ng/mg)。但是,与此同时,转基因植株却出现了组织扭曲变形的体细胞胚胎发生现象,严重影响到了转基因植株的光合作用和生物量累积[23]。由于35S启动子是一个组成型表达的强启动子,因此对于所驱动的基因会非选择性地进行强行表达,而在自然状态下,LEC2的表达不可能是组成型的。有趣的是,选择不同的启动子,对于LEC2的表达效果和植株表型也会产生截然不同的影响。Andrianov等在烟草叶片中用AIC作为启动子,在成熟叶片中用乙醛诱导了AtLEC2的表达,结果表明,AtLEC2的表达使烟草叶片中总的脂肪酸含量达到干重的6.8%,但表型却没有发生明显的改变[24]。Nookaraju等在烟草茎秆中以PtdCesA8A为启动子,过表达拟南芥的AtLEC2,使茎秆中的含油率达到2%,转基因烟草的表型同样没有受到影响[25]。Kim等用衰老诱导启动子在拟南芥中过表达AtLEC2,结果发现叶片内WRI1表达量上升,转基因植株TAG含量达到干质量的1.4%,与野生型相比提高了3倍,但是植株表型未发生任何改变,其生长没有受到明显的抑制[26](表1)。上述结果表明,不同的启动子,对LEC2的表达和功能具有不同的调控作用。
最后,在不同的受体物种中,过表达LEC2转录因子,其产生的效果也有差异。如用35S强启动子驱动拟南芥AtLEC2在小球藻内过表达,发现转AtLEC2基因藻株的脂肪酸含量比原始藻株提高了1倍以上,且对小球藻的生长及光合作用没有产生明显影响[27]。
2 共表达LEC2和其他基因对植物营养组织内油脂含量的影响 在种子中,仅通过控制油脂代谢途径中单一的酶促反应已被证明并不能显著影响种子内的油脂合成与储存[28]。单独过表达LEC2的转基因策略对植物营养组织或藻类的油脂合成具有促进作用,但是由于植物油脂合成是一个极其复杂的过程,涉及到各种不同功能的酶在代谢途径中的分工合作,共同调控着油脂的合成与累积,因此组合LEC2与其他基因进行共表达,理论上可以更进一步提升转基因植株的油脂含量。近年来,越来越多的研究者尝试将油脂合成(降解)代谢途径中的多个关键酶基因(转录因子)进行组合表达(或敲除),以此来提高植物营养器官中的油脂含量。目前的研究主要从以下3个层面入手:(1)在叶绿体内提高光合产物转化为脂肪酸的效率;(2)增加内质网上脂肪酸组装成甘油三酯的效率;(3)降低脂酶活性,防止脂肪酸或油体的降解[5-6,29-30]。其中,调控叶绿体内脂肪酸合成的LEC2已被选择与内质网上甘油三脂组装、胞质内油滴形成的多个基因进行组合并串联表达(表1)。Slocombe等在拟南芥中过表达AtLEC2,拟南芥在叶片处于衰老期时甘油三酯积累量达到最大值,为干质量的0.8%,但是脂肪酸降解突变体cts2与过表达AtLEC2植株杂交后代油脂分析显示,其甘油三酯含量与cts2单突变体相比并没有明显增加;类似地在过氧化物酶体pxa1突变体中过表达AtLEC2,结果表明,在叶片进入衰老期时拟南芥叶片中的甘油三酯含量与拟南芥pxa1突变体相比也并没有明显增加[22]。这可能是因为当叶片处于衰老期时,二者都能利用膜脂降解过程产生的脂肪酸以避免其进入氧化途径,因此选择适当的基因组合也是十分必要的。Londo等在烟草中共表达WRI1、DGAT1及OLEOSIN,结果表明,根、茎中的甘油三酯含量都有所提高,处于衰老时期叶片的TAG含量达到干质量的15%,并且对植株生长没有产生明显的影响[31]。Li等又进一步在共表达WRI1、DGAT1及Oleosin的烟草叶片中过表達AtLEC2,使叶片中的TAG含量达到干质量的30%[32],这个数值已非常接近植物种子内的油脂水平。更重要的是,在上述转基因植株中,并未表现出明显的不良生长状况。值得注意的是,在上述研究中,转基因植株营养组织内积累的油脂分布并不均匀,呈现出较大的时空差异,即叶龄较大的叶片中的油脂含量高于幼年叶片,这可能是因为油脂的合成和累积需要时间,且衰老叶片内相关酶的表达量也较高。处于植株上部位置的叶片油脂含量高于植株下部位置叶片的油脂含量,这可能与维管束的运输、淀粉的降解、糖酵解的空间区隔化有关。而笔者前期研究也发现,过表达AtLEC2烟草的植株,成年叶片上会出现比较明显的叶片斑块化现象,一些叶片部位呈现出非枯死性的白色斑块区域,暗示着这些部位的叶绿体发育已受到明显影响,这可能与过表达AtLEC2会驱动脂肪酸进入内质网参与甘油三酯组装,而非进入叶绿体参与膜脂重建有关。所以,在对转基因植物进行油脂含量分析时,取样时期和取样部位的选择至关重要。
3 展望
植物油脂的合成是一个极其复杂的过程,在植物营养组织内合成和储存油脂,从概念的提出到实验室获得30%叶片含油量的转基因烟草株系,只用了不到10年时间,相关领域的研究已如火如荼。LEC2转录因子虽然已被证明可以有效提高植物(藻类)营养器官和种子内的油脂含量,但是,其效果在不同的宿主植物和启动子之间存在较大的差异,甚至在一些转基因植株还出现了生长缓慢、叶片扭曲变形的胚性发育现象,严重影响了植株的正常生长。因此,选择哪些宿主植物?选择什么启动子和结构基因进行组合?在植物哪些部位进行表达?表达量控制到多少才能平衡油脂产量和植物正常生长?这些问题还有待进一步的研究阐明。对LEC2调控营养组织油脂含量的研究,有助于研发新型的油脂生产体系,因此具有十分重要的理论和实践意义。
参考文献:
[1]Carlsson A S,Yilmaz J L,Green A G,et al. Replacing fossil oil with fresh oil - with what and for what?[J]. European Journal of Lipid Science and Technology,2011,113(7):812-831.
[2]Thelen J J,Ohlrogge J B. Metabolic engineering of fatty acid biosynthesis in plants[J]. Metabolic Engineering,2002,4(1):12-21.
[3]Reynolds K B,Taylor M C,Zhou X,et al. Metabolic engineering of medium-chain fatty acid biosynthesis in Nicotiana benthamiana plant leaf lipids[J]. Frontiers in Plant Science,2015,6:164.
[4]Ohlrogge J B. Design of new plant products:engineering of fatty acid metabolism[J]. Plant Physiology,1994,104(3):821-826.
[5]Hu Q,Sommerfeld M,Jarvis E,et al. Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances[J]. The Plant Journal,2008,54:621-639.
[6]Radakovits R,Jinkerson R E,Darzins A A. Genetic engineering of algae for enhanced biofuel production[J]. Eukaryotic Cell,2010,9(4):486-501.
[7]Wu H Y,Liu C,Li M C,et al. Effects of monogalactoglycerolipid deficiency and diacylglycerol acyltransferase overexpression on oil accumulation in transgenic tobacco[J]. Plant Molecular Biology Reporter,2013,31(5):1077-1088.
[8]Bouvier-Navé P,Benveniste P,Oelkers P,et al. Expression in yeast and tobacco of plant cDNAs encoding acyl CoA:diacylglycerol acyltransferase[J]. European Journal of Biochemistry,2000,267(1):85-96.
[9]Park S,Gidda S K,James C N,et al. The α/β hydrolase CGI-58 and peroxisomal transport protein PXA1 coregulate lipid homeostasis and signaling in Arabidopsis[J]. Plant Cell,2013,25(5):1726-1739.
[10]James C N,Horn P J,Case C R,et al. Disruption of the Arabidopsis CGI-58 homologue produces chanarin-dorfman-like lipid droplet accumulation in plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(41):17833-17838.
[11]Vanhercke T,El Tahchy A,Shrestha P,et al. Synergistic effect of WRI1 and DGAT1 coexpression on triacylglycerol biosynthesis in plants[J]. FEBS Letters,2013,587(4):364-369.
[12]Kelly A A,van Erp H,Quettier A L,et al. The SUGAR-DEPENDENT1 lipase limits triacylglycerol accumulation in vegetative tissues of Arabidopsis[J]. Plant Physiology,2013,162(3):1282-1289.
[13]Angeles-Núez J G,Tiessen A. Mutation of the transcription factor LEAFY COTYLEDON 2 alters the chemical composition of Arabidopsis seeds,decreasing oil and protein content,while maintaining high levels of starch and sucrose in mature seeds[J]. Journal of Plant Physiology,2011,168(16):1891-1900.
[14]Cernac A,Andre C,Hoffmann-Benning S,et al. WRI1 is required for seed germination and seedling establishment[J]. Plant Physiology,2006,141(2):745-757.
[15]Liu J,Hua W,Zhan G,et al. Increasing seed mass and oil content in transgenic Arabidopsis by the overexpression of wri1-like gene from Brassica napus[J]. Plant Physiology and Biochemistry,2010,48(1):9-15.
[16]Baud S,Mendoza M S,To A,et al. WRINKLED1 specifies the regulatory action of LEAFY COTYLEDON2 towards fatty acid metabolism during seed maturation in Arabidopsis[J]. The Plant Journal for Cell and Molecular Biology,2007,50(5):825-838.
[17]Bourgis F,Kilaru A,Cao X,et al. Comparative transcriptome and metabolite analysis of oil palm and date palm mesocarp that differ dramatically in carbon partitioning[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(30):12527-12532.
[18]Ohlrogge J B,Jaworski J G. Regulation of fatty acid synthesis[J]. Annual Review of Plant Biology,1997,48:109-136.
[19]Millar A A,Smith M A,Kunst L. All fatty acids are not equal:discrimination in plant membrane lipids[J]. Trends in Plant Science,2000,5(3):95-101.
[20]Baud S,Lepiniec L. Regulation of de novo fatty acid synthesis in maturing oilseeds of Arabidopsis[J]. Plant Physiology & Biochemistry,2009,47(6):448-455.
[21]Mendoza M S,Dubreucq B,Miquel M,et al. LEAFY COTYLEDON 2 activation is sufficient to trigger the accumulation of oil and seed specific mRNAs in Arabidopsis leaves[J]. FEBS Letters,2005,579(21):4666-4670.
[22]Slocombe S P,Cornah J,Pinfield-Wells H,et al. Oil accumulation in leaves directed by modification of fatty acid breakdown and lipid synthesis pathways[J]. Plant Biotechnology Journal,2009,7(7):694-703.
[23]Kim H U,Jung S J,Lee K R,et al. Ectopic overexpression of castor bean LEAFY COTYLEDON2 (LEC2) in Arabidopsis triggers the expression of genes that encode regulators of seed maturation and oil body proteins in vegetative tissues[J]. FEBS Open bio,2014,4(1):25-32.
[24]Andrianov V,Borisjuk N,Pogrebnyak N A,et al. Tobacco as a production platform for biofuel:overexpression of Arabidopsis DGAT and LEC2 genes increases accumulation and shifts the composition of lipids in green biomass[J]. Plant Biotechnology Journal,2010,8(3):277-287.
[25]Nookaraju A,Pandey S K,Fujino T,et al. Enhanced accumulation of fatty acids and triacylglycerols in transgenic tobacco stems for enhanced bioenergy production[J]. Plant Cell Reports,2014,33(7):1041-1052.
[26]Kim H U,Lee K R,Jung S J,et al. Senescence-inducible LEC2 enhances triacylglycerol accumulation in leaves without negatively affecting plant growth[J]. Plant Biotechnology Journal,2015,13(9):1346-1359.
[27]劉长斌,佟少明,张文蕾,等. 拟南芥Leafy Cotyledon 2的表达提高了小球藻Chlorella sorokiniana的油脂含量[J]. 生物工程学报,2017,33(6):1037-1045.
[28]Ramli U S,Baker D S,Quant P A,et al. Control analysis of lipid biosynthesis in tissue cultures from oil crops shows that flux control is shared between fatty acid synthesis and lipid assembly[J]. Biochemical Journal,2002,364(2):393-401.
[29]Greenwell H C,Laurens L M,Shields R J,et al. Placing microalgae on the biofuels priority list:a review of the technological challenges[J]. Journal of the Royal Society Interface,2010,7(46):703-726.
[30]苗迎春,雷 洁,牛蕾蕾,等. 提高植物营养器官含油量的研究进展[J]. 江苏农业科学,2017,45(1):1-5.
[31]Kondo H,Shiratsuchi K,Yoshimoto T,et al. Acetyl-CoA carboxylase from Escherichia coli:gene organization and nucleotide sequence of the biotin carboxylase subunit[J]. Proceedings of the National Academy of Sciences of the United States of America,1991,88:9730-9733.
[32]Li S J,Cronan J E Jr. The gene encoding the biotin carboxylase subunit of Escherichia coli acetyl-CoA carboxylase[J]. Journal of Biological Chemistry,1992,267(2):855-863. 曾祥朋,杨清香. 噬菌体在环境耐药基因转移中的作用综述[J]. 江苏农业科学,2019,47(7):14-18.
