在循环水养殖系统中养殖密度对红鳍东方鲀应激反应和抗氧化状态的影响
2019-09-17曲克明李卫东朱建新
张 龙,曲克明,张 鹏,汪 鲁,李卫东,朱建新
(1 农业农村部海洋渔业可持续发展重点实验室,中国水产科学研究院黄海水产研究所,山东 青岛 266071;2上海海洋大学水产与生命学院,上海 201306;3天津海升水产养殖有限公司,天津 300000)
近年来,循环水养殖凭借其养殖密度高、养殖水体污染物质量浓度可控、养殖废水可循环利用以及环境友好的优点,促进了水产养殖产业的可持续发展,受到广泛关注[1-2];循环水养殖系统还有利于养殖水体中废物管理和营养物迁移转化,可控制养殖生物的疾病发生[3-5]。然而,与网箱养殖和流水养殖模式相比,在生产中循环水养殖系统的应用仍然是较少的,这主要与其较高的投资和运行成本有关[6]。这就要求养殖生产者选择经济价值较高的鱼种进行高密度养殖,提高鱼类养殖产量和效益,从而弥补循环水养殖系统的投资运行成本,但是较高的养殖密度很可能抑制养殖鱼类的生长性能,增加死亡率。因此,在循环水养殖中选择合适的放养密度十分重要。养殖密度一直被视为影响鱼类健康和产量的重要因素,养殖密度不仅会改变养殖水体的水质指标,而且可以被视作一种应激源,对鱼类生理生化指标产生重要影响[7]。就生理角度而言,鱼类较好的生长性能可以通过一些生理生化指标表现出来,如血液血浆的生化指数。当鱼体较健康和生存条件较为适宜时,鱼体血浆皮质醇质量浓度通常是较低的,乳酸和葡萄糖水平处在正常范围[8]。据刘宝良等[9]报道,在较高养殖密度条件下,大菱鲆肝脏抗氧化酶活性降低,而丙二醛水平增加。因此,检测密度胁迫条件下鱼类应激反应和抗氧化状态的变化对改善鱼类健康具有至关重要的意义[10]。
红鳍东方鲀(Takifugurubripes)凭借其较高的营养和商业价值,成为日本和中国较为普遍的养殖品种。一些研究已证明循环水养殖红鳍东方鲀的可行性[11-12],目前有关循环水养殖条件下密度胁迫对红鳍东方鲀应激反应和抗氧化状态影响的研究较少。因此,本文研究养殖密度在循环水养殖系统对红鳍东方鲀的生长性能、应激反应、抗氧化状态以及养殖水体水质影响,以期为提高红鳍东方鲀的养殖产量、改善其生长环境提供理论支撑。此外,本研究还通过硝酸盐氮急性处理试验,探究不同硝酸盐氮质量浓度(1.0、 25.0、100.0 和150.0 mg/L)对红鳍东方鲀应激反应和抗氧化状态的影响,以确定循环水养殖过程中水体硝酸盐氮质量浓度变化对红鳍东方鲀生长的影响。
1 材料和方法
1.1 试验设施和养殖生物
循环水养殖试验系统设计如图1所示,主要由养殖池(9个,养殖水体30 m3/个)和水处理设备组成。水处理设备包括弧形筛、循环水泵、蛋白分离器、曝气池、紫外消毒设备、生物滤池、液氧和罗茨鼓风机等。生物滤池为浸没式,可以容纳水体126 m3,以聚丙烯材质的弹性刷状生物填料为生物膜载体。养殖试验开始之前,生物滤池生物膜已经培养完成。该养殖系统在之前的研究中已经被成功应用于红鳍东方鲀的养殖[13]。本试验所用的红鳍东方鲀(300 g/尾)和试验设施均由天津海升水产养殖有限公司提供。
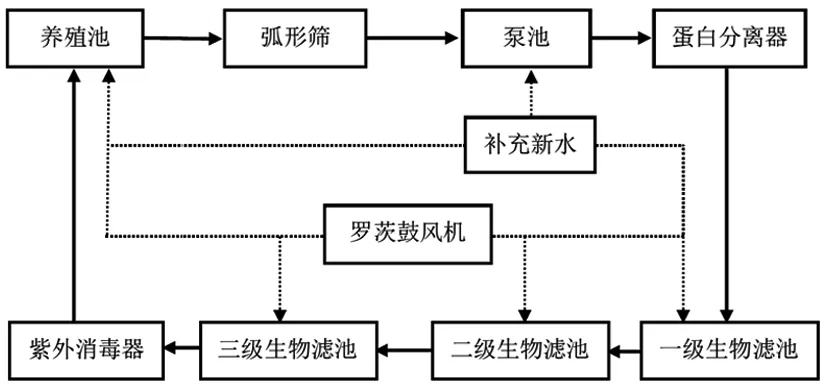
图1 红鳍东方鲀循环水养殖系统工艺流程图
1.2 试验设计
将红鳍东方魨(规格300 g,共14 700尾)随机分为3个密度组:12.5 kg /m3、16.5 kg /m3和20.0 kg /m3,分别标记为L组、M组和H组。各个密度组处理3个重复。在试验期间,每天投喂商品饲料3次(8:00,16:00和 22:00),各个密度处理组日投喂量约占鱼体总质量的3.0%,根据红鳍东方鲀摄食和体质量情况进行适时适量调整,本试验共进行50 d。
在试验过程中测定一些重要的水质指标、鱼体应激反应指标和抗氧化能力指标,以及鱼体生长性能。水质指标包括水温、pH、溶氧、盐度、氨氮、亚硝酸盐氮和硝酸盐质量浓度,每10 d测定1次。鱼体应激反应指标包括鱼体血浆葡萄糖(GLU)、乳酸(LAC)、胆固醇(CHO)和皮质醇(COR)质量浓度;抗氧化能力指标包括鱼体肝脏总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-px)活性、谷胱甘肽(GSH)和丙二醛(MDA)含量。上述指标在试验开始20 d、30 d、40 d和50 d在各养殖池随机抽取10尾红鳍东方鲀测定;试验结束时在各个养殖池内随机抽取30尾鲀对其生物学体长和体质量进行测量,统计各个养殖池内鱼体数量,以计算养殖红鳍东方鲀的生长率、存活率以及饲料转化率。
通过硝酸盐氮急性处理试验,探究不同硝酸盐氮质量浓度对红鳍东方鲀应激反应和抗氧化的影响。在试验过程中,利用硝酸钠和天然海水配置不同质量浓度的硝酸盐氮,其质量浓度分别被控制在(1.0±0.3)、 (25.0±1.4)、(100.0±2.6)和(150.0 ± 3.3 )mg/L。试验将平均规格为300 g的20条红鳍东方鲀放入180 L含不同质量浓度硝酸盐氮的养殖槽中48 h进行急性毒理试验,水体pH为7.7,温度22 ℃。试验结束后,每个养殖池内随机取出5条鱼进行应激反应指标和抗氧化能力指标的测定。
1.3 取样
在试验开始20 d、30 d、40 d和50 d,从养殖池内随机抽取红鳍东方鲀进行血浆和肝脏取样操作,但在取样之前需要禁食24 h。红鳍东方鲀的血液通过注射器从鱼体尾静脉抽取,加入抗凝剂,经3 000 r/ min的离心处理后获得血浆,将处理好的血浆储存在液氮中以备用;肝脏通过解剖获得,选取部分储存在液氮中待用。
1.4 分析方法
1.4.1 水质分析

1.4.2 生长性能参数
在试验结束后,分别使用游标卡尺、电子天平和电子秤测量各养殖池内红鳍东方鲀的生物学体长、体质量,并分别计算其特定增长率、存活率以及饲料转化率,公式如下:
TSGR= 100%×(lnW1- lnW0)/t
(1)
CSR= 100%×(S1/S0)
(2)
ZFCR= 100%×(Wf/Wi)
(3)
式中,TSGR—特定增长率,%/d ;CSR—存活率;ZFCR—饲料转化率;W1—鱼体终体质量, g;W0—鱼体初始体质量, g ;t—试验天数, d;S1—养殖开始鱼体数量,尾;S0—养殖末期鱼体数量,尾;Wf—饲料利用干重,kg;Wi—鱼类增加总质量,kg。
1.4.3 应激反应指标测试
取红鳍东方鲀的血浆样品加入9倍体积冰冷的生理盐水(0.9%),制成10%的血浆稀释样品,分装到2 mL的离心管,进行应激反应指标测定。血浆样品的GLU、 LAC、CHO和COR质量浓度均使用南京建成生物工程研究所的试剂盒测定,测定步骤参考试剂说明书。
1.4.4 抗氧化能力和脂质过氧化指标测定
取红鳍东方鲀肝脏样品,剪碎,加入9倍体积冰冷的生理盐水(0.9%),制成10%的匀浆,在4 ℃条件下,3 500 r/min离心15 min,取出上清液,分装到2 mL的离心管,进行抗氧化能力和脂质过氧化测定。肝脏样品的T-AOC、SOD、GSH-px、GSH和MDA含量均使用南京建成生物工程研究所的试剂盒测定,测定步骤参考试剂说明书。
1.4.5 数据分析
所有数据均用平均值±标准误差表示,使用SPSS 软件对试验数据进行统计分析、差异显著性检验分析,用t检验计算P值,当P<0.05时为差异显著,P<0.01时为差异极显著。
2 结果
2.1 不同养殖密度对养殖水体水质的影响


表1 红鳍东方鲀在不同养殖密度下养殖水体水质理化参数

图2 不同养殖密度下水体中硝酸盐氮质量浓度变化
3.2 不同养殖密度对鲀生长性能的影响
不同养殖密度红鳍东方鲀在循环水养殖系统的生长参数见表2。由表2可知,不同养殖密度鲀从初体质量300.00 g分别生长至585.50、576.40和542.30 g,H组与L组、M组的终体质量、特定生长率、饵料转化率之间存在显著性差异(P<0.05),且 H组鲀终体质量、特定生长率、饵料转化率高于L组、M组,但各密度组鲀的存活率不存在显著性差异(P>0.05)。

表2 不同养殖密度对红鳍东方鲀生长性能的影响
注:同行上标不同字母表示差异显著
3.3 不同养殖密度对鲀血浆理化指标的影响
在试验期间,养殖密度对红鳍东方鲀的血液血浆理化指标的改变具有重要影响(图3)。在试验第40天和50天,H组鲀血浆皮质醇质量浓度显著高于M组和L组(P<0.05);在试验第50天,H组鲀血浆葡萄糖质量浓度显著低于M组和L组(P<0.05),而H组鲀血浆乳酸浓度显著高于L组(P<0.05),但与M组鲀血浆乳酸质量浓度则无显著性差异(P>0.05)。
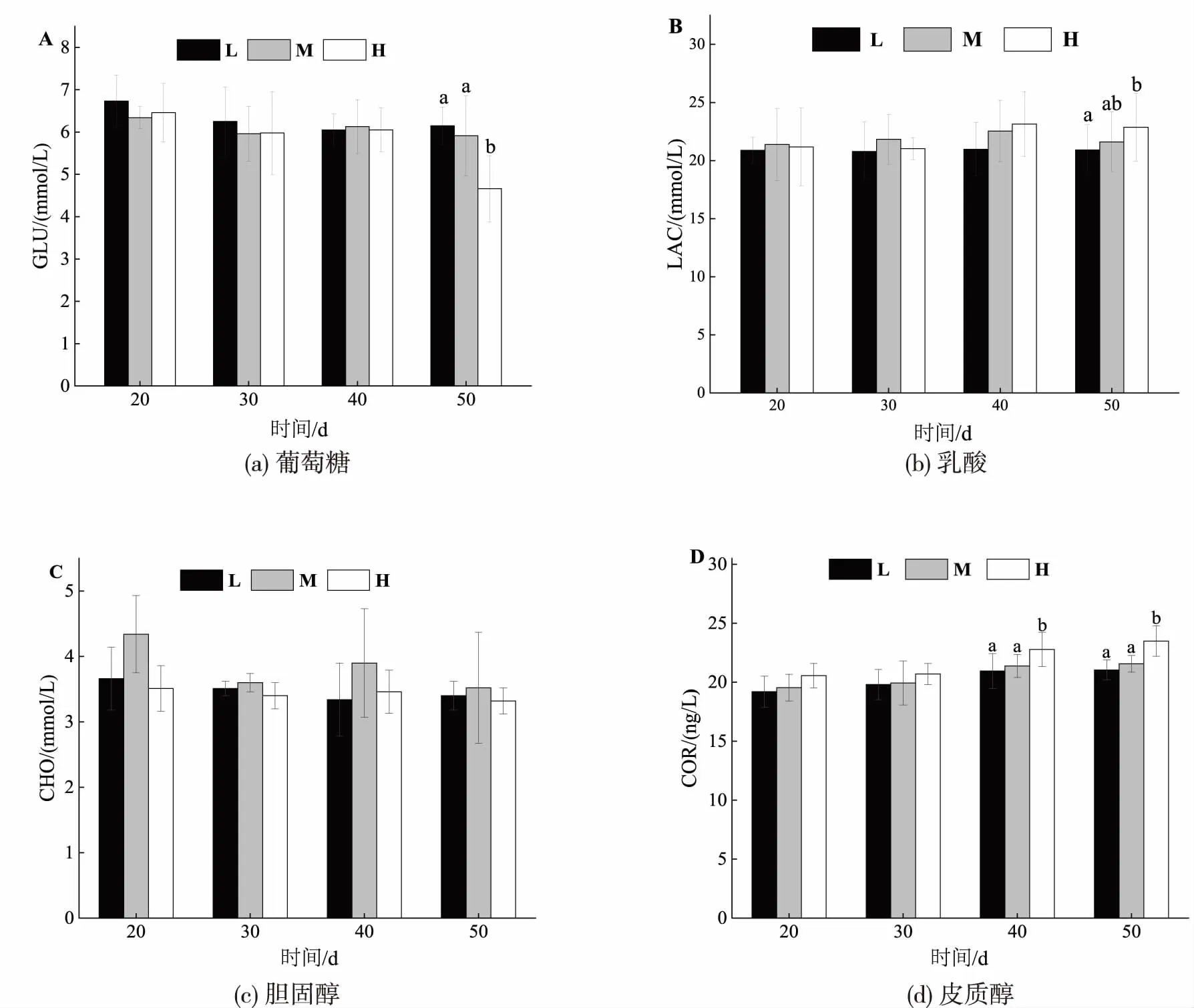
注:不同小写字母表示差异显著,下同
3.4 不同养殖密度对鲀肝脏抗氧化能力和脂质过氧化的影响
在红鳍东方鲀养殖末期,养殖密度对鲀抗氧化能力和脂质过氧化具有重要影响(图4)。其中,H组鲀肝脏总抗氧化能力显著低于L组和M组(P<0.05),但H组鲀肝脏SOD和GSH-px活性显著低于L组(P<0.05),这也许表明H组鲀肝脏的抗氧化能力较低。同时,H组鲀肝脏MDA含量显著高于L组和M组(P<0.05)。
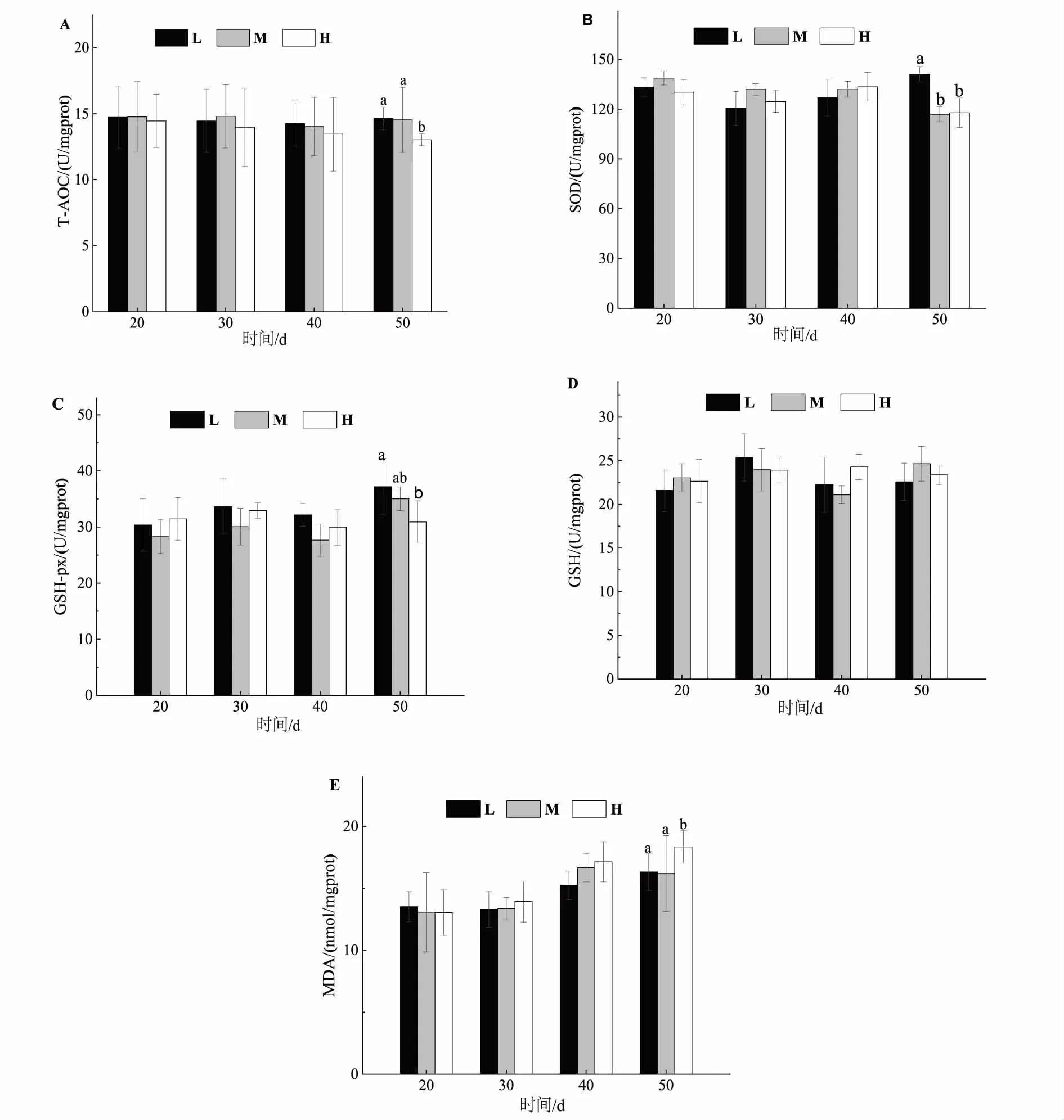
图4 不同养殖密度对红鳍东方鲀抗氧化能力和脂质过氧化的影响
3.5 不同质量浓度对鲀血浆理化指标的影响
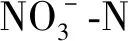

图5 不同硝酸盐氮质量浓度对红鳍东方鲀血浆理化指标的影响
3.6 不同质量浓度对鲀肝脏抗氧化能力和脂质过氧化的影响
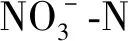
4 讨论
4.1 养殖密度对循环水养殖系统水体水质变化


图6 不同硝酸盐氮质量浓度对红鳍东方鲀抗氧化能力和脂质过氧化的影响
4.2 不同养殖密度对鲀生长性能的影响

4.3 不同养殖密度对鲀应激反应的影响
鱼类应激反应一般是由养殖水环境改变、人类活动、鱼类运输和发病以及养殖密度增加等因素引起的。其中,较高养殖密度通常被视为鱼类集约化养殖过程中的一种慢性应激源,对养殖鱼体的生理生化指标产生重要影响。鱼类血液皮质醇和葡萄糖含量是反映鱼类抗应激能力的重要检测指标。当鱼类受到应激压力时,鱼类的下丘脑-垂体-肾间组织轴(HPI)被激活,引起头肾细胞中皮质醇激素的合成与释放。鱼类交感-肾上腺髓质系统也会受到刺激,引起肾上腺髓质的嗜铬细胞释放儿茶酚胺。儿茶酚胺可以促进机体肝脏、骨骼肌和心肌内糖原的分解,产生大量葡萄糖供机体短时间供能。在本试验中,红鳍东方鲀在高密度长期胁迫条件下血浆皮质醇分泌量增加,促使葡萄糖消耗量增加,这就导致养殖后期高密度试验组鲀血浆葡萄糖质量浓度下降,这与Braun等[17]和Fotedar[20]的研究结果相吻合。本试验中密度胁迫所消耗的葡萄糖绝大部分通过厌氧糖酵解生成乳酸,促使鲀血浆乳酸水平升高,这与Fotedar[20]研究结果相一致,而红鳍东方鲀血浆理化指标改变很可能是由高密度条件下鱼类的空间拥挤效应所引起的。为使鱼类适应拥挤效应所带来的应激压力和恢复正常的生理状态,鱼类需要消耗大量能量,糖异生能力增强,这也许对鱼类的生长产生不利影响。因此,在红鳍东方鲀集约化养殖中必须选择适当的养殖密度,以降低鲀在高密度胁迫条件下应激压力发生的概率。
4.4 不同养殖密度对鲀抗氧化能力和脂质过氧化的影响
氧自由基反应和脂质过氧化反应是机体新陈代谢活动的重要组成部分。在正常情况下,需氧动物的基本代谢会产生大量氧自由基和活性氧分子(ROS),以维持生物机体生理生化活动和免疫功能。然而,当生物机体内氧自由基和ROS过多时,它们就会攻击生物的抗氧化系统,造成机体抗氧化能力减弱、抗氧化酶活性和抗氧化物质含量降低。T-AOC、SOD、GSH-px、GSH和MDA等是衡量生物机体免疫机能的重要指标。其中,SOD是降解活性氧自由基的第一道防线,可以将超氧阴离子自由基转化为过氧化氢,然后由过氧化氢酶将过氧化氢转化为水和氧气;GSH-px可以清除细胞内的过氧化氢和过氧化物;GSH为一类小分子抗氧化剂,可以清除氧自由基和解毒亲电体,维持巯基-二硫键的平衡和信号转导。在本试验中,当红鳍东方鲀养殖密度在20.0 kg/m3时,肝脏T-AOC、SOD和GSH-px水平明显降低,这表明鲀在高密度胁迫条件下产生大量氧自由基和活性氧分子,需要消耗大量抗氧化酶和抗氧化活性物质,导致其总抗氧化能力降低,这与Braun 等[17],Trenzado等[24]的研究结果相一致。红鳍东方鲀在高密度条件下持续产生大量的自由基,而过多的自由基会攻击生物膜,生成脂质过氧化物,并最终分解成MDA。在本试验中,在较高密度条件下红鳍东方鲀肝脏MDA含量显著升高,这与Sahin 等[25]、王博文等[26]研究结果相吻合。红鳍东方鲀的脂质过氧化很可能是由密度胁迫引起的。但在以前的非洲鲶、大菱鲆密度胁迫试验中,鱼体在高密度条件下未发现脂质过氧化的现象,这可能与试验条件和养殖生物不同有关[10,12]。
4.5 不同质量浓度对鲀应激反应的影响
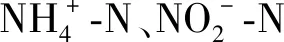
4.6 不同质量浓度对鲀抗氧化能力和脂质过氧化的影响
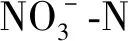
5 结论

[2] VERDEGEM M C J,BOSMA R H,VERRETH J A J.Reducing water use for animal production through aquaculture[J].Water Resources Development,2006,22(1):101-113.
[3] PIEDRAHITA R H.Reducing the potential environmental impact of tank aquaculture effluents through intensification and recirculation[J].Aquaculture,2003,226(1/4):35-44.
[4] SUMMERFELT S T,SHARRER M J,TSUKUDA S M,et al.Process requirements for achieving full-flow disinfection of recirculating water using ozonation and UV irradiation[J].Aquacultural Engineering,2009,40(1):17-27.
[5] TAL Y,SCHREIER H J,SOWERS K R,et al.Environmentally sustainable land-based marine aquaculture[J].Aquaculture,2009,286(1/2):28-35.
[6] SCHNEIDER O,BLANCHETON J P,VARADI L,et al.Cost price and production strategies in European recirculation systems[C].Conference:Aqua 2006:Linking Tradition & Technology Highest Quality for the Consumer,Firenze (Florence),Italy,9-13 May 2006.2006:855-855.
[7] ARLINGHAUS R,COOKE S J,SCHWAB A,et al.Fish welfare:a challenge to the feelings‐based approach,with implications for recreational fishing[J].Fish and Fisheries,2007,8(1):57-71.
[8] TURNBULL J,BELL A,ADAMS C,et al.Stocking density and welfare of cage farmed Atlantic salmon:application of a multivariate analysis[J].Aquaculture,2005,243(1/4):121-132.
[9] ADAMS C E,TURNBULL J F,BELL A,et al.Multiple determinants of welfare in farmed fish:stocking density,disturbance,and aggression in Atlantic salmon (Salmosalar)[J].Canadian journal of fisheries and aquatic sciences,2007,64(2):336-344.
[10]LIU B,JIA R,HAN C,et al.Effects of stocking density on antioxidant status,metabolism and immune response in juvenile turbot (Scophthalmusmaximus)[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2016,190:1-8.
[11]KIKUCHI K,IWATA N,FURUTA T,et al.Growth of tiger pufferTakifugurubripesin closed recirculating culture system[J].Fisheries Science,2006,72(5):1042-1047.
[12]WANG Q L,ZHANG H T,REN Y Q,et al.Comparison of growth parameters of tiger puffer Takifugu rubripes from two culture systems in China[J].Aquaculture,2016,453:49-53.
[13]朱建新,刘慧,徐勇,等.循环水养殖系统生物滤器负荷挂膜技术[J].渔业科学进展,2014,35(4):118-124.
[14]CHEN S,LING J,BLANCHETON J P.Nitrification kinetics of biofilm as affected by water quality factors[J].Aquacultural engineering,2006,34(3):179-197.
[15]VAN RIJN J,TAL Y,SCHREIER H J.Denitrification in recirculating systems:theory and applications[J].Aquacultural engineering,2006,34(3):364-376.
[16]GOOD C,DAVIDSON J.A review of factors influencing maturation of Atlantic salmon,Salmo salar,with focus on water recirculation aquaculture system environments[J].Journal of the World Aquaculture Society,2016,47(5):605-632.
[17]BRAUN N,DE LIMA R L,BALDISSEROTTO B,et al.Growth,biochemical and physiological responses ofSalminusbrasiliensiswith different stocking densities and handling[J].Aquaculture,2010,301(1/4):22-30.
[18]曹阳,李二超,陈立侨,等.养殖密度对俄罗斯鲟幼鱼的生长,生理和免疫指标的影响[J].水生生物学报,2014,38(5):968-974.
[19]FOSS A,KRISTENSEN T,ÅTLAND Å,et al.Effects of water reuse and stocking density on water quality,blood physiology and growth rate of juvenile cod (Gadusmorhua)[J].Aquaculture,2006,256(1/4):255-263.
[20]FOTEDAR R.Water quality,growth and stress responses of juvenile barramundi (LatescalcariferBloch),reared at four different densities in integrated recirculating aquaculture systems[J].Aquaculture,2016,458:113-120.
[21]HAN K,MATSUI S,FURUICHI M,et al.Effect of stocking density on growth,survival rate,and damage of caudal fin in larval to young puffer fish,Takifugu rubripes[J].Aquaculture Science,1994,42(4):507-514.
[22]KOTANI T,WAKIYAMA Y,IMOTO T,et al.Effect of initial stocking density on larviculture performance of the ocellate puffer,Takifugu rubripes[J].World Aquacult.Soc.2009,40:383-393.
[23]NAKAMURA I.Kumamoto Prefectural Fisheries Research Center[J].Nihon Suisan Gakkaishi,1994,60 (6):813-814.
[24]TRENZADO C E,MORALES A E,DE LA HIGUERA M.Physiological changes in rainbow trout held under crowded conditions and fed diets with different levels of vitamins E and C and highly unsaturated fatty acids (HUFA)[J].Aquaculture,2008,277(3/4):293-302.
[25]SAHIN K,YAZLAK H,ORHAN C,et al.The effect of lycopene on antioxidant status in rainbow trout (Oncorhynchusmykiss) reared under high stocking density[J].Aquaculture,2014,418:132-138.
[26]王博文,王建国,李爱华,等.拥挤胁迫后鲫鱼血液皮质醇和溶菌酶水平的变化及对病原的敏感性[J].中国水产科学,2004,11(4):408-412.
[27]GUILLETTE JR L J,EDWARDS T M.Is nitrate an ecologically relevant endocrine disruptor in vertebrates?[J].Integrative and Comparative Biology,2005,45(1):19-27.
[28]HAMLIN H J,MOORE B C,EDWARDS T M,et al.Nitrate-induced elevations in circulating sex steroid concentrations in femaleSiberiansturgeon(Acipenserbaeri) in commercial aquaculture[J].Aquaculture,2008,281(1/4):118-125.
[29]郭勤单,王有基,吕为群.温度和盐度对褐牙鲆幼鱼渗透生理及抗氧化水平的影响[J].水生生物学报,2014,38(1):58-67.
[30]ALIKO V,OIRJO M,SULA E,et al.Antioxidant defense system,immune response and erythron profile modulation in gold fish,Carassius auratus,after acute manganese treatment[J].Fish & shellfish immunology,2018,76:101-109.
[31]BERNTSEN M H G,AATLAND A,HANDY R D.Chronic dietary mercury exposure causes oxidative stress,brain lesions,and altered behaviour in Atlantic salmon (Salmosalar) parr[J].Aquatic Toxicology,2003,65(1):55-72.
[32]ROMEO M,BENNANI N,GNASSIA-BARELLI M,et al.Cadmium and copper display different responses towards oxidative stress in the kidney of the sea bass Dicentrarchus labrax[J].Aquatic Toxicology,2000,48(2/3):185-194.
[33]THOMAS P,WOFFORD H W.Effects of cadmium and Aroclor 1254 on lipid peroxidation,glutathione peroxidase activity,and selected antioxidants in Atlantic croaker tissues[J].Aquatic toxicology,1993,27(1/2):159-177.
