阿帕替尼对人涎腺腺样囊性癌生长抑制作用的体内外研究
2019-09-12吴丽红温智辉欧阳可雄贺轲葛林虎
吴丽红,温智辉,欧阳可雄,贺轲,葛林虎
(1.广州医科大学附属口腔医院·广州口腔疾病研究所·口腔医学重点实验室,广东 广州 510140; 2.中山大学中山医学院 生化教研室/教育部干细胞与组织工程重点实验室,广东 广州 510080)
人唾液腺样囊性癌(SACC)是最常见的头颈上皮恶性肿瘤之一,是唾液腺第二常见的恶性肿瘤[1-5]。SACC是一种生长缓慢但具有侵略性的肿瘤,约占人类头颈部上皮恶性肿瘤的27%。SACC界限不清,且有高度组织浸润性,容易沿着神经、血管浸润进入组织和破坏组织正常结构。手术、放射和化学药物治疗效果均不理想和常复发。其生长、浸润和转移依赖于肿瘤新生血管的形成[6-8]。
阿帕替尼(apatinib)是一种口服的血管内皮细胞生长因子受体2(VEGFR2)特异性抑制剂[7-11],能有效靶向作用于受体中的酪氨酸激酶,抑制VEGFR2分子信号转导,从而抑制血管内皮的更新和代谢,对多种癌症都有良好的治疗效果。阿帕替尼作为肺癌、结肠癌、胃癌等腺癌的靶向VEGFR2药物治疗效果良好,但在人头颈部腺癌治疗中鲜有报道。本文利用阿帕替尼作用于口腔腺样囊性癌细胞SACC83和裸鼠移植瘤模型,观察药物作用效果和对血管生成相关基因的影响,从而评估阿帕替尼治疗口腔腺样囊性癌的应用前景。
1 材料与方法
1.1 实验动物
12只6周龄健康的裸小鼠BALB/c-nu/nu,雌雄各半,购自南方医科大学实验动物中心,生产许可证号SCXK(粤)2016-0041。动物实验于广州医科大学附属第一医院[SYXK(粤)2013-0093 ]的SPF级环境中进行,室温为26~28 ℃,相对湿度保持在40%~60%,自由饮食,水和鼠料均经高压灭菌消毒。
1.2 主要试剂与仪器
主要试剂:阿帕替尼购于上海阿拉丁生化科技股份有限公司(A129753);噻唑蓝、二甲基亚砜(DMSO)均购自中国Sigma-Aldrich公司;血管生成因子芯片(Human Angiogeesis Array GS1)购自Raybiotech公司;细胞实验所涉及的主要试剂均购自赛默飞世尔科技(中国)有限公司。SACC83细胞系由广州医科大学口腔医学实验室保存。在实验开始前,需制备100 mmol/L阿帕替尼DMSO储存液。
主要仪器:HF151型CO2培养箱(上海力康);5810R型低温台式高速离心机(德国艾本德);Epoch2微孔板分光光度计(Biotek公司);Ariamx实时荧光定量PCR仪(Agilent Technologies)。
1.3 方法
1.3.1 不同浓度的阿帕替尼对SACC83细胞增殖的影响 SACC83 细胞培养体系:10%~15%胎牛血清、双抗(100 IU/mL青霉素+100 IU/ mL链霉素)、RPMI1640 培养基。SACC83 细胞相对于其他的口腔癌细胞生长缓慢。收取对数期生长阶段的SACC83细胞,制成细胞悬液,96孔板中每孔加入5 000个细胞,补充孔内培养基至100 μL。细胞贴壁后第2天分别用含有0、20、40、60、80、100、200、400、600、800、1 000 μmol/L阿帕替尼的无双抗、低血清(5%胎牛血清)RPMI1640培养基继续培养2 d或4 d,每个浓度和时间点复孔数为n=6。阿帕替尼作用结束后,MTT法测定细胞活力。MTT法测定细胞活力具体步骤参考文献[12],简单步骤如下:每孔加入20 μL的噻唑蓝(5 mg/mL)。2 h后终止培养,小心吸走孔内的培养基,孔内加入200 μL的DMSO,37 ℃温箱孵育10 min或摇床低速缓慢振荡10 min,用微孔板分光光度计检测各孔的吸光度值(A570 nm)。
1.3.2VEGFR2、肝细胞生长因子(HGF)、表皮细胞生长因子(EGF)和血管生成素(Angiogenin)基因表达水平的检测 采用荧光定量PCR方法检测VEGFR2、HGF、EGF和Angiogenin在PBS或者400 μmol/L阿帕替尼处理过的腺样囊性癌细胞SACC83的表达水平。
总RNA抽提:采用常规方法从PBS或者400 μmol/L阿帕替尼处理过的腺样囊性癌细胞SACC83抽提总RNA。
将VEGFR2、HGF、EGF和Angiogenin基因与GAPDH同时进行定量PCR扩增,记录各个基因扩增的ct值。定量PCR体系:上下游引物(20 μmol/L)各0.2 μL、反转录产物1 μL、ddH2O 8.56 μL,SYBR green-Taq 10 μL,50×ROX0.04 μL。引物序列见表1。定量循环条件:50 ℃ 2 min,95 ℃ 2 min,[95 ℃ 15 s,60 ℃(GAPDH)或60 ℃(HGF) 或60.5 ℃(EGF)或60 ℃(Angiogenin)或58 ℃(VEGFR2)30 s]40个循环。计算公式:Relative Quantification (ddCt)法,基因的平均相对含量=2-averageΔΔCt×100%(Ct值是表示每个PCR反应管内荧光信号到达设定的阈值时所经历的循环数)。

表1 定量PCR引物序列Table 1 Primers for real-time PCR amplication
1.3.3 裸小鼠皮下人涎腺腺样囊性癌移植瘤模型的建立与阿帕替尼治疗方案 处于对数生长期的SACC83细胞,用0.25%含EDTA胰酶消化、PBS冲洗和重悬SACC83细胞2次,最后使细胞悬液终浓度为4×107/mL。每只裸小鼠左侧腋窝皮下注射0.1 mL的SACC83细胞悬液,3~5 d左右便能观察到绿豆粒般体积的肿瘤块。此时,将成瘤的小鼠分成2组(n=6),每天每只裸小鼠分别瘤内注射0.1 mL的PBS或者400 μg/mL阿帕替尼,共注射2周。实验终止时安乐死动物,从裸小鼠皮下剥离移植瘤、称质量和测量肿瘤的长、宽,计算肿瘤体积。肿瘤体积计算公式:V(mm3)=长(mm)×宽(mm)2×0.5。
1.3.4 检测阿帕替尼治疗后血管生成因子的表达水平 从裸小鼠皮下剥离移植瘤,随机每组抽取3个样本的肿瘤块。根据Raybiotech公司生产的血管生成因子芯片(Human Angiogeesis Array GS1)试剂盒说明抽提蛋白和实施检测。
1.3.5 实验数据处理与分析 利用SPSS17.0进行数据统计与分析,使用Graphpad prism 5作图;实验数据用平均数±标准差表示,采用student’t test进行统计分析,P<0.05为差异有统计学意义。使用Graphpad prism 5计算阿帕替尼对SACC83细胞处理4 d的IC50。利用STRING 10.0分析VEGFR2、HGF、EGF和Angiogenin基因之间的相互作用关系。
2 结果
2.1 阿帕替尼对SACC83细胞增殖的影响
不同浓度的阿帕替尼分别作用于SACC83细胞系2 d和4 d,对其活力的影响是不同的。图1A和图1B结果显示,SACC83细胞活力随着阿帕替尼浓度的增加而显著降低。与PBS对照组比较,阿帕替尼组各浓度、各时间点细胞活力都显著下降(P<0.01)。当400 μmol/L阿帕替尼作用SACC83细胞,细胞活力达到较低水平[2 d,细胞活力为(53.1±2.3)%]或者最低水平[4 d,细胞活力为(38.7±3.7)%],并且增加浓度不会引起细胞活力发生太大的变化,作用效果趋于稳定。图1C显示阿帕替尼对SACC83细胞抑制的最佳浓度为400 μmol/L,最佳作用时间为4 d(96 h),此时400 μmol/L阿帕替尼能有效抑制SACC83细胞增殖,抑制率约为61.3%。阿帕替尼对SACC83细胞处理4 d的IC50为(179.26±2.3)μmol/L。
2.2 阿帕替尼对血管生成相关基因VEGFR2、HGF、EGF和Angiogenin mRNA表达水平的影响
图2结果显示,阿帕替尼处理组与PBS对照组比较,VEGFR2、HGF、EGF和Angiogenin基因在400 μmol/L阿帕替尼处理4 d的人涎腺腺样囊性癌细胞中mRNA表达水平显著低于对照组,差异有统计学意义(P<0.05)。
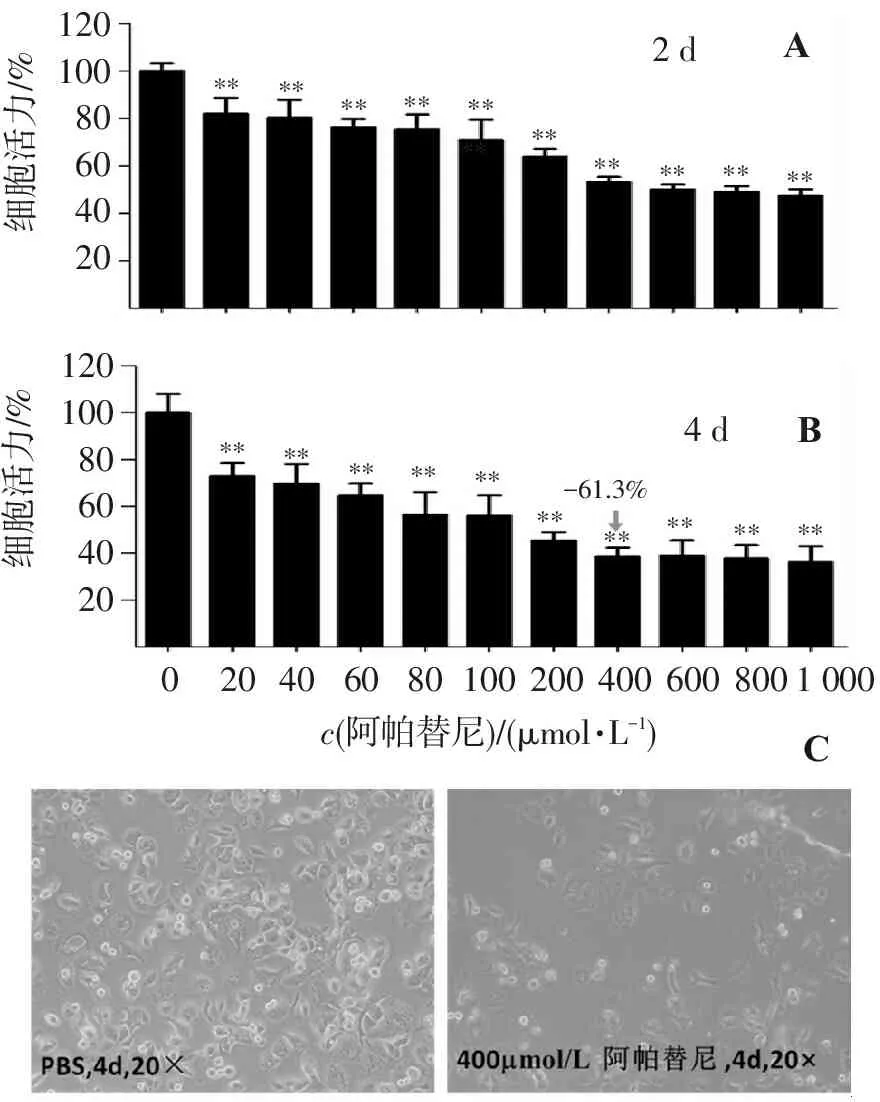
1201008060402012010080604020****************************************细胞活力/%2d4d-61.3%细胞活力/%c(阿帕替尼)/(μmol?L-1)**1000100200400600800020406080ABC
A. 2 d时细胞活力; B.4 d时细胞活力。与0 μmol/L的阿帕替尼处理组比较:**P<0.01; C.最佳浓度和作用时间摸索:400 μmol/L阿帕替尼对SACC83细胞处理4 d。
图1不同浓度的阿帕替尼在不同时间点对SACC83细胞增殖影响
Figure1Effect of different concentrations of apatinib on the proliferation of SACC83 cells
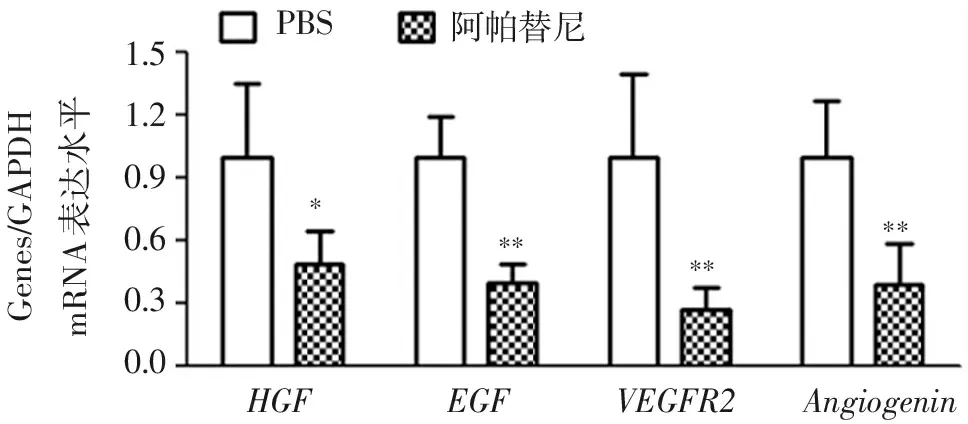
PBS阿帕替尼1.51.20.90.60.30.0mRNA表达水平Genes/GAPDH*******HGFEGFVEGFR2Angiogenin
与PBS组比较:*P<0.05,**P<0.01。
图2血管生成相关的基因mRNA表达水平
Figure2mRNA expression of angiogenesis-related genesVEGFR2,HGF,EGFandAngiogenin
2.3 阿帕替尼对裸小鼠SACC细胞皮下移植瘤的生长和血管生成因子的蛋白表达水平影响
给药后14 d,与阿帕替尼组相比,PBS对照组裸小鼠出现饮水、采食量显著减少,体形消瘦明显,有2只裸鼠移植瘤周围出现大小不等的卫星癌灶。与阿帕替尼注射前相比,阿帕替尼组裸鼠进水未见异常,采食量和体质量略有降低,移植瘤周围未见卫星癌灶。实验结束安乐死裸小鼠,剥离肿瘤组织称重和测量肿瘤的长径和短径,计算肿瘤的体积大小。
图3结果显示,与PBS对照组相比,瘤内注射0.1 mL的400 μg/mL阿帕替尼14 d后,肿瘤明显缩小(图3A),肿瘤的质量和体积分别只有对照组的31.4%[图3B,对照组(1 216.5±120.04) mg和10.6%[图3C,对照组(1 790.25±467.92) mm3]。利用血管生成因子芯片检测移植瘤体中血管生成因子的表达水平,图4结果显示,阿帕替尼治疗后,HGF、EGF和Angiogenin因子表达水平极显著地锐减,表达水平分别只有未治疗组的15.7%(对照组,因子与内参灰度值比:0.46±0.11)、8.6%(对照组,因子与内参灰度值比:0.18±0.06)和5.9%(对照组,因子与内参灰度值比:0.08±0.02)。
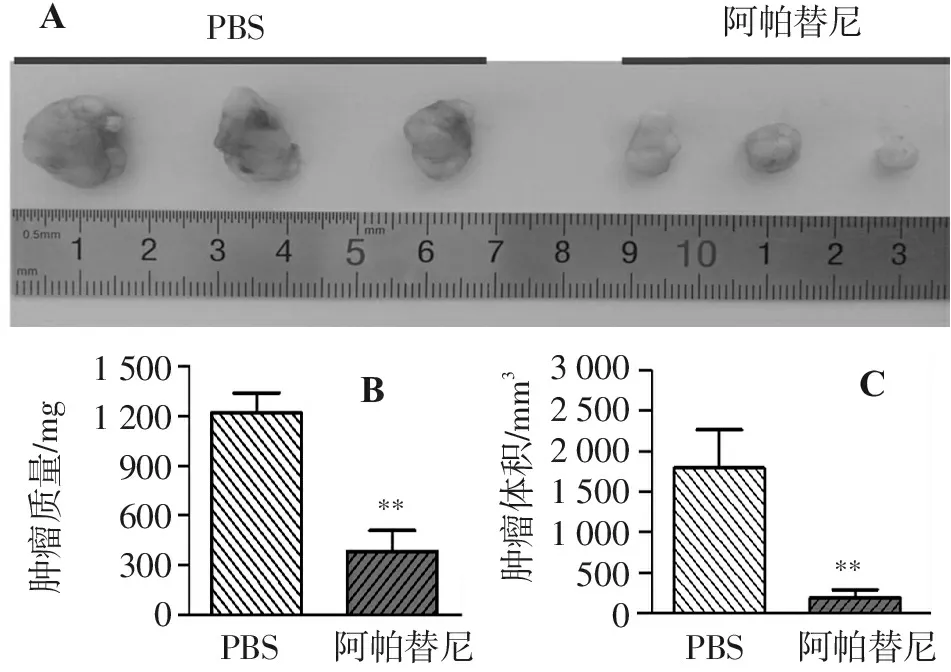
PBS阿帕替尼150012009006003000肿瘤质量/mgPBS阿帕替尼****肿瘤体积/mm3300025002000150010005000阿帕替尼PBSABC
A. 剥离肿瘤大体图(随机抽取每组3只裸小鼠的肿瘤展示);B.肿瘤质量;C.肿瘤体积。与PBS组比较:**P<0.01。
图3阿帕替尼对裸小鼠SACC83细胞皮下移植瘤生长的影响
Figure3Effect of apatinib on the growth of subcutaneous transplantation tumor of SACC83 cells in nude mice
2.4 血管生成相关基因VEGFR2、HGF、EGF和Angiogenin的分子网络作用关系
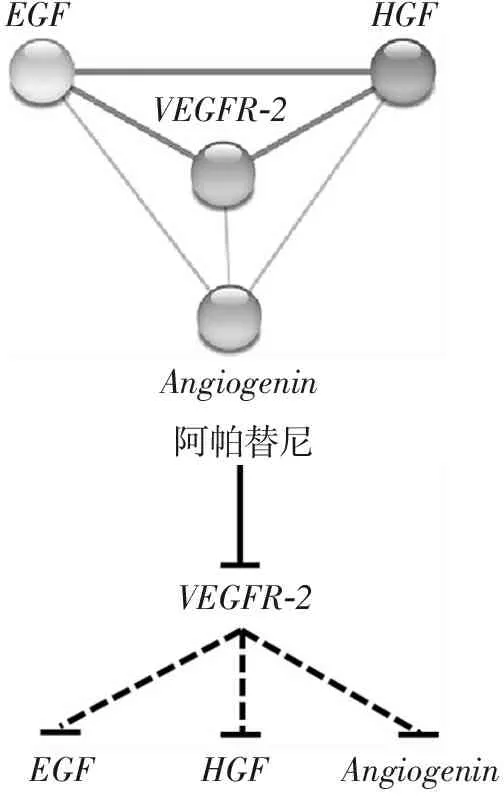
利用STRING 10.0进行分子网络关系分析,图5A结果显示,VEGFR2处于HGF、EGF和Angiogenin网络关系的较为核心的位置,提示阿帕替尼可能通过抑制VEGFR2下调HGF、EGF和Angiogenin基因的表达水平。
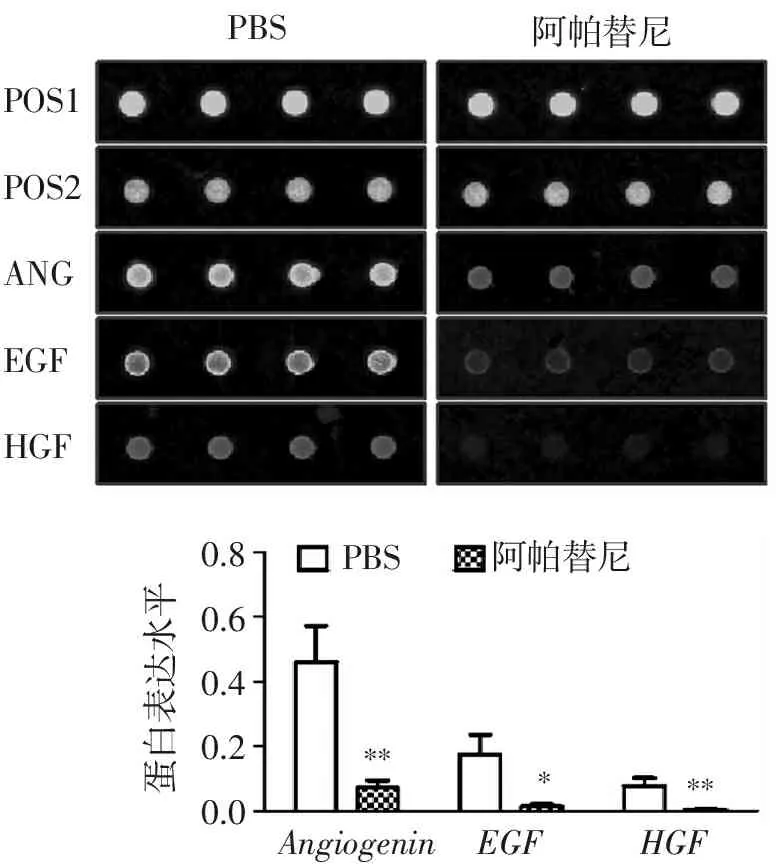
POS1POS2ANGEGFHGFPBS阿帕替尼PBS阿帕替尼0.80.60.40.20.0蛋白表达水平AngiogeninEGFHGF*****
与PBS组比较:*P<0.05,**P<0.01。
图4阿帕替尼对裸小鼠SACC83细胞皮下移植瘤中HGF、EGF和Angiogenin因子表达水平的影响
Figure4Effect of apatinib on the expression ofHGF,EGFandAngiogeninprotein in subcutaneous transplantation tumor of SACC83 cells in nude mice
EGFHGFVEGFR-2Angiogenin阿帕替尼VEGFR-2EGFHGFAngiogenin
A.血管生成相关基因VEGFR2、HGF、EGF和Angiogenin分子网络关系; B.阿帕替尼作用机制预测分析。线的粗细代表分子之间的关系密切程度,线越粗代表关系越紧密,反之亦然。
图5血管生成相关基因VEGFR2、HGF、EGF和Angiogenin分子网络关系分析
Figure5Molecular network of angiogenesis-associated genesVEGFR2,HGF,EGFandAngiogenin
3 讨论
人涎腺腺样囊性癌患者目前主要采用手术治疗,术后严重影响容貌和生活质量,术后也可能进食困难和营养状况较差,也可影响化疗方案的耐受性。目前,头颈部腺癌临床化疗主要使用多西他赛、卡培他滨和5-FU等药物。以上化疗药物副作用较大,疗效也不够理想。SACC患者的肿瘤组织中往往VEGFR2高表达,因而本课题组设想,抗血管生成的靶向药可能对治疗SACC有效。因此,若能通过VEGFR2靶向药物,特定地只对癌症组织和肿瘤血管起破坏或抑制作用,将会大大提高癌症患者的生存率。
阿帕替尼是VEGFR2特异性抑制剂,是口服药物,副作用少[13-15]。在临床阿帕替尼应用到晚期非小细胞肺癌腺癌、结肠癌、胃癌、肝癌以及乳腺癌等癌症有显著疗效[16-18]。阿帕替尼不仅可以直接抑制癌细胞增殖,还可以通过抑制增殖相关信号通路的激活、阻碍细胞周期过程,从而抑制血管的生成来发挥抗肿瘤作用。阿帕替尼对于头颈部癌的治疗作用尚不明确,更鲜有阿帕替尼治疗人涎腺腺样囊性癌的报道。如果将阿帕替尼应用于治疗涎腺腺样囊性癌患者,阻止肿瘤形成过程中血管和微血管生成及肿瘤和细胞增殖,便可阻碍肿瘤组织和肿瘤细胞的生长、增殖,在控制癌症治疗和预后转归中发挥重要的辅助治疗作用。
本研究利用400 μmol/L阿帕替尼作用于SACC83细胞4 d,细胞活力显著降低约39%,抑制效率高且效果显著,说明阿帕替尼可有效抑制人涎腺腺样囊性癌细胞株SACC83的生长。另外本研究利用SACC83细胞构建裸小鼠涎腺腺样囊性癌移植瘤模型,结果显示,阿帕替尼组裸小鼠每天瘤内注射0.1 mL的400 μg/mL阿帕替尼,14 d时阿帕替尼组移植瘤体积约只有PBS对照组体积的1/10,说明阿帕替尼具有抗裸小鼠人涎腺腺样囊性癌移植瘤生长的作用。以上体内外实验结果提示,阿帕替尼在人涎腺腺样囊性癌组织和人涎腺腺样囊性癌细胞生长中发挥重要抑制作用,与阿帕替尼在其他组织器官腺癌中的研究结果一致。
阿帕替尼能竞争性地抑制VEGF与VEGFR2结合,阻断VEGFR2自动磷酸化过程和抑制肿瘤血管的生成,从而发挥强有力的抗肿瘤作用[19-20],并不会导致VEGFR-2表达下调。但本文结果显示阿帕替尼下调SACC83自身VEGFR2基因mRNA表达,推测可能与VEGFR2基因代偿性表达有关,阿帕替尼竞争性地抑制VEGF与VEGFR2结合,致使VEGF的功能作用发挥受阻,迫使细胞代偿性的增加了VEGFR2基因mRNA的表达。HGF是一种可促分裂、分化和侵袭运动及诱发血管生成的多肽类生长因子,其与受体c-Met结合后可以使酪氨酸蛋白激酶信号通路活化和磷酸化。EGF具有刺激上皮细胞运动和参与上皮形成的功能,肿瘤组织和肿瘤细胞中可见EGF表达水平升高。Angiogenin是促进内皮细胞生长和血管生成的关键因子之一。它是核糖核酸酶超家族成员,在不同类型的肿瘤细胞中有较高的表达,它不但与血管内皮细胞的增殖、迁移和血管生成有关,还与肿瘤的发生发展进程、侵袭转移和微血管的形成密切相关。本实验利用STRING 10.0进行基因之间网络关系分析,发现阿帕替尼可能通过的VEGFR2下调HGF、EGF和Angiogenin基因mRNA和蛋白的表达水平,但阿帕替尼如何通过抑制VEGFR2调控HGF、EGF和Angiogenin,有待本课题组继续深入研究。
本研究通过细胞活力、裸小鼠实验、基因表达水平分析和生物信息学分析,初步证明阿帕替尼可抑制SACC细胞的增殖和下调SACC83细胞VEGFR2、HGF、EGF和Angiogenin的mRNA或蛋白表达,为临床利用阿帕替尼治疗人SACC提供实验科学依据。
