别旁茶乙醇提取物对炎症性肠病的保护作用
2019-09-10谢方镕高磊李思荃邓广辉聂玉强宋雨鸿
谢方镕,高磊,李思荃,邓广辉,聂玉强,宋雨鸿
(1.广州医科大学附属市一人民医院,广东 广州 510180; 2.南方医科大学中医药学院,广东 广州 510515; 3.南方医科大学中西医结合医院,广东 广州 510315; 4.广州市干部疗养院消化内镜科,广东 广州 510530)
炎症性肠病(IBD)是一种临床常见但病因不明并且治疗困难的疾病,临床常见溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)2种亚型,在经济较为发达的国家及地区发病率非常高。近年来不少研究发现,肠道黏膜上皮的完整性破坏是IBD发病的关键步骤,以保护肠道黏膜上皮完整从而防止疾病的发生发展为切入点治疗IBD具有巨大潜力[1]。别旁茶(Bie Pang Cha,BPC)是一种具有悠久胃肠道疾病治疗历史且药效可靠的民族药物,是木犀科素馨亚科素馨属扭肚藤种扭肚藤Jasminumelongatum(Bergium) Willd的干燥嫩茎及叶[2]。它具有强大的抗炎止泻镇痛作用,临床上常用于治疗胃肠炎[3]。有研究显示,BPC的甲醇提取物通过作用于基底外侧β-肾上腺素受体从而抑制胃肠道Cl-的分泌,这一现象提示该药可以减少平滑肌运动、减少排便频率,并且可能还具有抗分泌作用,从而达到止泻、收敛作用[4- 5]。国内外对BPC乙醇提取物的成分及其对肠道黏膜完整性影响的研究较少。本课题组对BPC的乙醇提取物进行了系列研究,从中提取鉴定出25种化学成分[6]。后续的体内体外实验证明了BPC乙醇提取物对TNBS诱导的大鼠IBD模型具有保护作用,并能通过NF-κB途径减轻LPS诱导的细胞炎症[7- 8]。由于TNBS诱导的IBD模型与CD更为相近,而与UC相似的IBD模型的作用研究领域尚是空白,故本次实验使用葡聚糖硫酸钠(Dextran sulfate sodium,DSS)诱导小鼠UC模型,观察BPC乙醇提取物对UC小鼠的结肠有何影响,并探索其可能的作用机制[9]。
1 实验材料
1.1 实验动物
6~7周龄C57BL/6小鼠24只,雄性,SPF级,体质量22~24 g,由济南朋悦实验动物繁育有限公司提供,生产许可证号:SCXK(京)2014-0004。
1.2 主要试剂与药品
主要试剂:无水乙醇、石油醚(60-90,天津大茂);DSS (36000-50000,MP);RIPA裂解液(Sigma);BCA蛋白定量试剂盒(Thermo);GTVsion III型免疫组化检测试剂盒(上海基因科技);TUNEL试剂盒(Roche,批号11684795919);Anti-Claudin-1抗体(ThermoFisher,71-7800);Anti-iNOS抗体(abcam,ab178945); Anti-p-stat3抗体(CST,9145S)。
主要药品:别旁茶Jasminumelongatum(Bergium) Willd购自广州市清平药材市场,经广州中医药大学谢友良老师鉴定,存放于南方医科大学中医药学院分子生物学实验室,存放编号:201809001。
1.3 主要仪器
BS224S1DFY-500型摇摆式高速中药粉碎机(温岭市林大机械有限公司);RE52-05型旋转蒸发器(上海亚荣生化仪器厂);电热恒温水浴箱(SPACER,Taiwan);B×60倒置显微镜(Nikon,Japan);光学显微照相系统(Nikon,Japan),Centrifuge5840R超速低温离心机(eppendorf,Germany);RM2245轮转石蜡切片机(Leica,Germany);EG1160包埋机(Leica,Germany);CM-1850冰冻切片机(Leica,Germany);Mini-Protein电泳槽(Bio-Rad,USA);直流稳压电源(Bio-Rad,USA);电热恒温干燥箱(湖北黄石恒丰医疗器械);十万分之一电子分析天平(Meilteler,Germany);-80 ℃超低温冰箱(海尔,中国)。
2 方法
2.1 BPC醇提物的制备
使用宋雨鸿等“一种别旁茶提取物的制备方法及其应用”专利中描述的提取方法制备BPC醇提物[12]。具体操作如下:将BPC药材粉碎,加10倍60%(φ)乙醇加热回流提取2次,每次提取1 h,合并提取液,过滤,得醇提液;将醇提液减压回收乙醇,用水定容浓缩液至0.25 g原药/mL,并用石油醚脱色,得水提液;水提液用大孔树脂吸附,2倍体积水洗脱,弃水洗液,分别用3倍体积的30%、50%、70%乙醇洗脱,收集各自洗脱液,减压回收乙醇至相对密度为1.05~1.15时,喷雾干燥得到各个浓度BPC醇提物,密封4 ℃保存。通过观察醇提物成品发现30%和50%的乙醇提取物呈膏状黏稠物,试图用蒸馏水进行溶解时,药物沉于试管底部呈不溶状态。经过超声、振荡、水浴等操作后药物虽有少量溶解,但依然有较大体积的不溶物附着于食管底部。预实验时,取相应溶液灌胃后,小鼠各项指标与模型组小鼠相近,差异无统计学意义(P<0.05),且无法准确进行溶液含药量计算,故而弃用。70%乙醇提取物成干燥粉末状物质,用蒸馏水溶解发现大部分药物可溶于水,有少量不溶物也可形成均质悬浊液进行灌胃,操作方便,易于计算,且大部分检测指标与模型组相比有统计学意义(P<0.05),故选用70%乙醇提取物进行后续实验。
2.2 动物分组及给药处理
24只小鼠按计算机生成的随机数字表随机分成4组,每组6只,分别为对照组、模型组、别旁茶低剂量组、别旁茶高剂量组。对照组小鼠每日自由饮用水瓶中的灭菌水,并且用灭菌水灌胃0.5 mL/d。将模型组及其余给药实验组水瓶中的灭菌水换成含3%DSS的灭菌水溶液供小鼠自由饮用。此外,模型组小鼠每日用灭菌水灌胃0.5 mL/d,别旁茶低剂量组和别旁茶高剂量组的小鼠每日用别旁茶70%乙醇提取物的药液灌胃,给药量分别为3、6 g/kg体质量。制备药液时控制药物浓度,使每只小鼠的灌胃体积为0.5 mL/d左右。其余饲养条件如温度、湿度、光照、饲料等均一致。
2.3 实验动物样品制备
造模时长为1周,各组小鼠模型完成后,用200 mg/kg戊巴比妥腹腔注射麻醉小鼠。待小鼠充分麻醉后,将其固定于处置台上并充分暴露小鼠胸部。使用1 mL注射器,经心脏采血。保持针尖与皮肤呈30°角,从小鼠的剑突下的方向进针刺入心脏,缓慢地抽动注射器针芯,保持注射器内的负压,小鼠血液随着心脏搏动自然进入注射器,取0.8~1 mL血液后拔出针尖。全血在4 ℃静置过夜后,3 000 r/min离心10 min,分离上层血清,置于-80 ℃超低温冰箱以备用。然后用眼科剪迅速剪开小鼠胸骨及膈肌,暴露心脏,用灌注针插入心尖部位(左心室)并用止血钳固定。打开灌注仪,同时用眼科剪在右心耳剪开1个小口,通过心脏灌注将小鼠体内的血液用PBS缓冲液排除,持续3~5 min,直至肝脏及肾脏发白,停止灌注。随后迅速将小鼠结肠整段取出,测量结肠长度并记录。将肠道内容物用PBS溶液冲洗干净,取1~2 cm末段结肠浸泡在4%PFA溶液中固定,24 h后进行组织修整并做切片处理(冰冻切片和石蜡切片)。剩余新鲜样本置于-80 ℃超低温冰箱保存备用。
2.4 模型评价方法
2.4.1 小鼠一般情况评价 在小鼠给药期间,每日记录小鼠体质量变化、活动状态、粪便状态、便血情况等并记录,按照文献所述的方法进行DAI评分并统计[13]。处死小鼠后立即取出结肠,测量结肠长度。
2.4.2 组织结构改变及炎症损伤程度评价取完整的小鼠结肠1~2 cm置于4%(φ)多聚甲醛溶液中脱水固定,室温静置24 h后用乙醇二甲苯脱水,石蜡包埋。并用石蜡切片机将组织切成4 μm厚度贴于载玻片上。用苏木素/伊红染色、中性树脂封片后于光学显微镜下观察肠道病理改变并采集图像。在双盲的条件下根据病理评分标准对每张病理切片进行评分,记录并统计评分结果[13]。
2.5 Western blot实验
2.5.1 蛋白提取 处死小鼠后取新鲜结肠组织100 mg,加入200 μL蛋白裂解液(96%RIPA+2%蛋白酶抑制剂+2%磷酸酶抑制剂)后超声裂解,4 ℃冰箱静置30 min。置于4 ℃离心机12 000 r/min离心30 min取上清。用BCA蛋白浓度检测试剂盒检测所提取蛋白的浓度。剩余上清加入Loading Buffer后98 ℃变性10 min,-80 ℃冰箱保存。
2.5.2 蛋白电泳 配制11%分离胶和5%压缩胶置于蛋白电泳槽中,每孔按蛋白总量30 μg上样,90 V电压电泳至溴酚蓝进入分离胶,调整电压至120 V电泳,当溴酚蓝接近分离胶底端时终止电泳。将凝胶在370 mA的电流下转膜2 h,取出转膜后的PVDF膜置于5%BSA溶液中室温封闭2 h。封闭结束后将相应的条带放入稀释的一抗中4 ℃轻摇过夜,用TBST清洗后再置于稀释的二抗中4 ℃孵育2 h。滴加显影液,于暗室中曝光显影并采集图像。
2.6 免疫组化实验
取石蜡切片,用二甲苯和乙醇脱蜡,用PBS清洗切片并将切片浸入枸橼酸溶液后置于微波炉中保持微沸状态10 min进行抗原修复。待切片温度降为室温后用3%H2O2-甲醇溶液浸泡10 min。PBS清洗切片,滴加2.5%山羊血清-triton溶液室温封闭2 h。滴加稀释后的一抗溶液4 ℃孵育过夜,用PBS清洗后用免疫组化试剂盒进行二抗孵育及DAB显色。最后用苏木素染核,盐酸酒精分化,乙醇二甲苯脱水,中性树脂封片。将切片置于光学显微镜下观察蛋白表达情况并采集图像。
2.7 TUNEL(凋亡)实验
取冰冻切片,用PBS溶液清洗OCT胶,并将切片浸入枸橼酸溶液室温静置8 min。PBS清洗后用TUNEL试剂盒进行凋亡细胞染色。再用PBS清洗后滴加DAPI室温孵育5 min。最后PBS清洗后,用抗荧光淬灭的封片剂封片。将切片置于荧光显微镜下观察结果并采集图像。
2.8 图形及统计学处理
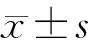
3 结果
3.1 别旁茶对小鼠一般情况的影响
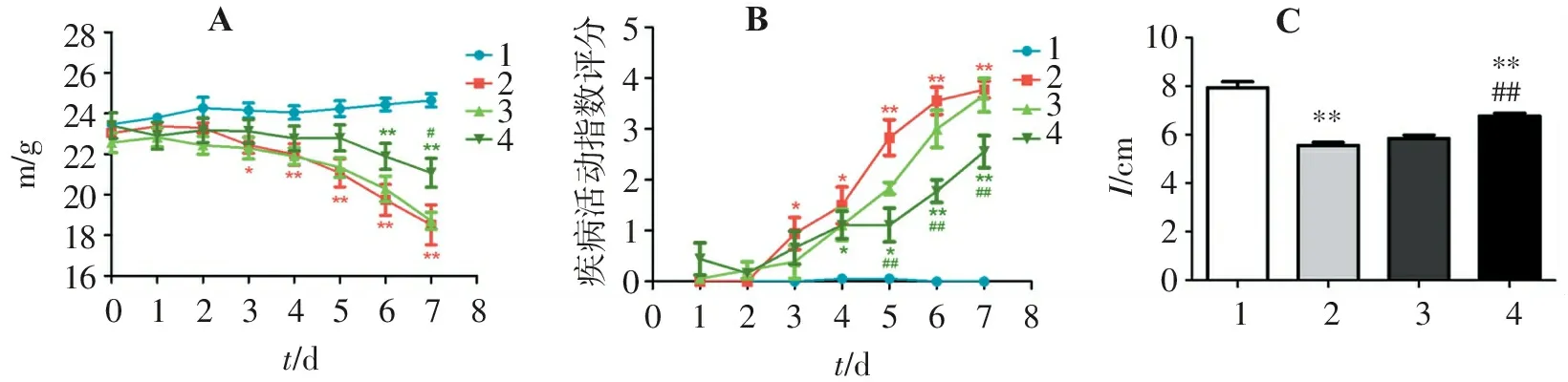
模型组小鼠体质量明显下降,在造模第3天开始与对照组相比差异有统计学意义(P<0.05)。别旁茶低剂量组小鼠的体质量变化曲线与模型组相似,两组小鼠的体质量变化差异无统计学意义(P>0.05)。别旁茶高剂量组小鼠的体质量下降速度与模型组小鼠相比更加缓慢,与对照组相比,直到造模第6天才出现明显的统计学差异(P<0.01)。此外,别旁茶高剂量组小鼠体质量的下降幅度也小于模型组小鼠(P<0.05)(图1A)。
与对照组相比,各实验组小鼠的DAI评分均增高并具有统计学意义(P<0.05),其中模型组DAI评分与对照组相比出现差异的时间最早、增加速度最快。别旁茶低剂量组DAI评分变化曲线与模型组相比虽然增加速度略有减缓,差异无统计学意义(P>0.05),且在造模后期的评分均值接近模型组。别旁茶高剂量组DAI评分明显低于模型组,在造模中后期可以观察到与模型组相比具有明显的改善作用(P<0.01)(图1B)。
模型组小鼠结肠明显短于对照组,差异有统计学意义(P<0.01),别旁茶低剂量组小鼠的结肠长度与模型组相比差异无统计学意义(P>0.05),别旁茶高剂量组的小鼠结肠与模型组相比更长,且差异有统计学意义(P<0.01)(图1C)。
3.2 别旁茶对小鼠结肠病理结构及炎症程度的影响
与对照组相比,模型组小鼠结肠出现明显的上皮结构紊乱,大量炎性细胞浸润,黏膜下水肿,间隙增宽。而别旁茶低剂量组和别旁茶高剂量组小鼠结肠上皮结构清晰,黏膜层和黏膜下层仅有少量炎性细胞浸润,黏膜下层水肿不明显。病理评分显示高剂量别旁茶醇提物组小鼠结肠损伤与模型组比较有明显改善(P<0.05),而低剂量别旁茶醇提物差异无统计学意义(P>0.05)(图2)。
28262422201816m/g012345678t/d1234543210疾病活动指数评分12340123456781234****##1086420I/cmt/dABC
A.小鼠体质量变化; B.疾病活动指数改变; C.结肠长度(1.对照组; 2.模型组; 3.别旁茶低剂量组; 4.别旁茶高剂量组)。与对照组比较:*P<0.05,**P<0.01; 与模型组比较:#P<0.05,##P<0.01。
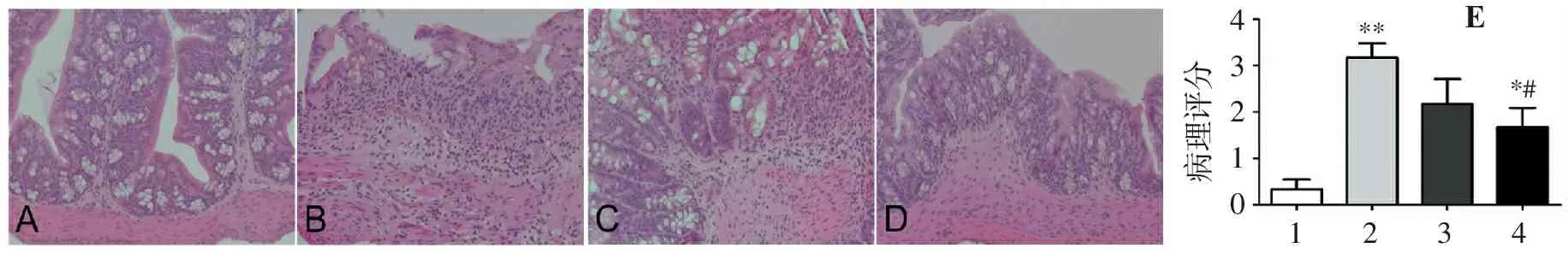
图1 各组体质量、DAI评分及结肠长度变化图Figure 1 Changes of body weight,DAI score and colon length in each group
A.对照组; B.模型组; C.别旁茶低剂量组; D.别旁茶高剂量组; E.病理评分统计(1.对照组; 2.实验组; 3.别旁茶低剂量组; 4.别旁茶高剂量组); 与对照组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05。
图2各组小鼠结肠病理改变(HE染色,100×)
Figure2Colon pathological changes of mice in each group (HE staining,100×)
3.3 别旁茶对小鼠肠道紧密连接蛋白表达的影响
对照组肠道黏膜上皮可见明显的紧密连接蛋白Claudin-1蛋白的表达,模型组Claudin-1蛋白的表达明显下降。别旁茶低剂量组小鼠肠道中Claudin-1蛋白的表达情况与模型组相近,而别旁茶高剂量组小鼠肠道中Claudin-1蛋白的表达与模型组相比有明显增加(图3)。

A.对照组; B.模型组; C.别旁茶低剂量组; D.别旁茶高剂量组。
图3各组小鼠结肠Claudin-1蛋白的表达(免疫组织化学染色;放大倍数:大图100×,小图400×。
Figure3Expression of colon Claudin-1 protein in mice of each group (Immunohistochemical staining; Magnification: large image 100×,small image 400×)
3.4 别旁茶对小鼠肠道上皮细胞凋亡的影响
镜下观察发现,与对照组相比,模型组小鼠结肠中凋亡的上皮细胞明显增多,表现为大量的点片状绿色荧光,而别旁茶醇提物组小鼠结肠上皮细胞凋亡情况和模型组相比均有明显改善,其中高剂量组改善情况更佳(图4)。
3.5 别旁茶醇提物对小鼠结肠中iNOS蛋白和p-Stat3蛋白表达的影响
Western blot结果可以观察到模型组小鼠结肠组织中iNOS蛋白、p-Stat3蛋白表达均增高,别旁茶醇提物低剂量组中相应蛋白表达与模型组相比无明显改善,而高剂量别旁茶醇提物可以明显减轻这种改变。(图5)。
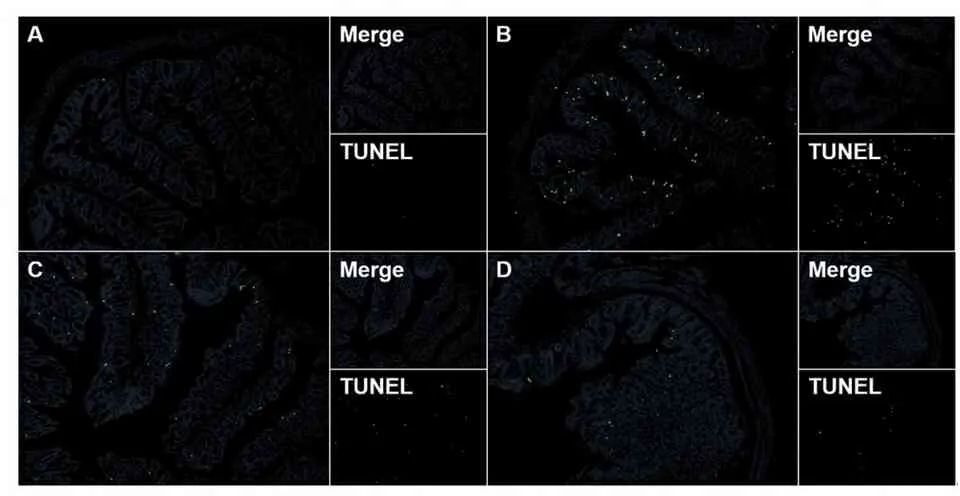
A.对照组; B.模型组; C.别旁茶低剂量组; D.别旁茶高剂量组。
图4各组小鼠结肠细胞凋亡情况(TUNEL染色,100×)
Figure4Apoptosis of colon cells in mice of each group (TUNEL staining,100×)

GAPDHp-STAT3iNOS12341.51.00.50.0p-STAT31.51.00.50.0iNOS***##*#12341234ABC
A.iNOS蛋白、p-Stat3蛋白表达图; B.p-Stat3蛋白表达量化图; C. iNOS蛋白表达量化图(1.对照组; 2.实验组; 3.别旁茶低剂量组;4.别旁茶高剂量组)。与对照组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01。
图5各组小鼠结肠蛋白的表达
Figure5Expression of colon protein in mice of each group
4 讨论
IBD是一种以胃肠道慢性炎症为特征的自身免疫疾病,已成为消化系统的主要疾病之一,在临床上常见UC和CD 2种亚型。该病在发达国家常见,近年来有全球化的趋势,而且IBD也逐渐引起很多亚洲国家的重视[14]。随着生活水平的提高,我国IBD的发病率也逐年上升,这可能与人们生活习惯、饮食结构、工作压力、环境污染等因素有关。与健康人群相比,IBD患者患肿瘤、冠状动脉疾病及帕金森病等其他系统疾病的风险更高[16,21]。该病主要的临床表现有腹痛,里急后重、黏液脓血便、体质量减轻等。
IBD的发病机制十分复杂,与环境、遗传、感染和免疫等因素都密切相关[17]。最近有研究表明,肠黏膜屏障尤其是其中机械屏障的完整性是影响IBD发病的关键环节。若屏障的完整性受到破坏,如黏膜上皮细胞病理性脱落、上皮细胞间的紧密连接被破坏等都会增加机体患IBD的几率[19,24]。Sharma D等[20]发现,地中海热病基因(MEFV)通过介导IL-18成熟促使肠上皮完整以限制DSS诱导的损伤和炎症。Mohanan V等[21]研究证明C1orf106(一种结肠炎风险基因)可通过调节上皮黏附连接的稳定性从而改变肠黏膜屏障完整性,使溃疡性结肠炎的发病风险增加。另外,MA Yanlei等[22]证明了条件性敲除小鼠ACF7基因所致的肠上皮紧密连接受损会影响肠上皮细胞的迁移和肠道伤口修复的速度,从而增加小鼠对实验性结肠炎的易感性。小鼠敲除肠上皮屏障完整性必需因子HNF4α后,肠道上皮通透性上升、肠道炎症加重[23-24]。
本次实验使用浓度为3%的DSS饲养C57BL/6小鼠以建立稳定的IBD小鼠模型。随着造模时间的推移,小鼠出现体质量降低、活动减少、毛发杂乱、血便等症状。病理染色和凋亡实验等结果显示小鼠结肠出现黏膜结构紊乱、上皮细胞凋亡增加,而免疫组化结果则显示小鼠结肠上皮Claudin-1蛋白降低,这些现象表明IBD小鼠的肠道黏膜屏障受损、通透性增加。
目前临床上对IBD治疗的目标是:诱导并维持临床缓解及黏膜愈合,防治并发症,改善患者生命质量,加强对患者的长期管理[25]。其药物选择一般是氨基水杨酸制剂、激素类、硫嘌呤类药物、甲氨蝶呤等。这些药物刺激性大、副作用多且价格昂贵,且对肠道黏膜有一定的损伤,科学家们一直在寻找更多的有效治疗方式。研究发现,中医药可以通过减轻病变肠道的炎症反应、恢复肠黏膜和血管通透性、纠正免疫功能紊乱等途径修复肠道黏膜屏障,缓解IBD急性期症状并防止其复发,在IBD的治疗上具有广阔的前景[26]。
别旁茶是一种常见的传统瑶药,又名扭肚藤,分布于山地疏林或密林中,非常常见且易于采集,可用于治疗胃肠炎、消化不良、痢疾、湿热腹痛等疾病,是临床用药“腹可安片”的主要成分。研究显示,本药含有丰富的环烯醚萜苷类、黄酮类及黄酮苷类、东莨菪素等化合物,这些成分均有一定的抗炎止泻作用[6,27-28]。此外,本药还在多种IBD的动物模型中验证过其防治炎症、镇痛和抗腹泻的作用。李思荃等[8]的研究表明别旁茶苷通过上调PXR,抑制NF-κB p65表达进而抑制IL-8分泌从而保护CRL-1790细胞免受炎症侵害。随着研究的深入,有研究表明别旁茶提取物对TNBS诱导的IBD大小鼠模型均具有显著的保护作用,可明显改善结肠组织的病理损伤并使TNF-α、IL-1β、IL-6、IL-27、MPO水平降低,同时增高SOD水平[7,29]。
本次实验使用70%乙醇提取部分对IBD小鼠模型进行干预,结果显示BPC对IBD模型小鼠具有保护作用,尤其浓度为0.24 g/mL的高剂量别旁茶醇提物对疾病的改善效果最好。它可以显著地缓解小鼠的便血情况,减缓小鼠体质量减轻的速度,改善结肠短缩症状,结肠上皮炎性浸润情况也得到有效控制。本研究发现BPC醇提物抑制IBD小鼠模型Claudin-1蛋白的降低并减少上皮细胞的凋亡,对保持肠道屏障的完整性有一定作用,可以加强肠道抵御微环境中损害因素的能力。此外,本实验还发现高剂量的别旁茶醇提物可以降低由造模药物引起的小鼠结肠组织中iNOS、p-Stat3蛋白表达的升高。这提示别旁茶发挥保护作用的途径很可能与氮氧应激及Stat3信号通路的转录激活相关。综上所述,本实验提示别旁茶醇提物可能通过调控氮氧应激、Stat3信号通路的转录激活等途径保护IBD小鼠的肠道完整性,这一发现为IBD的治疗及民族医药的开发应用提供了新的方向。
本实验还存在一些不足之处,如未设置西药干预组探讨BPC醇提物与西药治疗效果的比较以及未深入探讨氮氧应激和Stat3通路对该模型的直接作用。这些不足之处将在后续实验中进一步讨论完善。
