油樟叶精油馏分的主要成分、抑菌活性及其主要单体成分抑菌机理研究
2019-09-11胡文杰戴彩华周升团
胡文杰 戴彩华 周升团
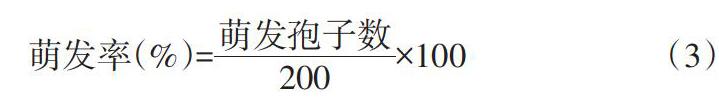

摘 要:采用氣相色谱-质谱联用仪技术测定油樟叶精油3个馏分(A1、A2和A3)的化学成分,并对其进行了抑尖孢镰刀菌活性的测定,筛选出最佳抑菌馏分;通过受试菌分别在受到油樟叶精油馏分A3及其主要单体成分(1,8-桉叶油素和α-松油醇,下同)作用后,测定菌丝的生长、孢子的萌发、电导率、还原性糖及可溶性蛋白质等变化特征,进而探讨其抑菌的机理。结果表明:从油樟叶精油3个馏分(A1、A2和A3)中,共检测出的主要化学成分(相对百分含量>1%)有13种,其中A1、A2、A3馏分中各有6、8、12种;3个馏分中含量较高的成分均是1,8-桉叶油素。不同浓度的馏分A3及其主要单体成分对尖孢镰刀菌均有抑菌作用,其中在150mg/L浓度下的抑菌率分别达到90.46%、84.40%和87.18%。馏分A3及其主要单体成分分别能够使尖孢镰刀菌菌丝的生长、孢子的萌发、电导率、还原性糖、可溶性蛋白质以及ATP酶等发生较为明显的变化,但发生变化的突变点各不相同。它们主要是通过破坏尖孢镰刀菌的细胞膜结构或功能,导致细胞膜通透性的改变,使菌体内外物质失衡,最终致菌体细胞正常形态和代谢功能丧失,从而达到抑菌的目的。
关键词:油樟;精油馏分;气相色谱-质谱联用仪;抑菌机理
中图分类号 TQ651文献标识码 A文章编号 1007-7731(2019)15-0014-06
Research on Major Constituents,Bacteriostatic Effect and Antibacterial Mechanism of Fractions from Cinnamomum longepaniculatum Leaves Essential Oils and its Major Monomer Components
Hu Wenjie1 et al.
(1 School of Life Sciences,Jinggangshan University,Ji′an 343009,China)
Abstract:The chemical constituents of three fractions (A1,A2 and A3) were determined by gas chromatography-mass spectrometry from Cinnamomum longepaniculatum leaves essential oils. And the best antimicrobial fraction was screened through antimicrobial effects of the determination of fractions.Study on inhibition mechanism of fraction A3 and its major monomer components (1,8-Cineole and α-Terpineol,the same below) through the determination of mycelium growth activity,spore germination rate,electric conductivity,reducing sugar,soluble protein and so on.The results showed that 13 main chemical constituents (relative percentage>1%)were detected from the 3 fractions (A1,A2 and A3) of Cinnamomum longepaniculatum leaves essential oils,There are 6,8 and 12 kinds fractions of A1,A2 and A3,respectively.The content of 1,8-Cineole was all higher of them.Different concentrations of A3 and its major monomers had bacteriostatic effects on Fusarium oxysporum,and the bacteriostatic rates reached 90.46%,84.40% and 87.18% at the concentration of 150mg/L,respectively.Fraction A3 of essential oil and its major monomeric components could significantly change the hyphae growth,spore germination,electrical conductivity,reducing sugar,solube protein and ATPase of Fusarium oxysporum,but the mutation points were different,respectively.They mainly destroy the cell membrane structure or function of Fusarium oxysporum,leading to the change of cell membrane permeability,making the imbalance of substances inside and outside the bacteria,and finally causing the loss of normal morphology and metabolic function of bacterial cells,so as to achieve the purpose of inhibiting bacteria.
Key Words:Cinnamomum longepaniculatum;Essential oil fractions;GC-MS;Antibacterial mechanism
植物精油是从植物花、叶、茎、根、果实等部位中提取的一类具有较强挥发性的植物次生代谢产物,其成分一般由小分子、萜烯类、醇类、醛酮类等物质组成,作用机理复杂,较难使病原菌产生抗性,在农林生物防治等领域具有较好的应用前景[1]。植物精油来源于天然,具有对人体相对安全、与环境友好、生物活性多样等特点,因此,从天然植物中寻找广谱、高效、低毒的杀菌剂,已成为科研人员及农药使用人员的共同目标[2]。
油樟[Cinnamomum longepaniculatum(Gamble)N.Chao]系樟科樟属常绿乔木,为中国特有的树种,已被列为国家Ⅱ级重点保护植物[3]。油樟各部位均富含有精油,具有抗菌[4-5]、抗炎[6-7]、镇痛[8]、抗癌[9]等生理活性。目前,有关油樟精油的提取、成分分析及抑菌效果等已有了较为多的研究报道,但对于油樟叶精油馏分的抑菌效果及其主要单体成分抑菌机理研究尚未见报道。为此,笔者以尖孢镰刀菌为供试菌,在比较油樟叶精油不同馏分的抑菌效果的基础上,通过研究最佳抑菌馏分A3及其主要单体成分对尖孢镰刀菌的形态和生理生化的影响,揭示油樟叶精油馏分A3及其主要单体成分的抑菌机理,为油樟源杀菌剂的开发提供理论依据。
1 材料与方法
1.1 主要材料与试剂 供试材料:油樟鲜叶于2018年10月中旬采集于江西吉安。供试菌种:尖孢镰刀菌(Fusarium oxysporum),由郑州精思威化工有限公司提供。供试试剂:吐温-80、丙酮、PBS缓冲液、无水硫酸钠、ATP酶试剂盒等均为分析纯。培养基:马铃薯葡萄糖琼脂培养基(PDA培养基)等。
1.2 主要仪器设备 ShimadzuGCMS-QP2020气相色谱-质谱聯用仪,日本岛津公司生产;全自动高压灭菌,上海博迅实业有限公司生产;H-1650高速离心机,长沙湘仪离心机仪器有限公司生产;DHP-9052电热恒温培养箱,上海一恒科学仪器有限公司生产;SW-CJ-2F超净工作台,苏州安泰空气技术有限公司生产等。
1.3 方法
1.3.1 精油各馏分的提取和制备 采用水蒸气蒸馏法提取油樟鲜叶精油,收集一定量的叶精油,并用无水硫酸钠干燥后置于分馏瓶中,再经减压分馏(-0.073MP),收集3种不同温度的馏分,分别为:60℃以下的馏分,标为A1号精油;60~100℃的馏分,标为A2号精油;100~150℃的馏分,标为A3号精油。
1.3.2 精油各馏分的主要化学成分分析 (1)色谱条件:Rxi-5Sil MS(30m×0.25mm×0.25μm)石英毛细管柱,载气为高纯度氦气(99.999%),流速为1.0mL/min,气化室温度为220℃,柱起始温度50℃(保持2min),以8℃/min的速率程序升温到160℃,以8℃/min升温至250℃(保持15min)至完成分析;分流比为20∶1,进样量为0.5μL。(2)质谱条件:离子源为EI,电子能量为70eV,离子源温度为220.0℃,进样口温度250℃扫描范围m/z60~350。
1.3.3 精油各馏分抑菌活性的测定 分别取油樟叶精油的3种馏分(A1、A2和A2)50μL、100μL、150μL、200μL与25mL PDA混合倒平板,制得油樟叶精油的3个馏分浓度为2μL/mL、4μL/mL、6μL/mL、8μL/mL的PDA培养基,并以纯PDA倒平板作对照。分别将尖孢镰刀菌菌丝块接种到培养皿中央,重复3次,25℃恒温培养5d后观察拍照,计算抑菌率。其中,接种在对照平板上的尖孢镰刀菌菌落平均直径为Do,接种在含馏分平板上的尖孢镰刀菌菌落平均直径为Dx,则抑菌率(%)=(Do-Dx)/Do×100 (1)
1.3.4 精油馏分A3及主要单体成分的抑菌活性与机理
1.3.4.1 供试菌菌丝生长活性的测定 用生长速率测定法[10]分别测定馏分A3及主要单体成分对尖孢镰刀菌菌丝生长的抑制作用。在无菌操作条件下,向每个培养皿中倒入9mL的PDA培养基,再分别加入1mL精油馏分A3及其主要单体成分,对照组加入1mL丙酮,轻轻摇匀,制成平板,待冷却凝固后,每个培养皿中接入一个生长一致的菌饼(d=5.0mm)。重复3次,25~26℃培养7d后,再用十字交叉法测量菌落生长直径,计算菌丝生长抑制率。相关计算公式如下:
菌丝生长抑制率(%)=(对照组菌丝生长直径-处理组菌丝生长直径)/(对照组菌丝生长直径-菌饼直径)×100 (2)
1.3.4.2 供试菌孢子萌发率的测定[11] 取浓度为1×105cfu/mL的尖孢镰刀菌的孢子悬浮液100μL,分别加入已经用吐温-80乳化好的含0μL、25μL、50μL、100μL、150μL馏分A3及其主要单体成分的PDA培养基中,每皿15mL。均匀涂布后立即密封培养皿,以培养基滴入少量吐温-80未加馏分A3及其主要单体成分的平板作为对照。27℃生化培养箱中培养9h后,在显微镜下观察,并根据公式计算孢子萌发率。相关计算公式如下:
萌发率(%)=[萌发孢子数200]×100 (3)
1.3.4.3 供试菌细胞膜渗透性的测定[12] 采用导电率法测定。挑取尖孢镰刀菌菌丝接入50mL PDA液体培养基中摇床震荡(140r/min、25℃)培养2d,过滤菌丝,用0.05mol/L、pH7.2的PBS缓冲液冲洗3次,转移到20mL的PBS缓冲液中,分别加不同浓度的馏分A3及其主要单体成分,放入摇床继续振荡,处理4h取样,离心(4000r/min,10min)除去菌液体,上清液测定电导率。以不加馏分A3及其主要单体成分的菌液为空白对照组(CK)。
1.3.4.4 供试菌菌液中还原性糖含量的测定[13] 取供试尖孢镰刀菌在PDA培养基上培养,在第3天菌丝覆盖整个平板后,用5mm打孔器取菌饼5个接入100mL液体培养基中,设置处理组和对照组,处理组加入60μL同浓度的(150mg/L)馏分A3及其主要单体成分,对照组加入相应灭菌的蒸馏水,将其置于振荡箱中进行培养,每间隔一定时间测定样品中还原性糖的含量。
1.3.4.5 供试菌菌液可溶性蛋白质含量的测定[13] 取供试尖孢镰刀菌在PDA培养基上培养,在第3天菌丝覆盖整个平板后,用5mm打孔器取菌饼5个接入100mL,液体培养基中,设置处理组和对照组,处理组分别60μL相同浓度的(150mg/L)馏分A3及其主要单体成分,对照组加入相应灭菌的蒸馏水,将其置于振荡箱中进行培养,每间隔一定时间进行样品中蛋白质含量测定(25℃,140r/min)。
1.3.4.6 供试菌ATP酶活性的测定 将1mL孢子悬浮液(106CFU/m L)接种于50mL PDA培养基中,分别加入相同浓度的(150mg/L)馏分A3及其主要单体成分,振荡培养42h(28℃、180r/min),以无菌水为空白对照。每间隔2h取样1.5mL,离心10min(4℃、12000r/min),弃沉淀取上清液,收集菌丝体,用快速组织细胞破碎仪破碎细胞,取上清弃沉淀,用超微量ATP酶试剂盒测定总ATP酶活性。
2 结果与分析
2.1 精油各馏分的主要化学成分分析 前期已采用GC-MS联用仪技术对油樟叶精油的3个馏分(A1﹑A2和A3)进行了测定,结果显示,A1 馏分中主要化学成分(相对百分含量>1%)有6种:2-甲基-5-(1-甲基乙基)-双环[3.1.0]-2-己烯﹑α-蒎稀﹑4(10)-侧柏烯﹑β-蒎烯﹑β-月桂烯和1,8-桉叶油素;A2馏分中主要化学成分(相对百分含量>1%)有8种:2-甲基-5-(1-甲基乙基)-双环[3.1.0]-2-己烯﹑α-蒎稀﹑4(10)-侧柏烯﹑β-蒎烯﹑β-月桂烯﹑(+)-4-蒈烯﹑γ-萜品烯和1,8-桉叶油素;A3馏分中主要化学成分(相对百分含量>1%)有13种:α-蒎稀﹑4(10)-侧柏烯﹑β-蒎烯﹑β-月桂烯﹑(+)-4-蒈烯﹑D-柠檬烯﹑γ-萜品烯﹑石竹烯﹑大根香叶烯B﹑1,8-桉叶油素﹑松油烯-4-醇和α-松油醇。3个馏分中含量较高的均是1,8-桉叶油素,其次是4(10)-侧柏烯和α-蒎稀。它们的结构式如图1
(+)-4-Carene][A1,A2,A3][A2,A3][A1,A2,A3]
D-Limonene][γ-萜品烯
γ-Terpinene][石竹烯
Caryophyllene][大根香叶烯 B
8-Cineole][松油烯-4-醇
Terpinen-4-ol ][α-松油醇
α-Terpineol][A1,A2,A3][A3][A3]
2.2 精油各馏分对尖孢镰刀菌的抑菌活性 油樟叶精油各馏分(A1﹑A2和A3)对尖孢镰刀菌均具有一定的抑制效果,并分别随着各馏分浓度的增加,抑制效果更加明显。当浓度为8μL/mL时,对尖孢镰刀菌的抑制效果均最为明显,抑菌率分别达到79.09%、85.51%和89.81%(表1),油樟叶精油馏分A3抑菌率分别为馏分A1和馏分A2的1.14和1.05倍。
2.3 精油馏分A3及其主要单体成分的抑菌活性与机理
2.3.1 对尖孢镰刀菌菌丝生长活性的抑制 由表2可知,油樟叶精油馏分A3、α-松油醇和1,8-桉叶油素分别对尖孢镰刀菌菌丝生长均有一定的抑制作用,其中馏分A3对尖孢镰刀菌的作用更强一些。在浓度相同的情况下(150mg/L),油樟叶精油馏分A3、1,8-桉叶油素及α-松油醇对尖孢镰刀菌的抑制作用从大到小依次为馏分A3>α-松油醇>1,8-桉叶油素;而随着馏分A3、α-松油醇及1,8-桉叶油素浓度的增加,抑制作用均增大。
2.3.2 对尖孢镰刀菌孢子萌发率的影响 根据1.3.4.2实验方法,测得油樟叶精油馏分A3、α-松油醇和1,8-桉叶油素分别在不同体积下尖孢镰刀菌孢子的萌发个数并计算出萌发率,结果见图2。由图2可知,随着馏分A3、α-松油醇和1,8-桉叶油素各自体积的不断增加,其萌发个数在不断降低,萌发率也在不断下降,说明馏分A3、α-松油醇和1,8-桉叶油素对尖孢镰刀菌孢子的萌发均具有一定的抑制效果。在含有A3培養基中的孢子萌发率最低,其次是含α-松油醇,最后是含1,8-桉叶油素的培养基。
2.3.3 对尖孢镰刀菌细胞膜渗透性影响 由图3可知,随着馏分A3、α-松油醇和1,8-桉叶油素抑菌成分的浓度增加,尖孢镰刀菌菌液中电导率均显著上升;未经抑菌成分处理的对照组电导率变化幅度不大。其中馏分A3的电导率值最大为69.03μS/cm,说明馏分A3中的化学成分之间协同抑菌效果明显,离子外流量最大。电导率的变化说明抑菌成分改变了菌体细胞膜的通透性,直接导致了菌体内部物质(如钾离子、钠离子等)的大量流出,影响了供试菌的正常生长,从而达到了抑菌目的。
2.3.4 对尖孢镰刀菌还原性糖含量的影响 由图4可知,从第0h开始,经过对馏分A3、α-松油醇和1,8-桉叶油素与对照组(CK)处理后,尖孢镰刀菌菌悬液中的还原性糖含量均呈现出先减少后上升的趋势,其原因可能是尖孢镰刀菌对数期大量繁殖消耗了还原糖使其减少;随后由于馏分A3及其主要单体成分分别抑制了尖孢镰刀菌的生长繁殖,同时破坏尖孢镰刀菌的菌体细胞膜,使分子质量较大的还原糖得以通过细胞膜渗出等因素,导致还原性糖含量上升。
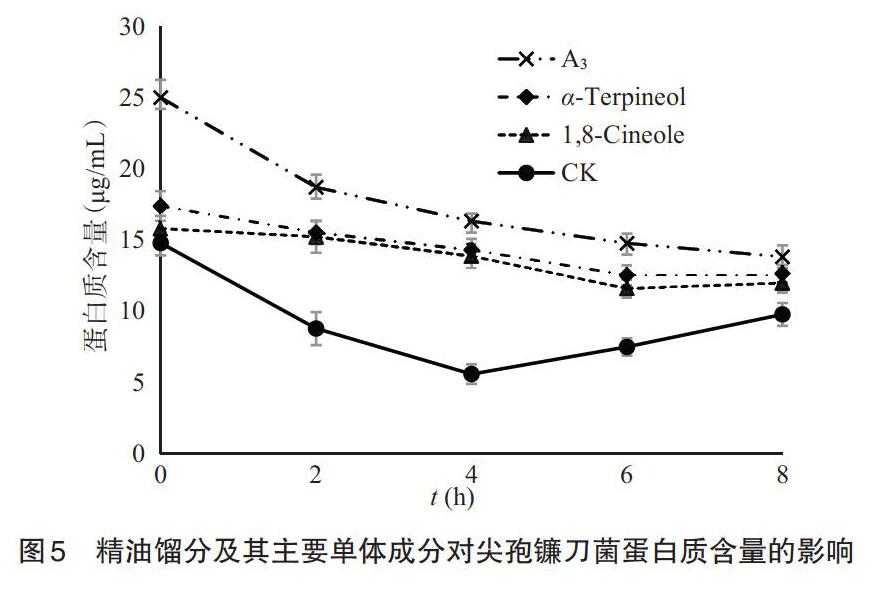
2.3.5 对尖孢镰刀菌蛋白质含量的影响 由图5可知,分别经馏分A3、α-松油醇和1,8-桉叶油素作用后的尖孢镰刀菌菌液中的蛋白质含量较不加抑菌成分作用的菌液稍高,在同一浓度下(150mg/L),馏分A3、α-松油醇和1,8-桉叶油素分别随着时间的增加,菌液中蛋白质含量均呈现减少的趋势,其原因可能如下:一是由于随着时间的延长,抑菌成分的作用效果降低,同时其余的尖孢镰刀菌仍在继续生长,菌液中的蛋白质被正在生长的尖孢镰刀菌消耗;二是由于菌体自身对细胞膜进行了修复,导致蛋白质的渗漏量减少,渗出的蛋白质不足以抵消菌液中蛋白质的消耗量。在150mg/L时,馏分A3、α-松油醇和1,8-桉叶油素分别作用8h,菌液中蛋白质含量分别达到13.82%、12.63%和11.97%。
2.3.6 对尖孢镰刀菌ATP酶活性的影响 由图6可知,在0~2h内,馏分A3、α-松油醇和1,8-桉叶油素与对照组(CK)4种处理均使尖孢镰刀菌内ATP酶活性下降,其原因可能是在初始时ATP酶用于分解ATP释放能量以维持尖孢镰刀菌生长,从而使ATP酶活性下降;在2~4h内,尖孢镰刀菌内ATP酶活性均呈现增大的趋势,其原因可能是该阶段是ATP合成阶段,消耗ATP酶较少;在4h后由于受到馏分A3、α-松油醇和1,8-桉叶油素的作用而使ATP活性降低,可能是因为此时ATP合成量的减少,相应地ATP酶含量也表现为下降的趋势。
3 讨论与结论
油樟叶精油3个馏分中主要含有醇类化合物和烃类化合物,这些化合物被广泛应用于香精香料、制药及食品工业等领域。如1,8-桉叶油素是世界10大精油品种之一,具有抗菌[14-15]、杀虫[16]、疏风解热、祛湿解毒等作用,同时也对多种药物具有良好的透皮渗透作用[17]。α-松油醇可用于香精的配制以及医药、农药、塑料、肥皂等工业中,是玻璃器皿上色彩的优良溶剂[18-19]。α-蒎稀是合成樟脑、松油醇、香料、树脂等化工产品的重要原料之一,具有较好的抗肿瘤、抗真菌、抗过敏及改善溃疡等生物活性及独特的反应多样性[20]。此外,油樟叶精油馏分中还含有一些化学成分,其功效目前尚未明确,有待于进一步研究。
从天然植物精油中分离纯化抑菌活性物质,并将其直接运用到防治,得到一种既有效控制农作物病原真菌病害又不至于对环境及其它生物造成伤害的药剂,这不仅能拓宽丰富的植物精油资源的用途,又能开创农作物病害生物防治的新途径[2]。油樟属于樟科樟属植物,富含有精油。本试验对油樟叶精油馏分A3及其主要单体成分进行抑菌研究,结果显示,馏分A3及主要单体成分均具有一定的抑菌活性,又以馏分A3效果最好,可能是由于馏分A3多种抑菌成分协同抗菌作用的结果,因此,可作为一种有待开发的新型杀菌物质进行研究。
油樟叶精油馏分A3及其主要单体成分能够使尖孢镰刀菌菌丝的生长、孢子的萌发、电导率、还原性糖、蛋白质以及ATP酶的活性发生较明显的变化,但发生明显变化的突变点各不相同。当尖孢镰刀菌遇到抑制生长作用时,细胞膜结构遭到破坏,菌体的保护被打破,其内部小分子物质会外渗入,导致培养液的电导率升高;随着抑菌物质作用时间的延长,中等分子量的还原性糖随菌体细胞结构的破坏游离到菌液中;经一定时间作用后,菌体的细胞结构完全被破坏,致使蛋白质等大分子物质也全部溶于菌液中,同时ATP酶的活性也发生相应的变化,进而达到抑制菌体的作用。
我国油樟叶资源较为丰富,资源浪费现象却十分严重。要解决我国油樟叶资源的综合开发利用的问题,精深加工是关键。本试验对油樟叶精油馏分A3及其单体成分抗菌活性与机理的研究,进一步加深了油樟作为芳香类药材开发利用的广度和深度,对提高油樟产品的附加值,促进当地经济发展具有重要的现实意义。
参考文献
[1]Sellamuthu PS,Sivakumar D,Soundy P,et al.Essential oil vapours suppress the development of anthracnose and enhance defence related and antioxidant enzyme activities in avocado fruit[J].Postharvest Biology and Technology,2013,81:66-72.
[2]宁蕾,邓业成,雷玲,等.5种植物精油对植物病原真菌的抑菌活性[J].农药,2012,51(5):377-389.
[3]四川植物志编委会.四川植物志(第1卷)[M].成都:四川人民出版社,1979.
[4]Li L,Shi CF,Yin ZQ,et al.Antibacterial activity of α-terpineol may induce morphos tructural alterations in Escherichia coli[J].Brazilian Journal of Microbiology,2014,45(4):1409-1413.
[5]王濤,游玲,魏琴,等.油樟内生细菌的多样性及抑制植物病原菌初步研究[J].西北林学院学报,2009,24(2):97-100.
[6]Du YH,Feng RZ,Li Q,et al.Anti-inflammatory activity of leaf essential oil from Cinnamomum longepaniculatum(Gamble)N.Chao[J].International Journal of Clinical and Experimental Medicine,2014,7(12):5612-5620.
[7]丛赢,张琳,祖元刚,等.油樟(Cinnamomum longepaniculatum)精油的抗炎及抗氧化活性初步研究[J].植物研究,2016,36(6):949-954.
[8]曹玫,贾睿琳,江南,等.油樟叶挥发油的镇痛活性研究[J].广西植物,2013,33(4):552-555.
[9]叶奎川,殷中琼,魏琴,等.油樟叶挥发油及其主要成分的体外抗肝癌活性[J].解剖学报,2012,43(3):381-386.
[10]陈年春.农药生物测定技术[M].北京:北京农业大学出版社,1990:66-68.
[11]张梦宇,孙佳文,崔志波,等.三种精油对青霉抑菌效果的研究[J].微生物前沿,2018,7(4):165-171.
[12]刘欢,夏光辉,温春野.复配精油对采后葡萄灰霉菌抑制作用的研究[J].食品工业科技,2014,35(21):115-122.
[13]王学奎,黄见良.植物生理生化实验原理与技术[M].北京:高等教育出版社,2015:171-184.
[14]?im?ek M,Duman R.Investigation of effect of 1,8-cineole on antimicrobial activity of Chlorhexidine Gluconate[J].Pharmacognosy Research,2017,9(3):234-237.
[15]Castro KNC,Canuto KM,Brito ES,et al.In vitro efficacy of essential oils with different concentrations of 1,8-cineole against Rhipicephalus (Boophilus) microplus[J]. Revista Brasileira de Parasitologia Veterinária,2018,27(2):203-210.
[16]Liang JY,Wang WT,Zheng YF,et al.Bioactivities and chemical constituents of essential oil extracted from Artemisia anethoides against two stored product insects[J].2017,66(1):71-76.
[17]Casey AL, Karpanen TJ,Conway BR,et al.Enhanced chlorhexidine skin penetration with 1,8-cineole[J].BMC infectious diseases,2017,17:350-354.
[18]Zhou HE,Tao NG,Jia L.Antifungal activity of citral,octanal and α-terpineol against Geotrichum citri-aurantii[J].Food Control,2014,37:277-283.
[19]Souza RHL,Cardoso MSP,Menezes CT.Gastroprotective activity of α-terpineol in two experimental models of gastric ulcer in rats[J].DARU Journal of Pharmaceutical Sciences,2011,19(4):277-281.
[20]Lo?iene. K,?vediene. J,Pa?kevi?ius A.Influence of plant origin natural α-pinene with different enantiomeric composition on bacteria,yeasts and fungi[J].Fitoterapia,2018,127:20-24.
(責编:张宏民)
