白芍饮片的HPLC指纹图谱建立及聚类分析、主成分分析
2019-09-10林秀敏张振凌王胜超闫梦真陈祎甜张江山
林秀敏 张振凌 王胜超 闫梦真 陈祎甜 张江山









摘 要 目的:建立白芍饮片的高效液相色谱(HPLC)指纹图谱,并进行聚类分析和主成分分析。方法:采用HPLC法。色谱柱为SunFire® C18,流动相为乙腈-0.05%磷酸水溶液(梯度洗脱),流速为1.0 mL/min,检测波长为230 nm,柱温为30 ℃,采集时间为70 min,进样量为15 µL。以芍药苷为参照,建立26批不同产地白芍饮片及30批不同炮制方法白芍饮片的HPLC指纹图谱;采用《中药色谱指纹图谱相似度评价系统》(2012版)进行相似度评价,确定共有峰;采用SPSS 20.0软件进行聚类分析和主成分分析。结果:26批不同产地白芍饮片共有9个共有峰,相似度均大于0.880;共指认了6个峰,分别为没食子酸、儿茶素、芍药内酯苷、芍药苷、1,2,3,4,6-五没食子酰葡萄糖、苯甲酰芍药苷;聚类分析结果显示,当余弦距离为15时26批样品可聚为2类,S1~S21聚为一类,S22~S26聚为一类;经主成分分析,前2个主成分的累积方差贡献率为81.124%。30批不同炮制方法白芍饮片共有10个共有峰,相似度均大于0.970;共指认了7个峰,分别为没食子酸、儿茶素、丹皮酚新苷、芍药内酯苷、芍药苷、1,2,3,4,6-五没食子酰葡萄糖、苯甲酰芍藥苷;聚类分析结果显示,当余弦距离为25时,30批样品可聚为2类,B1~B10聚为一类,C1~C10、J1~J10聚为一类;经主成分分析,前4个主成分的累积方差贡献率为86.887%。结论:所建HPLC指纹图谱及聚类分析和主成分分析结果可为不同白芍饮片的质量控制提供参考。
ABSTRACT OBJECTIVE: To establish HPLC fingerprints of Paeonia tactilora decoction pieces, and to conduct its cluster analysis and principal component analysis. METHODS: HPLC method was adopted. The determination was performed on SunFire® C18 column with mobile phase consisted of acetonitril-0.05% phosphoric acid solution (gradient elution) at the flow rate of 1.0 mL/min. The detection wavelength was set at 230 nm, the column temperature was 30 ℃, the collection time was 70 min,and sample size was 15 µL. Using paeoniflorin as reference, HPLC fingerprints of 26 batches P. tactilora decoction pieces from different habitats and 30 batches by different processed methods were established. The similarity of samples was evaluated by TCM Chromatographic Fingerprint Similarity Evaluation System (2012 edition) to confirm common peak. Cluster analysis and principal component analysis were performed by using SPSS 20.0 software. RESULTS: There were 9 common peaks in HPLC fingerprints of 26 batches of sample from different habitats, the similarity of which was higher than 0.880. Six peaks were identified, including gallic acid, catechin, albiflorin, paeoniflorin, 1,2,3,4,6-pentagalloylglucose and benzoylpaeoniflorin. Cluster analysis showed that 26 batches of samples were clustered into 2 categories when cosine distance was 15. S1-S21 were clustered into one category; S22-S26 were clustered into the other category. By principal component analysis, the accumulative contribution rate of two main components was 81.124%. There were 10 common peaks in HPLC fingerprints of 30 batches of sample by different processed methods, the simi- larity of which was higher than 0.970. Seven peaks were identified, including gallic acid, catechin, aplopaeonoside, albiflorin, paeoniflorin, 1,2,3,4,6-pentagalloylglucose and benzoylpaeoniflorin. Cluster analysis showed that 30 batches of samples were clustered into 2 categories when cosine distance was 25. B1-B10 were clustered into one category; C1-C10 and J1-J10 were clustered into the other category. By principal component analysis, the accumulative contribution rate of four main components was 86.887%. CONCLUSIONS: Established HPLC fingerprint, the results of cluster analysis and principal component analysis can provide reference for quality control of decoction pieces of P. tactilora.
KEYWORDS Paeonia tactilora decoction pieces; HPLC; Fingerprint; Cluster analysis; Principal component analysis
白芍为毛茛科植物芍药(Paeonia lactiflora Pall.)的干燥根,其性微寒,味苦、酸,归肝、脾经,具有养血调经、敛阴止汗、柔肝止痛、平抑肝阳之功效,可用于治疗血虚萎黄、月经不调、自汗、盗汗、胁痛、腹痛、四肢挛痛、头痛眩晕等症[1]。现代研究表明,白芍的主要药理作用为保肝、镇痛、抗炎、调节免疫等[2-5]。2015年版《中国药典》(一部)以芍药苷作为白芍的控制指标,而赤芍的指标性控制成分也是芍药苷,因此以芍药苷作为白芍的质量指标,具有一定的局限性[1]。白芍中含有单萜及其苷类、三萜类、黄酮类、鞣质类和多糖类等多种化学成分[6-9],因此测定其中某个或几个成分的含量,并不能全面反映白芍的质量。指纹图谱以表征中药内在质量的整体变化为目的,符合中药质量控制整体性表征的分析特点[10-12],同时借助化学计量法进行质量评价,能更全面地体现中药的内在品质[13-14]。为此,本研究建立了26批不同产地白芍饮片及30批不同炮制方法白芍饮片的高效液相色谱(HPLC)指纹图谱,并结合相似度分析、聚类分析、主成分分析对其进行综合评价,旨在为其质量控制提供参考。
1 材料
1.1 仪器
UltiMate 3000型HPLC仪,包括U3000型二极管阵列检测器、version 7 Chromatogram 化学工作站(美国Thermo Fisher公司);600型HPLC仪,包括2487型紫外检测器、version 2 Empower化学工作站(美国Waters公司);KQ-500 SV型超声波清洗器(昆山市超声仪器有限公司);BT25S型十万分之一天平、BSA224S-CW型万分之一天平[赛多利斯科学仪器(北京)有限公司]。
1.2 药品与试剂
芍药苷对照品(批号:MUST-16041901,纯度:≥98.5%)、芍药内酯苷对照品(批号:MUST-16051601,纯度:≥98.5%)、1,2,3,4,6-五没食子酰葡萄糖对照品(批号:MUST-16061211,纯度:≥98.5%)、儿茶素对照品(批号:MUST-16030812,纯度:≥98%)均由成都曼斯特生物科技有限公司提供;没食子酸对照品(批号:PS-0258-0050,纯度:98.5%)、苯甲酰芍药苷对照品(批号:PS-13011802,纯度:98.5%)、丹皮酚新苷对照品(批号:PS-08080102,纯度:≥98%)均由成都普斯生物科技有限公司提供;乙腈、甲醇均为色谱纯,磷酸为分析纯,水为超纯水。
1.3 药材
白芍药材(编号:S1~S26)经河南中医药大学药学院张振凌教授鉴定为毛茛科植物芍药(Paeonia Lactiflora Pall.)的干燥根,并按2015年版《中国药典》(四部)[15]“炮制”通则制成饮片;白芍饮片(编号:B1~B10,中试生产)、炒白芍饮片(编号:C1~C10)、酒白芍飲片(编号:J1~J10)均由安徽亳州市沪谯药业有限公司提供(中试生产是指按国家中药标准化项目要求,将实验室工艺在合作企业进行工艺放大生产,以满足企业生产的要求)。样品信息详见表1。
2 方法与结果
2.1 色谱条件
色谱柱:SunFire® C18(250 mm× 4.6 mm,5 µm);流动相:乙腈(A)-0.05%磷酸水溶液(B),梯度洗脱(0~10 min,8%A→18%A;10~25 min,18%A→20%A;25~30 min,20%A;30~40 min,20%A→25%A;40~55 min,25%A →40%A;55~60 min,40%A→45%A;60~70 min,45%A→8%A);采集时间:70 min;进样量:15 µL;流速:1.0 mL/min;柱温:30 ℃;检测波长:230 nm。
2.2 溶液的制备
2.2.1 混合对照品溶液 精密称取没食子酸对照品14.08 mg、儿茶素对照品10.90 mg、芍药内酯苷对照品6.76 mg、芍药苷对照品11.52 mg、丹皮酚新苷对照品10.51 mg、1,2,3,4,6-五没食子酰葡萄糖对照品10.33 mg、苯甲酰芍药苷对照品10.99 mg,分别置于10 mL量瓶中,加甲醇溶解并定容,得各单一对照品溶液。分别精密量取各单一对照品溶液1 mL,置于同一25 mL量瓶中,加甲醇至刻度,即得混合对照品溶液。
2.2.2 供试品溶液 精密称取白芍中粉(中粉指能全部通过四号筛,但混有不超过60%能通过五号筛的粉末)0.1 g,置于50 mL量瓶中,加50%乙醇35 mL,超声(功率:500 W,频率:50 Hz)处理30 min,放冷,加50%乙醇至刻度,摇匀,经0.22 µm微孔滤膜滤过,取续滤液,即得。
2.3 方法学考察
2.3.1 精密度试验 取“2.2.2”项下供试品溶液(编号:S10)适量,按“2.1”项下色谱条件连续进样测定6次,以芍药苷峰的保留时间和峰面积为参照,记录各共有峰的相对保留时间和相对峰面积。结果,9个共有峰相对保留时间的RSD均小于0.19%(n=6),相对峰面积的RSD均小于2.34%(n= 6),表明本方法精密度良好。
2.3.2 稳定性试验 取“2.2.2”项下供试品溶液(编号:S10)适量,分别于室温下放置0、2、4、8、12、24 h时按“2.1”项下色谱条件进样测定,以芍药苷峰的保留时间和峰面积为参照,记录各共有峰的相对保留时间和相对峰面积。结果,9个共有峰相对保留时间的RSD均小于0.21%(n=6),相对峰面积的RSD均小于2.61%(n=6),表明供试品溶液于室温下放置24 h内稳定性良好。
2.3.3 重复性试验 精密称取样品(编号:S10)0.1 g,共6份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,以芍药苷峰的保留时间和峰面积为参照,记录各共有峰的相对保留时间和相对峰面积。结果,9个共有峰相对保留时间的RSD均小于0.34%(n=6),相对峰面积的RSD均小于2.75%(n= 6),表明本方法重复性良好。
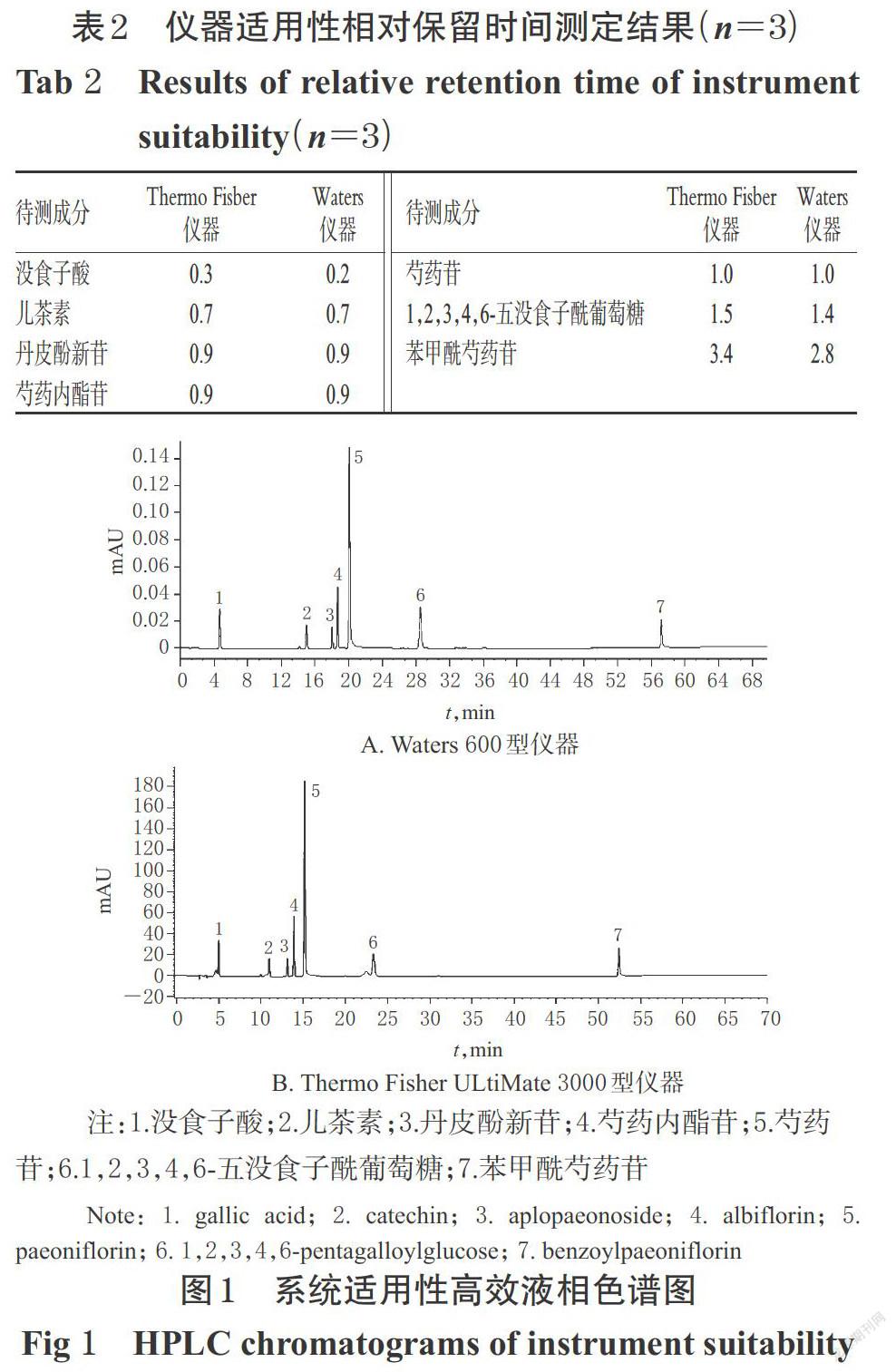
2.3.4 仪器适用性试验 取“2.2.1”项下混合对照品溶液5 μL,按“2.1”项下色谱条件进样测定,以芍药苷为参照,计算没食子酸、儿茶素、丹皮酚新苷、芍药内酯苷、芍药苷、1,2,3,4,6-五没食子酰葡萄糖和苯甲酰芍药苷的相对保留时间。通过配对t检验,考察不同仪器对色谱条件的适用性。结果,t=1.38,双侧P=0.22>0.05,表明相同色谱条件下,以芍药苷为参照,两种仪器所测色谱峰可定位其他成分的相对保留时间,且无显著性差异,不同仪器不影响目标峰的出峰顺序,相对定位准确,详见表2、图1。
2.4 不同产地白芍饮片HPLC指纹图谱的生成与相似度、共有峰分析
2.4.1 HPLC指纹图谱的生成 取26批不同产地白芍饮片(编号:S1~S26)各0.1 g,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,采用《中药色谱指纹图谱相似度评价系统》(2012版)进行分析,得HPLC指纹图谱,详见图2、图3。
2.4.2 相似度评价 采用《中药色谱指纹图谱相似度评价系统》(2012版),以样品的HPLC对照指纹图谱为对照,进行整体相似度评价。结果,26批不同产地白芍饮片(编号:S1~S26)的相似度为0.887~0.998,提示不同产地白芍存在微小的质量差异,详见表3。
2.4.3 共有峰的指认及相关分析 26批不同产地白芍饮片(编号:S1~S26)共有9个共有峰,通过与对照品图谱比对,共指认了6个色谱峰,分别为没食子酸(峰2)、儿茶素(峰3)、芍药内酯苷(峰4)、芍药苷(峰5)、1,2,3,4,6-五没食子酰葡萄糖(峰7)、苯甲酰芍药苷(峰9)。因芍药苷的峰面积较大、分离度较好,故以其为参照峰,计算其他成分的相對保留时间和相对峰面积,详见表4、表5。
2.4.4 不同产地白芍饮片镜像对比 随机选取3批不同产地白芍饮片(编号:S9、S16、S22)的图谱进行镜像对比,详见图4。由图4可知,在同一检测条件下,亳白芍(S9)检测出1个色谱峰,经与对照品比对判定为丹皮酚新苷,而杭白芍(S22)、川白芍(S16)未检测出该成分。
2.4.5 聚类分析 以各共有峰的峰面积除以称样量的数值作为原始数据,采用SPSS 20.0 软件,以组间连接法结合余弦距离对26批不同产地白芍饮片(编号:S1~S26)进行聚类分析,详见图5。由图5可知,当余弦距离为15时,样品可聚为2类,S1~S21聚为一类,S22~S26聚为一类;当余弦距离小于5时,样品可聚为5类,S1~S15聚为一类,S16~S21聚为一类,S22、S23聚为一类,S24、S26聚为一类,S25聚为一类。
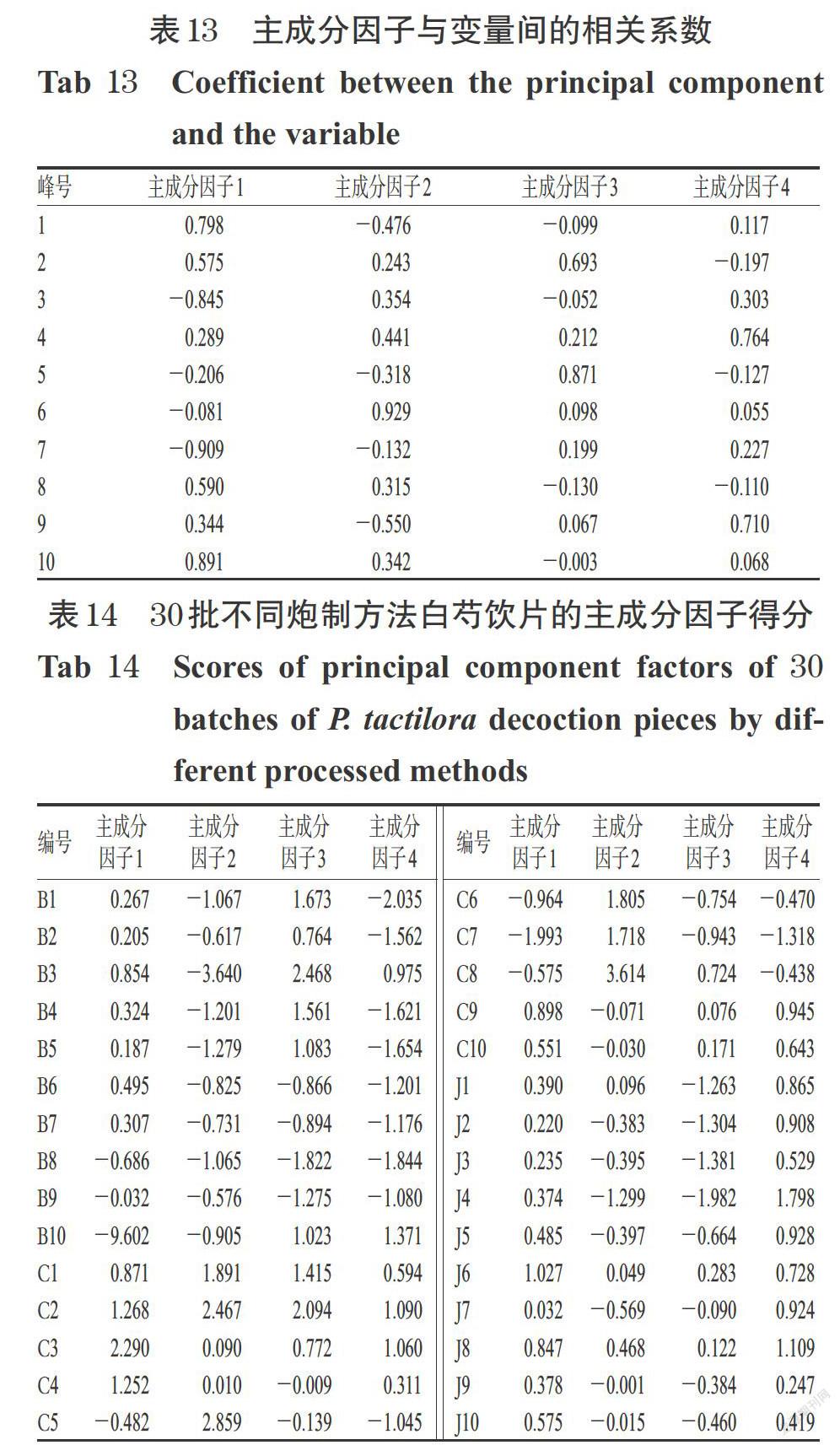
2.4.6 主成分分析 对26批不同产地白芍饮片的9个共有峰的绝对峰面积进行标准化处理后,采用SPSS 20.0 软件进行主成分分析。结果显示,共得到2个主成分因子,特征值分别为6.002、1.299,方差贡献率分别为66.686%、14.438%,累积方差贡献率为81.124%,提示主成分因子1、2可作为不同产地白芍饮片的评价指标。故以主成分因子1、2为指标对26批不同产地白芍饮片(S1~S26)进行评价。结果显示,主成分因子1与9个共有峰相关性均较强,特别是峰1、峰7和峰8;主成分因子2对峰5、峰6的影响较大;主成分因子1得分对S16~S26影响较大,主成分因子2对S1~S15 影响较大,以峰面积为指标进行归一化,结果显示亳白芍、川白芍、杭白芍之间存在差异,详见表6~表8。
2.5 不同炮制方法白芍饮片HPLC指纹图谱的生成与相似度、共有峰分析
2.5.1 不同炮制方法白芍饮片HPLC指纹图谱的生成 按“2.2.2”项下方法分别制备白芍(编号:B1~B10)、炒白芍(编号:C1~C10)、酒白芍(编号:J1~J10)供试品溶液,按“2.1”项下色谱条件进样测定,采用《中药色谱指纹图谱相似度评价系统》(2012版)进行分析,得到HPLC指纹图谱,详见图6、图7。
2.5.2 相似度评价 采用《中药色谱指纹图谱相似度评系统》(2012版),以样品的HPLC对照指纹图谱为对照,进行整体相似度评价。结果,30批不同炮制方法白芍饮片与对照指纹图谱之间差别不明显,相似度均大于0.970,表明不同炮制方法白芍饮片间差异不大,详见表9。
2.5.3 共有峰的指认及相关分析 30批不同炮制方法白芍饮片共有10个共有峰,通过与对照品比对,共指认了7个色谱峰,分别为没食子酸(峰1)、儿茶素(峰2)、丹皮酚新苷(峰3)、芍药内酯苷(峰4)、芍药苷(峰5)、1,2,3,4,6-五没食子酰葡萄糖(峰8)、苯甲酰芍药苷(峰10)。因芍药苷的峰面稳定、分离度良好,故以其为参照峰,计算其他成分的相对保留时间和相对峰面积,详见表10、表11。
2.5.4 不同白芍炮制饮片镜像对比 取白芍饮片(编号:B1)、炒白芍饮片(编号:C1)、酒白芍饮片(编号:J1)的图谱进行镜像对比,详见图8。由图8可知,在同一检测条件下,酒白芍检测到1个未知峰,白芍、炒白芍均未检出该成分。
2.5.5 聚类分析 按“2.4.5”项下方法对30批不同白芍炮制饮片(编号:B1~B10、C1~C10、J1~J10)进行聚类分析,详见图9。由图9可知,当余弦距离为25时,样品可聚为2类,B1~B10聚为一类,C1~C10、J1~J10聚为一类;当余弦距离为20时,可聚为4类,B1~B10聚为一类,C5~C8聚为一类,C1~C4、C9、C10聚为一类,J1~J10聚为一类。
2.5.6 主成分分析 对30批不同炮制方法白芍饮片的10个共有峰的绝对峰面积进行标准化处理后,采用SPSS 20.0 软件进行主成分分析。结果显示,共得到4个主成分因子,特征值分别为3.899、2.105、1.365、1.319,方差贡献率分别为38.988%、21.052%、13.654%、13.193%,累积方差贡献率为86.887%,提示主成分因子1、2、3、4可作为不同炮制方法白芍饮片的评价指标。故以主成分因子1、2、3、4为指标对30批不同炮制方法白芍饮片(B1~B10、C1~C10、J1~J10)进行评价。结果显示,主成分因子1对峰1和峰10影响较大,主成分因子2对峰6影响较大,主成分因子3对峰5影响较大,主成分因子4对峰4和峰9影响较大;主成分因子1和主成分因子4得分在样品J1~J10中较高,表明其对酒白芍影响较显著;主成分因子2得分对样品C1~C10影响较大,表明其对炒白芍影响较明显;主成分因子3得分对样品B1~B10影响较大,表明其对白芍饮片影响突出。以10个共有峰的峰面积进行归一化,结果显示不同炮制方法白芍饮片存在质量差异,详见表12~表14。
3 讨论
本研究前期对液相条件进行了优化,发现以乙腈-0.05%磷酸水溶液为流动相进行梯度洗脱时,各成分的分离效果较好,保留时间适当,峰形良好。同时,采用二极管阵列检测器在190~400 nm波长内进行扫描,得三维光谱图。结果显示,检测波长为214 nm时,1,2,3,4,6-五没食子酰葡萄糖、没食子酸峰有最大吸收,但峰形较差,基线波动较大,对样品峰面积的积分影响大;当检测波长为230 nm时,芍药苷峰有最大吸收,且色谱峰形较好,出峰数目较多,各色谱峰之间分离度较好,基线平稳,故选择230 nm为检测波长。
26批不同产地白芍饮片的整体相似度较高,共有化学成分没食子酸、芍药苷、1,2,3,4,6-五没食子酰葡萄糖、苯甲酰芍药苷等较稳定,提示不同产地间白芍饮片的化学成分接近;但亳白芍比杭白芍、川白芍多了1个丹皮酚新苷峰,后续将扩大样本量进一步研究。26批不同产地白芍饮片共有9个共有峰,其相对保留时间的RSD为0~0.97%,相对峰面积的RSD为0~74.45%,表明不同产地白芍饮片中虽然化学成分相似,但含量存在差异。聚类分析和主成分分析结果显示,当余弦距离为15时,26批不同产地白芍饮片可聚为2类,S1~S21聚为一类,S22~226聚为一类,提示不同产地白芍饮片的成分含量存在差异,可能与生长环境不同有关[16]。
30批不同炮制方法白芍飲片的整体相似度较高,但酒白芍检测出1个未知峰,炒白芍和白芍饮片未检出。30批不同炮制方法白芍饮片共有10个共有峰,其相对保留时间的RSD为0~0.59%,相对峰面积的RSD为0~92.89%,表明白芍经不同方法炮制后,其化学成分含量变化较大[17-18]。聚类分析和主成分分析结果显示,当余弦距离为25时,30批不同炮制方法白芍饮片可聚为2类,B1~B10聚为一类,C1~C10、J1~J10聚为一类,提示白芍炮制饮片具有明显的分类趋势,间接证明其经炮制后内部化学成分可能发生变化,体现出不同炮制饮片的差异性[17]。
综上所述,本研究建立的HPLC指纹图谱及聚类分析和主成分分析结果可为不同白芍饮片的质量控制提供参考。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:105.
[ 2 ] 章丽,赵冰洁,袁嘉瑞,等.牡丹皮、赤芍与白芍对急性血瘀模型大鼠活血功效的比较研究[J].中草药,2016,47(15):2676-2683.
[ 3 ] 牟翔宇,郭英慧,孙文君,等.柴胡配伍白芍治疗PMDD肝气郁证的研究进展[J].中国实验方剂学杂志,2018,24(20):192-199.
[ 4 ] 左志燕,詹淑玉,黄嬛,等.白芍总苷保肝作用的药动学和药效学研究进展[J].中国中药杂志,2017,42(20):3860- 3865.
[ 5 ] 王成龙.基于白芍养血柔肝功效的芍药苷、芍药内酯苷药理作用研究[D].北京:北京中医药大学,2017.
[ 6 ] 笪婧雯.白芍的化学成分研究[J].海峡药学,2017,29(12):45-46.
[ 7 ] 金林,赵万顺,郭巧生,等.白芍饮片的化学成分测定及质量评价[J].中国中药杂志,2015,40(3):484-489.
[ 8 ] 范玛莉,邢婕,李震宇,等.基于NMR代谢组学技术的白芍与赤芍化学成分比较研究[J].中草药,2014,45(22):3230-3237.
[ 9 ] 周海玲,许舜军,周若龙,等.白芍、赤芍化学成分的高效液相色谱-飞行时间串联质谱分析[J].中药材,2018,41(7):1637-1640.
[10] 刘东方,赵丽娜,李银峰,等.中药指纹图谱技术的研究进展及应用[J].中草药,2016,47(22):4085-4094.
[11] 邹纯才,鄢海燕.我国中药色谱指纹图谱相似度评价方法30年(1988-2017年)研究进展与展望[J].中国中药杂志,2018,43(10):1969-1977.
[12] 张小艺,刘久石,高石曼,等.中药谱效关系的研究方法及应用进展[J/OL]. [2019-08-27]. https://doi.org/10.19540/-
j.cnki.cjcmm.20190429.201.
[13] 黄华花,王明军,黄鸣清,等.金橘药材的UPLC指纹图谱建立、聚类分析及主成分分析[J].中国药房,2019,30(12):1661-1665.
[14] 林林,于凤蕊,徐丽华,等.女金丸HPLC指纹图谱建立及聚类分析和主成分分析[J].中国药房,2019,30(10):1339- 1343.
[15] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:31.
[16] 童黄锦,白发平,汪小莉,等.不同产地白芍药材的指纹图谱研究[J].中医学报,2014,29(9):1326-1329.
[17] 万超,苏慧,霍雨佳,等.白芍饮片炒制前后物质基础的变化规律分析[J].中国实验方剂学杂志,2018,24(22):28- 33.
[18] 任娟,刘晓,李伟东,等.基于UHPLC-Q-TOF-MS/MS的白芍炒制前后化学成分研究[J].世界中医药,2019,14(2):268-273.
(收稿日期:2019-06-22 修回日期:2019-10-29)
(编辑:陈 宏)
