盐酸丁卡因醇质体的制备工艺优化
2019-09-10张楠张丹参景永帅苏晓梅张健美
张楠 张丹参 景永帅 苏晓梅 张健美




摘 要 目的:建立盐酸丁卡因(TCH)醇质体的含量测定方法,并对其制备工艺进行优化。方法:采用高效液相色谱法测定TCH的含量;采用注入-超声法制备TCH醇质体。以TCH对照品加入量、蛋黄卵磷脂质量浓度、乙醇体积分数为因素,以包封率为指标,在单因素试验基础上采用星点设计-响应面法对工艺进行优化,并对所制醇质体进行表征以及初步稳定性考察。结果:TCH的质量浓度线性范围为10~100 μg/mL(r=0.999 5);定量限为0.045 μg/mL,检测限为0.021 μg/mL;精密度、稳定性、重复性试验的RSD均小于2%;加样回收率为97.80%~103.20%(RSD=0.36%,n=9)。最优制备工艺为TCH对照品加入量1 mg,蛋黄卵磷脂质量浓度7 mg/mL,乙醇体积分数33%;在此工艺条件下,平均包封率为64.50%(n=3),与预测值(64.92%)的相对误差为0.64%。TCH醇质体为微有蓝色乳光的澄清液体,其外观为球形,形态圆整、光滑,大小均一,平均粒径为(80.33±2.24)nm,平均电位为(-22.6±1.33)mV。初步稳定性试验结果显示,TCH醇质体在4 ℃避光且密封的环境中放置10 d稳定性良好。结论:优化所得TCH醇质体的制备工艺稳定、可行;所建含量测定方法操作简便、快捷。
关键词 盐酸丁卡因;醇质体;高效液相色谱法;注入-超声法;星点设计-响应面法;包封率;工艺优化
ABSTRACT OBJECTIVE: To establish a method for determining the content of tetracaine hydrochloride (TCH) ethosomes, and to optimize the preparation technology. METHODS: The content of TCH was determined by HPLC. TCH ethosomes were prepared with injection-ultrasonic method. Using drug-loading amount, egg lecithin concentration and ethanol volume fraction as factor, encapsulation efficiency as index, central composite design-response surface methodology was used to optimize the prescription based on the single factor test. The prepared ethosomes were characterized and the stability was evaluated. RESULTS: The linear range of TCH was 10-100 μg/mL (r=0.999 5); the limit of quantification was 0.045 μg/mL, and detection limit was 0.021 μg/mL. RSD of precision, stability and repeatability tests were less than 2%. The recoveries ranged 97.80%-103.20% (RSD=0.36%, n=9). The optimal preparation technology included that the adding amount of TCH control was 1 mg; the concentration of egg lecithin was 7 mg/mL, and ethanol volume fraction was 33%. Under this technology, the average encapsulation efficiency was 64.50% (n=3), the relative error of which from the predicted value (64.92%) was 0.64%. TCH ethosome was a clear blue liquid with a blue opalescence. Its appearance was spherical, its shape was round, smooth, uniform in size; the average particle size was (80.33±2.24) nm, and the average Zeta potential was (-22.6±1.33) mV. TCH ethosome was stable during 10 days under 4 ℃, sealed and protected from light. CONCLUSIONS: The optimal preparation process is stable and feasible. Established method is simple and rapid.
KEYWORDS Tetracaine hydrochloride; Ethosomes; HPLC; Injection-ultrasonic method; Central composite design-response surface methodology; Encapsulation efficiency; Technology optimization
鹽酸丁卡因(TCH)是一种应用广泛的长效局部麻醉药,具有脂溶性强、麻醉效能高的特点[1-3]。有研究表明,TCH比利多卡因更具有亲脂性,该药可聚集在表皮的角质层中并慢慢扩散,能够有效延长麻醉的持续时间[4]。但目前上市的TCH凝胶剂和贴剂均存在毒性大、起效慢(使用后30~40 min起效)的缺点[5]。透皮给药系统具有能避免肝脏首过效应、控制药物输送、减少给药频率、改善患者依从性等优点[6]。理想的透皮用局部麻醉药应是能穿透皮肤表皮而产生有效的局部麻醉作用的药物[7-8]。皮肤是人体最大的器官,可作为局部或全身药物的传递途径,但表皮的角质层可阻碍亲水性和高分子量药物的渗透[9]。
醇质体是含有较高浓度乙醇的新型脂质囊泡载体,可将具有不同物理化学性质的药物由皮肤表层有效传递到皮肤深层。有研究发现,乙醇能够有效促进透皮制剂及美容剂的透皮吸收[10]。由于醇质体粒径较小且具有负电位和较高的包封率,因此其用于透皮给药系统可大大缩短起效时间,优于传统的脂质体[11-13]。基于此,本研究以TCH为主药,采用注入-超声法制备了TCH醇质体,并采用高效液相色谱法(HPLC)对其含量进行测定,旨在为TCH新剂型的研究提供思路,也为TCH用于透皮给药系统提供理论基础。
1 材料
1.1 仪器
e2695型HPLC仪,包括自动进样器、在线脱气系统、二极管阵列检测器(美国Waters公司);UV-2100型紫外可见分光光度计(北京莱伯泰科仪器有限公司);H-7650型透射电镜(日本日立公司);4-1S型高速离心机(美国Sigma公司);DF-101S型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);BT100-2J型蠕动泵(德国Ianger公司);ZEN3690型马尔文粒度仪(英国马尔文仪器有限公司);KQ5200DV型超声波清洗仪(昆山市超声仪器有限公司);ME235P型万分之一电子天平(德国Sartorius公司)。
1.2 药品与试剂
TCH对照品(美国Sigma公司,批号:T7508,纯度:≥99%);蛋黃卵磷脂(日本精化株式会社,批号:PC-98T);胆固醇(上海艾韦特医药科技有限公司,批号:B41239);葡聚糖G-50凝胶(北京索莱宝科技有限公司,批号:S8150);乙腈为色谱纯,无水乙醇、甲醇均为分析纯,水为纯化水。
2 方法与结果
2.1 TCH醇质体制备方法的筛选
2.1.1 注入-超声法 精密称取一定量的蛋黄卵磷脂、胆固醇、TCH对照品,溶于无水乙醇3 mL中,密封,即得有机相,将其置于磁力搅拌器上,保持30 ℃条件下以1 000 r/min转速搅拌;另精密量取水7 mL,以200 μL/min的速度加入有机相中,加入完成后搅拌30 min,再超声(功率:200 W,频率:40 kHz,下同)处理5 min,即得TCH醇质体[14],并按公式计算包封率[包封率(%)=洗脱液中TCH的质量/TCH总质量×100%[15],下同]。结果,包封率为47.32%。
2.1.2 薄膜分散法 精密称取一定量的蛋黄卵磷脂、胆固醇、TCH对照品,置于梨形瓶中,加入氯仿-甲醇溶液(2 ∶ 1,V/V)10 mL,待完全溶解后快速旋转蒸发至瓶壁上出现干脂质薄膜,然后加入30%乙醇水溶液10 mL,再超声处理5 min,即得TCH醇质体[16-17],并按公式计算包封率。结果,包封率为36.83%。
2.1.3 逆向蒸发法 精密称取一定量的蛋黄卵磷脂、胆固醇,溶于无水乙醚10 mL中作为油相;另取TCH对照品,溶于 30%乙醇水溶液10 mL中作为水相;于室温下将水相加入油相中,摇匀,探头超声,形成油包水型乳剂,快速转移至梨形瓶中,蒸发至凝胶状;涡旋使凝胶部分塌陷,减压蒸发残留乙醚,得醇质体混悬液,超声处理5 min,即得TCH醇质体[18],并按公式计算包封率。结果,包封率为19.35%。
综上可知,注入-超声法制得的TCH醇质体包封率最高,故选择注入-超声法制备TCH醇质体。
2.2 含量测定
2.2.1 色谱条件 色谱柱:Thermo-BDS(250 mm×4.6 mm,5 μm);流动相:乙腈-0.05 mol/L磷酸二氢铵溶液(40 ∶ 60,V/V);流速:1 mL/min;检测波长:310 nm;柱温:25 ℃;进样量:10 μL[19-20]。
2.2.2 对照品溶液的制备 精密称取TCH对照品1 mg,置于10 mL量瓶中,加甲醇稀释至刻度,超声处理2 min,即得质量浓度为100 μg/mL的对照品溶液。
2.2.3 空白对照溶液的制备 分别取蛋黄卵磷脂70 mg、胆固醇2 mg,溶于无水乙醇3 mL中,按“2.1.1”项下方法制备空白醇质体;精密量取该空白醇质体1 mL,加甲醇破乳并定容至10 mL,超声处理2 min,即得空白对照溶液。
2.2.4 供试品溶液的制备 精密量取“2.1.1”项下制备的TCH醇质体1 mL,加甲醇破乳并定容至10 mL,超声处理2 min,使其破乳完全,即得供试品溶液。
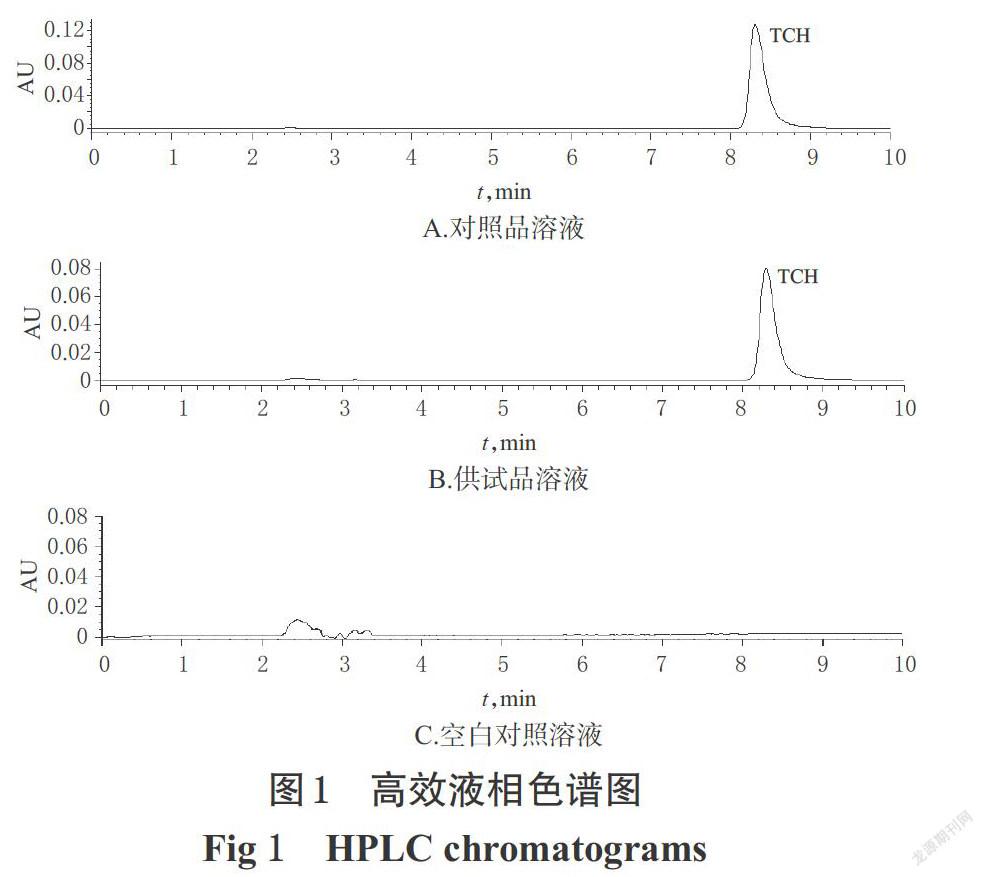
2.2.5 系统适用性试验 取上述对照品溶液、空白对照溶液、供试品溶液适量,按“2.2.1”项下色谱条件进样测定,记录色谱,详见图1。由图1可知,分离度均大于1.5,理论板数均不低于8 000,空白对照溶液对测定无干扰。
2.2.6 线性关系考察 精密称取TCH对照品,溶于水中,制成质量浓度为1 mg/mL的TCH贮备液;精密量取该贮备液适量,用甲醇分别制成质量浓度为10、20、40、60、70、80、100 μg/mL的线性关系溶液。取各线性关系溶液按“2.2.1”项下色谱条件进样测定,记录峰面积。以TCH质量浓度(μg/mL,x)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程为y=50 120x-75 639(r=0.999 5)。结果表明,TCH质量浓度在10~100 μg/mL范围内线性关系良好。
2.2.7 定量限与检测限考察 取“2.2.6”项下TCH贮备液,用甲醇逐级稀释,按“2.2.1”项下色谱条件进样测定,分别以信噪比10 ∶ 1、3 ∶ 1计算定量限、检测限。结果,TCH的定量限为0.045 μg/mL,检测限为0.021 μg/mL。
2.2.8 精密度试验 取“2.2.6”项下质量浓度为10、40、80 μg/mL的线性关系溶液,按“2.2.1”项下色谱条件分别于同日内重复进样测定6次,记录峰面积。结果,日内精密度峰面积的RSD分别为1.81%、0.13%、1.52%(n=6)。取上述线性关系溶液避光保存,于第2、3天分别按“2.2.1”项下色谱条件进样测定,记录峰面积。结果,日间精密度峰面积的RSD分别为1.06%、0.07%、1.19%(n=6),表明仪器精密度良好。
2.2.9 稳定性试验 取“2.2.4”项下供试品溶液,分别于室温下放置0、2、4、6、8、10、12 h时按“2.2.1”项下色谱条件进样测定,记录峰面积。结果,峰面积的RSD为1.07%(n=7),表明供试品溶液于室温下放置12 h内稳定性良好。
2.2.10 重复性试验 取“2.1.1”项下制备的TCH醇質体适量,共6份,按“2.2.4”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量。结果,含量的RSD为1.12%(n=6),表明该方法重复性良好。
2.2.11 加样回收率试验 精密量取“2.2.3”项下空白醇质体2 mL,共9份,分别置于10 mL量瓶中;另精密量取“2.2.6”项下TCH贮备液,用水分别制成高、中、低质量浓度(500、300、100 μg/mL)的TCH对照品溶液,分别加入上述量瓶中,用甲醇定容,超声处理2 min,按“2.2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表1。
2.1.12 样品含量测定 取“2.1.1”项下制备的TCH醇质体适量,按“2.2.4”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录峰面积并按标准曲线法计算样品含量,平行操作3次。结果,含量为39.62%~40.41%(n=3)。
2.3 洗脱曲线的考察
2.3.1 TCH对照品溶液的洗脱曲线 从葡聚糖G-50凝胶微柱顶端中心缓慢加入“2.2.2”项下TCH对照品溶液200 μL(防止溅到边缘),以3 000 r/min离心3 min,收集滤液;另从葡聚糖G-50凝胶微柱顶端中心缓慢加入超纯水200 μL,以3 000 r/min离心3 min,收集滤液,从葡萄糖G-50凝胶微柱顶端中心缓慢加入超纯水200 μL开始至收集滤液,重复操作15次,收集每次离心后的滤液[21];将离心后的滤液用甲醇定容至10 mL,按“2.2.1”项下色谱条件进样测定,绘制洗脱曲线,详见图2。由图2可知,从第7次离心后开始,过滤液中可检测到游离的TCH,提示葡聚糖G-50凝胶微柱对游离TCH具有一定的吸附作用。
2.3.2 TCH醇质体的洗脱曲线 取“2.1.1”项下制备的TCH醇质体200 μL,按“2.3.1”项下方法收集滤液,将离心后的滤液用甲醇破乳并定容至10 mL,再按“2.2.1”项下色谱条件进样测定,绘制洗脱曲线,详见图3。由图3可知,0~4管为TCH醇质体,7~13管为游离的TCH,提示葡聚糖G-50凝胶微柱能将TCH醇质体和游离TCH有效地分离。
2.4 包封率影响因素的考察
通过前期预试验及查阅相关文献[22-23]后发现,蛋黄卵磷脂质量浓度、TCH对照品加入量、乙醇体积分数对包封率影响较大,因此本研究以上述3个因素为指标进行单因素试验。
2.4.1 蛋黄卵磷脂质量浓度 以TCH对照品加入量为2 mg、乙醇体积分数为30%、胆固醇质量浓度为0.2 mg/mL、超声时间为5 min,考察不同蛋黄卵磷脂质量浓度(5、6、7、8 mg/mL)对包封率的影响,重复操作3次,详见图4A。由图4A可知,当蛋黄卵磷脂浓度为7 mg/mL时包封率最高,故选择蛋黄卵磷脂浓度范围为6~8 mg/mL进行后续优化。
2.4.2 TCH对照品加入量 以蛋黄卵磷脂质量浓度为7 mg/mL、乙醇体积分数为30%、胆固醇质量浓度为0.2 mg/mL、超声时间为5 min,考察不同TCH对照品加入量(0.5、1、1.5、2、3、4 mg)对包封率的影响,重复操作3次,详见图4B。由图4B可知,TCH对照品加入量为1 mg时包封率最高,故选择TCH对照品加入量范围为0.5~1.5 mg进行后续优化。
2.4.3 乙醇体积分数 以蛋黄卵磷脂质量浓度为7 mg/mL、TCH对照品加入量为1 mg、胆固醇质量浓度为0.2 mg/mL、超声时间为5 min,考察不同乙醇体积分数(20%、25%、30%、35%、40%)对包封率的影响,重复操作3次,详见图4C。由图4C可知,当乙醇体积分数为30%时包封率最高,故选择乙醇体积分数范围为25%~40%进行后续优化。
2.5 TCH醇质体的处方工艺优化
2.5.1 试验设计 根据“2.4”项下单因素试验结果,以TCH对照品加入量(X1)、蛋黄卵磷脂质量浓度(X2)、乙醇体积分数(X3)为变量,以包封率(Y)为指标,进行3因素5水平试验设计,因素与水平见表2(α=1.732),试验方案设计与结果见表3。
2.5.2 方程拟合 根据表3对方程进行线性拟合,以包封率为指标,得二项式方程为:Y=64.88-1.45X1-0.53X2+0.84X3+1.06X1X2-3.16X1X3+3.93X2X3-21.65X12-17.8X22-20.29X32(R2=0.987 6)。该模型的P<0.000 1,具有极大显著性,失拟项P=0.226 0>0.05,说明该模型无失拟现象,表明此方程具有良好的准确性,可用于TCH醇质体处方工艺的分析和预测,方差分析结果见表4。
2.5.3 响应面分析 采用Design-Expert 8.0.6软件,绘制响面图和等高线图,详见图5。由图5可知,X1与X2、X1与X3、X2与X3交互作用显著,且包封率均随TCH对照品加入量、蛋黄卵磷脂质量浓度以及乙醇体积分数的增加而呈现先增大后减小的趋势。
2.5.4 最优工艺的确定 采用Design-expert 8.0.6软件得到最优工艺为TCH对照品加入量0.98 mg,蛋黄卵磷脂质量浓度6.99 mg/mL,乙醇体积分数32.67%;预测包封率为64.92%。为了方便试验操作,将软件得到的工艺处方进行优化,即TCH对照品加入量为1 mg,蛋黄卵磷脂质量浓度为7 mg/mL,乙醇体积分数为33%。
2.5.5 验证试验 按“2.5.4”项下最优处方工艺制备TCH醇质体,平行操作3次。结果显示,3次试验所得醇质体包封率为64.62%、64.52%、64.37%,平均值为64.50%,与预测值(64.92%)的相对偏差为0.64%,提示该制备工艺稳定、可行。
2.6 优化工艺所制TCH醇质体的表征
2.6.1 外观评价 TCH醇质体为微有蓝色乳光的澄清液体,与文献报道[24]一致。
2.6.2 粒径 分别取 “2.5.4”项下制备的TCH醇质体适量,置于10 mL量瓶中,加水稀释50倍,用马尔文粒度仪分别测定粒径和电位。结果,平均粒径为(80.33±2.24)nm,多分散系数为0.145±0.03,粒子呈正态分布且分散性良好,平均表面电位为(-22.6±1.33)mV,详见图6。
2.6.3 形态 透射电镜下可见,TCH醇质体外观为球形,形态圆整、光滑、大小均一、分散均匀,详见图7。
2.7 优化工艺所制TCH醇质体的初步稳定性试验
按“2.5.4”项下最优处方工艺制备TCH醇质体,取适量于4 ℃冰箱中密封避光保存,分别于第0、5、10天观察其性状并测定其包封率,重复操作3次,详见表5。由表5可知,TCH醇质体的性状、包封率均未发生明显变化,提示TCH醇质体在4 ℃避光且密封的环境中放置10 d稳定性良好。
3 讨论
本研究采用HPLC法测定了TCH醇质体中TCH的含量,该方法的专属性、精密度、稳定性、重复性、加样回收率均符合要求,且操作简单、快捷。
常用的制备醇质体方法有注入-超声法、薄膜分散法和逆向蒸发法[25]。本研究以包封率为指标,对TCH醇质体的制备方法进行了筛选。结果发现,薄膜分散法、逆向蒸发法存在有机溶剂残留,不适于工业化生产;而采用注入-超声法制得TCH醇质体的包封率最高,且操作简单、方便、可重复。
有研究认为,影响TCH醇质体包封率的因素很多,如蛋黄卵磷脂质量浓度、TCH对照品加入量、乙醇体积分数、超声时间、搅拌时间、搅拌温度等[22]。本研究在前期预试验中发现,超声时间过长,TCH醇质体膜会发生破裂,造成TCH泄露;超声时间过短,又可造成TCH醇质体粒径过大、分布不均匀,因此确定超声时间为5 min。有研究发现,胆固醇的加入可以增加醇质体磷脂双分子层的韧性,提高醇质体的稳定性[26] 。本研究发现,处方中加入一定量的胆固醇可提高TCH醇质体的包封率,但浓度过高会造成包封率减小,这可能是因为高浓度的胆固醇可造成脂质体膜的不对称性增加,从而引起膜破裂、药物渗透率增加[26],因此选择胆固醇质量浓度为0.2 mg/mL。
综上所述,本研究得到最优工艺处方为TCH对照品加入量为1 mg,蛋黄卵磷脂质量浓度为7 mg/mL,乙醇体积分数为33%;平均包封率为64.50%。优化所得TCH醇质体的制备工艺稳定、可行,所建含量测定方法操作简单、快捷。
参考文献
[ 1 ] LI W,ZHAO J,CUI Y. Study on the synthesis process of tetracaine hydrochloride[J]. IOP Conf Ser:Earth and Environ Sci,2017. DOI:10.1088/1755-1315/64/1/012108.
[ 2 ] PANG X,FAN TJ. Cytotoxic effect and possible mechanisms of tetracaine on human corneal epithelial cells in vitro[J]. Int J Ophthalmol,2016,9(4):497-504.
[ 3 ] AHMED KH,SUHAM TA,BAHRUDDIN S. Tetracaine- selective electrodes with polymer membranes and their application in pharmaceutical formulation control[J]. Ara- bian J Chem,2013. DOI:10.1016/j.arabjc.2013.04.029.
[ 4 ] GIORDANO D,RASO MG,PERNICE C,et al. Topical local anesthesia:focus on lidocaine-tetracaine combination[J]. Local Reg Anesth,2015. DOI:10.2147/LRA.S41836.
[ 5 ] 劉关言.丁卡因凝胶处方研究[D].大连:大连理工大学,2016.
[ 6 ] 庞晓晨,成睿珍,赵静,等.中药透皮给药系统研究进展及其新剂型的应用[J].中国新药杂志,2019,28(3):286- 291.
[ 7 ] PRAUSNITZ MR,LANGER R. Transdermal drug deli- very[J]. Nat Biotechnol,2008,26(11):12681-12682.
[ 8 ] SCHOELLHAMMER CM,BLANKSCHTEIN D,LANGER
R. Skin permeabilization for transdermal drug delivery:recent advances and future prospects[J]. Expert Opin Drug Deliv,2014,11(3):393-407.
[ 9 ] NAINWAL N,JAWLA S,SINGH R,et al. Transdermal applications of ethosomes-aadetailed review[J]. J Liposome Res,2019,9(2):103-113.
[10] ABDULBAQI IM,DARWIS Y,KHAN NA,et al. Ethosomal nanocarriers:the impact of constituents and formulation techniques on ethosomal properties,in vivo studies,and clinical trials[J]. Int J Nanomedicine,2016. DOI:10.2147/IJN.S105016.
[11] TOUITOU E,DAYAN N,BERGELSON L,et al. Ethosomes-novel vesicular carriers for enhanced delivery:cha- racterization and skin penetration properties[J]. J Control Release,2000,65(3):403-418.
[12] SARWA KK,SURESH PK,RUDRAPAL M,et al. Penetration of tamoxifen citrate loaded ethosomes and liposomes across human skin:a comparative study with confocal laser scanning microscopy[J]. Curr Drug Deliv,2014,11(3):332-337.
[13] JAIN S,PATEL N,MADAN P,et al. Quality by design approach for formulation,evaluation and statistical optimization of diclofenac-loaded ethosomes via transdermal route[J]. Pharm Dev Technol,2015,20(4):473-489.
[14] 孙杏华,李圣惠,丁青龙,等.盐酸氟西汀醇质体凝胶剂的制备及其体外经皮渗透性研究[J].中国新药杂志,2015,24(24):2843-2847、2864.
[15] 张楠,宋辉,汪志强,等.冰片修饰的秋水仙碱醇质体的制备及体外扩散性评价[J].中国药房,2018,29(7):902- 906.
[16] 傅秀娟,任美萍,钟志容,等.薄膜蒸发法制备吲哚美辛醇质体的方法优化[J].泸州医学院学报,2013,36(2):129-133.
[17] 陈欣妍,李歆,王皓南,等.雷公藤红素长循环脂质体的制备和体外性质初步研究[J].中国新药杂志,2019,28(4):485-491.
[18] 白洁,冯健男,杨畅,等.芍药苷凝胶剂与醇质体凝胶剂透皮性能比较[J].中国实验方剂学杂志,2017,23(4):12-15.
[19] 王美云.高效液相色谱法测定盐酸丁卡因注射液中盐酸丁卡因的含量[J].山西医药杂志,2017,46(11):1363- 1365.
[20] 金鹏飞,邝咏梅,姜文清,等.高效液相色谱法同时测定复方丁卡因搽剂中盐酸丁卡因与磺胺醋酰钠含量[J].医药导报,2016,35(3):305-307.
[21] 侯文书,张丹参,张力,等. PEG修饰姜黄素固体脂质纳米粒的制备、表征及溶出特征[J].中草药,2019,50(8):1927-1934.
[22] 梅娜,毛羽,徐作军,等.藏药“扎颉俄色”总黄酮醇质体制备工艺的优化[J].中国民族民间医药,2018,27(17):23-26.
[23] 刘园园,郝谜谜,王艳,等.醇质体在经皮给药系统中的应用研究[J].中国药房,2017,28(28):4008-4011.
[24] 何良飞,陶玲,管咏梅,等.雷公藤甲素阿魏酸醇质体的制备与评价[J].中草药,2018,49(12):2817-2825.
[25] 张利竣,石森林,邵敬宝,等.弹性脂质囊泡在经皮给药系统的研究进展[J].中国现代应用药学,2019,36(4):511-515.
[26] 冯健男,杜守颖,白洁,等.星点-效应面法优化芍药苷醇质体制备工艺[J].环球中医药,2016,9(4):409-413.
(收稿日期:2019-07-02 修回日期:2019-11-07)
(編辑:陈 宏)
