黑龙江省部分稻田萤蔺种群对吡嘧磺隆的抗药性分析
2019-09-10刘亚光魏超月张正南朱金文吴绘鹏
刘亚光 魏超月 张正南 朱金文 吴绘鹏


摘要:【目的】明确黑龙江省部分稻田萤蔺(Scirpus juncoides Roxb.)对吡嘧磺隆的抗药性水平及抗性机制,为水稻田萤蔺的综合治理提供理论依据。【方法】以采自黑龙江省的23个萤蔺种群为试验材料,利用整株盆栽法测定其对吡嘧磺隆的抗药性水平。选取代表性抗性种群(SC-1和SC-8)和敏感种群(SC-23),于萤蔺抽茎期剪取花茎后,以不同浓度(0.1、10.0、100.0、1000.0和10000.0 nmol/L)的吡嘧磺隆溶液对其进行离体乙酰乳酸合成酶(ALS)检测;抽茎期喷施250 g/ha吡嘧磺隆对萤蔺进行茎叶处理,施药后第0、1、3、5、7和9 d剪取花茎,分别用于活体ALS活性和谷胱甘肽—硫—转移酶(GSTs)活性测定。【结果】整株盆栽法测定结果表明,供试22个种群中有7个种群对吡嘧磺隆产生了抗性,占供试种群的31.8%。离体条件下,抗性种群SC-1和SC-8体内ALS对吡嘧磺隆的敏感性明显降低,抗性指数分别为69.81和23.83;活体条件下,抗性种群SC-1和SC-8的ALS相对活性受到抑制后均能恢复至正常水平,敏感种群SC-23则不能恢复,3个种群试验结束时(第9 d)的相对活性别为0.92、0.72和0.45;抗性种群SC-1和SC-8的GSTs相对活性自施用吡嘧磺隆后第1 d起均显著高于敏感种群SC-23(P<0.05),且二者分别于施药后第3和第1 d升至最高值,分别为2.36和1.94,敏感种群SC-23的GSTs相对活性于施药后第1 d升至最高值,为1.49。【结论】黑龙江省部分地区稻田萤蔺已对吡嘧磺隆产生了低到中等水平抗性。抗性萤蔺种群的ALS对吡嘧磺隆敏感性下降和GSTs代谢作用增强可能与其抗性有关。
关键词: 萤蔺;吡嘧磺隆;抗药性;乙酰乳酸合成酶(ALS);谷胱甘肽—硫—转移酶(GSTs);黑龙江省
中图分类号: S451 文献标志码: A 文章编号:2095-1191(2019)03-0570-08
0 引言
【研究意义】萤蔺(Scirpus juncoides Roxb.)隶属于莎草科(Cyperaceae)多年生草本杂草,是我国北方稻田主要恶性杂草之一(罗宝君,2016)。近年来,萤蔺在黑龙江省水稻田内的发生和危害日趋严重,部分稻田萤蔺密度高达300株/m2,该杂草可在短时间内对水稻造成郁蔽而导致严重减产。磺酰脲类除草剂主要通过抑制支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)的生物合成而起除草作用,乙酰乳酸合成酶(Acetolactate synthase,ALS)是其唯一作用靶标(张朝贤等,2009)。吡嘧磺隆属磺酰脲类除草剂,在黑龙江省水稻田应用已有20余年的历史,但近年来黑龙江省部分水稻产区吡嘧磺隆对萤蔺的防效出现严重下降趋势(张玉池等,2018)。因此,对黑龙江省水稻产区萤蔺进行抗性测定,探讨其产生抗性的机理机制,对当地稻田萤蔺的综合防治具有重要意义。【前人研究进展】由于磺酰脲类除草剂具有生物活性高、选择性强、杀草谱广、对哺乳动物安全等优点,在全球范围内已得到广泛使用,但因其作用位点单一且长期使用,杂草对其抗性发展迅速。陈丽丽等(2013)采用盆栽法茎叶处理方式测定了黑龙江省5个地区水稻田野慈姑对吡嘧磺隆的敏感性,结果表明,常规施药量30 g/ha对各种群已无效,各种群对吡嘧磺隆的半数有效剂量(ED50)是20世纪90年代初期黑龙江省水稻田吡嘧磺隆常规田间施药量10~15 g/ha的10.7~48.4倍。刘亚光等(2015)采用盆栽法土壤处理方式测定了黑龙江省不同地区稻田萤蔺对吡嘧磺隆的抗药性,结果表明,五常市和哈尔滨市种群对吡嘧磺隆已产生低水平抗性,牡丹江市萤蔺种群对吡嘧磺隆产生了中等水平抗性,其他地区萤蔺对吡嘧磺隆仍处于敏感阶段,但未阐述抗性产生原因。李丹等(2017)采用盆栽法茎叶处理方式检测了从山东、湖北和江苏省稻田采集的28个鳢肠(Eclipta prostrata)种群对吡嘧磺隆的敏感性,发现除江苏省种群具有较高水平抗性外,其他地区鳢肠种群对吡嘧磺隆均为敏感种群。Fu等(2017)报道我国东北地区稻田三叶鬼针草(Bidens pilosa L.)对苄嘧磺隆产生了中到高等水平抗性。吴翠霞等(2018)采用盆栽法茎叶处理方式测定了山东省小麦田荠菜(Capsella bursa-pastoris)对苯磺隆的抗性水平,结果表明,山东省小麦田荠菜已普遍对苯磺隆产生抗性,其中滨州市荠菜抗性倍数最高可达6863.80。国内外研究表明,杂草对除草剂的抗性机理主要包括靶标抗性和非靶标抗性(张朝贤等,2009;张云月等,2013)。靶标抗性涉及两个方面,一是杂草ALS基因突变引起的除草剂敏感性下降。Uchino等(2010)、Sada等(2012,2013)采用PCR扩增了抗、感萤蔺生物型的ALS基因,发现抗性萤蔺生物型ALS基因第197位脯氨酸分别突变为丝氨酸、组氨酸和亮氨酸,第574位色氨酸突变为亮氨酸,第376位天冬氨酸突变为谷氨酸,同时证实靶标酶位点突变与抗性萤蔺生物型ALS敏感性降低有关;郎红等(2015)认为抗性慈姑(Sagittaria trifolia L.)ALS第324位错义突变可能破坏了蛋白质的二级结构或增加了二级结构的螺旋、折叠及卷曲的形成概率,从而降低了ALS对吡嘧磺隆的亲和力;李平生等(2015)分别测定了苄嘧磺隆对辽宁省4个水稻产区野慈姑种群离体叶片ALS活性的影响,发现抗、感野慈姑种群对苄嘧磺隆ALS活性的抑制中浓度(IC50)差异较明显,认为抗药性野慈姑种群的ALS对苄嘧磺隆敏感性下降可能是其产生抗性的原因之一。二是靶标酶的过量表达。彭学岗等(2009)发现经苯磺隆处理后2 d,抗性生物型豬殃殃(Galium aparine)活体条件下的ALS活性为对照的4.1倍,认为ALS过量表达可能是其产生抗药性的原因之一。杂草对除草剂的非靶标抗性主要是由杂草对除草剂解毒代谢能力的增强而引起。谷胱甘肽—硫—转移酶(GSTs)是催化谷胱甘肽与多种亲电疏水底物结合的多功能酶家族,也是植物对除草剂进行代谢解毒的关键酶系,其可催化还原型谷胱甘肽(GSH)与除草剂发生轭合作用而起到解毒作用(Powles and Yu,2015)。毕亚玲等(2013)通过测定山东省抗、感荠菜生物型GSTs活性发现,经苯磺隆处理后对照组抗、感荠菜生物型10 d内GSTs活力积累和分别为19.53和20.91 U;药剂处理组抗、感荠菜生物型GSTs活力均在第4 d达最高值,分别为同期对照的1.72和1.37倍,认为GSTs对苯磺隆代谢能力的差异可能与荠菜对苯磺隆的抗性有关。Bai等(2018)研究发现,施用苯磺隆后抗、感牛繁缕(Myosoton aquaticum L.)的GSTs活性均在48 h达最高值,抗性牛繁缕的GSTs活性整体明显高于敏感牛繁缕,认为GSTs对苯磺隆代谢作用的增强可能是牛繁缕对苯磺隆产生抗性的原因之一。【本研究切入点】目前,虽已有黑龙江省部分地区萤蔺对吡嘧磺隆产生抗药性的研究报道,但黑龙江省其他地区萤蔺对吡嘧磺隆是否也产生了抗药性、抗性水平及抗性机制等尚未见详细报道。【拟解决的关键问题】通过测定黑龙江省不同地区萤蔺种群对吡嘧磺隆的抗性水平和离体条件下萤蔺的ALS活性抑制率及施药后ALS和GSTs的相对酶活性变化,旨在明确黑龙江省萤蔺对吡嘧磺隆的抗性水平和抗性机制,为指导农民科学用药、延长吡嘧磺隆的使用寿命及抗药性萤蔺的综合治理提供理论依据。
1 材料与方法
1. 1 试验材料
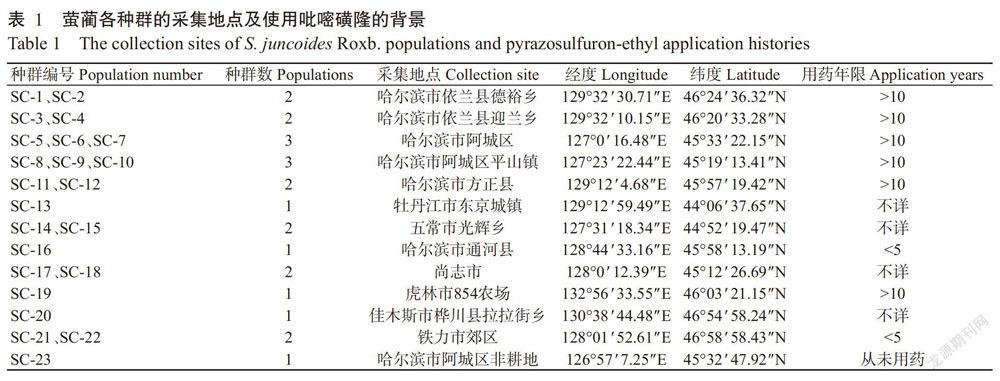
供试植物:2016年9—10月在黑龙江省采集萤蔺种子,根据采集地点将其命名为23个种群(表1),其中SC-23采自从未用过除草剂的非耕地。供试除草剂:10%吡嘧磺隆(Pyrazosulfuron-ethyl)可湿性粉剂(日本化学工业株式会社)。主要试剂:NaOH和K2HPO4(均为分析纯,500 g,天津市恒兴化学试剂制造有限公司);KNO3(分析纯,500 g,天津市四通化工厂);KH2PO4(分析纯,500 g,天津市东丽区天大化学试剂厂);肌酸(生物试剂,25 g,上海晶纯试剂有限公司);甲萘酚(分析纯,25 g,中国五联化工厂);95%乙醇(分析纯,500 mL,天津市富宇精细化工有限公司);(NH4)2SO4(分析纯,500 g,莱阳化工实验厂);考马斯亮蓝G250(高级纯,5 g)、丙酮酸钠(99.00%~100.02%,25 g)、TPP(BR≥98%,10 g)、FAD(BR≥94%,20 mg)和牛血清蛋白(第5组分,BR≥98%,10 g)均为Summus生物科技有限公司产品;MgCl2(分析纯,500 g,天津市耀华化学试剂有限责公司)。主要仪器:人工气候箱RXZ(宁波江南仪器厂);3WPSH-500D型生测喷雾塔(农业农村部南京农业机械化研究所);微量移液器(Gilson公司);台式高速冷冻离心机(5430R,Eppendorf公司);电热恒温水浴锅HWS-28(上海一恒科学仪器有限公司);双光束紫外可见分光光度计TU-1901(北京普析通用仪器有限责任公司)。
1. 2 供试植物培养
将不同种群萤蔺种子放入5 ℃储藏柜中层积处理28 d后,用2000 mg/L乙烯利浸种2 d,25 ℃光照培养箱内催芽1 d。采用整株盆栽法,将未施用过除草剂的土壤风干过筛后装入塑料盆直径18 cm,高38 cm),每盆播种10粒催眠萌发后刚露白的萤蔺种子,种植深度2 cm,覆盖1 cm过筛风干土,播种后1 d用喷壶浇水并保持3 cm左右水层。试验在室外进行,正常水分管理。
1. 3 测定项目及方法
1. 3. 1 不同萤蔺种群对吡嘧磺隆的抗性水平测定 根据预试验确定的吡嘧磺隆剂量(6.5、12.5、25.0、100.0和400.0 g.a.i/ha),于播种后1 d,分别用注射器定量抽取5 mL药液均匀分散滴入盆中(盆中水层呈浑浊状态),以滴清水为对照(CK),3次重复。药后21 d剪取萤蔺地上部分,称量鲜重。
杂草鲜重抑制率(%)=(空白对照杂草鲜重-处理杂草鲜重)/空白对照杂草鲜重×100。以杂草鲜重抑制率机率值(y)和剂量对数值(x)求得毒力回归方程(y=bx+a)及ED50,进而计算供试杂草种群的抗性指数(Resistance index,IR),IR=[抗药性种群的ED50(IC50)]/[敏感种群的ED50(IC50)]。抗性水平判定标准:敏感种群(1≤IR<5),低抗种群(5≤IR<10),中抗种群(10≤IR<50),高抗种群(IR≥50)(高兴祥等,2014)。选取中抗种群中抗性水平差异最明显的2个种群及敏感种群作为1.3.2~1.3.4的供试材料。
1. 3. 2 离体条件下萤蔺ALS活性测定 待萤蔺长至抽茎期(花茎达15~20 cm),剪取1 g花茎,以不同浓度(0.1、10.0、100.0、1000.0和10000.0 nmol/L)吡嘧磺隆溶液处理花茎,清水为对照(CK),3次重复。参照范志金等(2003)的方法测定萤蔺离体ALS活性,考马斯亮蓝G-250法测定可溶性蛋白含量。以酶活性抑制率机率值(y)和除草剂浓度对数值(x)建立毒力回归方程(y=bx+a),求得IC50,抗性指数计算及标准参照1.3.1。酶活抑制率(%)=(A525CK-A525)/A525CK×100,其中,A525和A525CK分别表示药剂处理及清水处理下萤蔺种群的酶活性,1.3.3~1.3.4同。
1. 3. 3 活体条件下萤蔺ALS活性测定 待萤蔺长至抽茎期,用10%吡嘧磺隆可湿性粉剂250 g/ha茎叶喷雾,清水为对照(CK),3次重复,分别于施药后第1、3、5、7和9 d剪取适量花茎,参照隋标峰等(2007)的方法测定萤蔺活体ALS活性。ALS相对活性=A525/A525CK。
1. 3. 4 萤蔺体内GSTs活性测定 施药时期和施药方式同1.3.3。分别于施药后第0、1、3、5、7和9 d剪取适量花莖,参照Pamela和David(1996)方法测定萤蔺的GSTs活性。GSTs相对活性=A340/A340CK。
1. 4 统计分析
利用DPS v7.05进行数据处理,Duncan’s新复极差法进行差异显著性检验,Excel 2007进行统计和制图。
2 结果与分析
2. 1 不同萤蔺种群对吡嘧磺隆抗性水平测定结果
23个萤蔺种群对吡嘧磺隆的整株抗药性水平见表2,其中SC-23采自从未使用过吡嘧磺隆的非耕地,ED50为15.22 g.a.i/ha,对吡嘧磺隆最敏感,因此确定该萤蔺种群为敏感种群。由表2可知,22个种群中有7个种群(SC-1、SC-3、SC-5、SC-6、SC-4、SC-8和SC-11)对吡嘧磺隆产生了抗性,占31.8%,其中SC-1和SC-3对吡嘧磺隆的抗药性水平最高,抗性指数分别为23.71和16.49,ED50分别为360.97和251.00 g.a.i/ha,SC-11对吡嘧磺隆处于低水平抗性,抗性指数为6.35;有15个种群为敏感种群,占68.2%,抗性指数为2.02~3.69。
根据表2结果,从中选取中抗种群中抗性水平差异最明显的2个种群(SC-1和SC-8)和敏感种群(SC-23)进行后续试验。
2. 2 离体条件下萤蔺ALS活性测定结果
随着吡嘧磺隆浓度的提高,抗性和敏感萤蔺种群ALS活性抑制率均呈持续上升趋势。当吡嘧磺隆浓度为0.1 nmol/L时,抗性种群SC-1和SC-8的ALS活性抑制率最低,分别为9.81%和12.75%,二者均于10000.0 nmol/L时升至最高值,分别为56.15%和63.80%;除0.1 nmol/L处理外,其余浓度处理下SC-1的ALS活性抑制率显著低于SC-8(P<0.05,下同),且两个抗性种群的ALS活性抑制率均显著低于敏感种群SC-23;敏感种群SC-23的ALS活性抑制率表现与两个抗性种群相似,在0.1 nmol/L处理下ALS活性抑制率最低(10.46%),于10000.0 nmol/L升至最高值(80.00%)。可见,随着吡嘧磺隆浓度的提高,抗、感萤蔺种群的ALS活性受抑制程度均呈不断加强趋势,以SC-23受抑制程度最高,SC-8次之,SC-1最低。吡嘧磺隆浓度与ALS活性抑制效果的关系见表3。由表3可知,SC-1的IC50最高,为10131.67 nmol/L,显著高于SC-8(3458.35 nmol/L),二者均显著高于SC-23(145.14 nmol/L);离体法测得的萤蔺ALS抗性指数以SC-1最高(69.81),且显著高于SC-8(23.83),与整株盆栽法测得的抗性趋势一致。可见,萤蔺体内ALS对吡嘧磺隆敏感性下降是其产生抗性的主要原因之一。
2. 3 活体条件下萤蔺ALS相对活性测定结果
施用吡嘧磺隆后,抗性种群SC-1和SC-8的ALS活性整体上呈先下降再上升的变化趋势。SC-1的ALS相对活性的最低值和最高值分别出现在施药后第3和第9 d,为0.60和0.92,且整个试验过程中其ALS相对活性均显著高于敏感种群SC-23;SC-8的ALS相对活性的最低值和最高值分别出现在施药后第3和第7 d,为0.49和0.73,至试验结束时(第9 d)为0.72,在整个试验过程中其ALS相对活性均显著高于SC-23,但显著低于SC-1;敏感种群SC-23的ALS相对活性整体呈下降趋势,最低值和最高值分别出现在施药后第3和第1 d,为0.42和0.53,且直至试验结束,其ALS相对活性仅为0.45,ALS相对活性不能恢复。可见,不同种群萤蔺的ALS相对活性均受到吡嘧磺隆一定程度的抑制,且敏感种群受抑制程度明显高于抗性种群;抗性种群间因抗性水平不同受抑制程度也存在差异,随着时间延长,抗性水平越高,其ALS相对活性恢复能力越强。
2. 4 萤蔺GSTs相对活性测定结果
吡嘧磺隆对抗、感种群萤蔺的GSTs相对活性测定结果。施用吡嘧磺隆后,抗、感种群萤蔺的GSTs相对活性整体呈先上升后下降的变化趋势。抗性种群SC-1和SC-8的GSTs相对活性分别于施药后第3和第1 d升至最高值,为2.36和1.94,之后逐渐下降,至试验结束(第9 d)时分别为1.85和1.33,二者的GSTs相对活性从施药后第1 d起显著高于敏感种群SC-23,且SC-8的GSTs相对活性从施药后第3 d起显著低于SC-1;敏感种群SC-23的GSTs相对活性于施药后第1 d升至最高值,为1.49,至试验结束时为1.25。可见,施用吡嘧磺隆后,抗性种群的GSTs相对活性明显高于敏感种群,与整株盆栽法测得的抗性趋势一致。
3 讨论
本研究结果表明,22个萤蔺种群中有7个抗药性种群,占31.8%,说明吡嘧磺隆已在黑龙江省多地存在抗性风险;同时发现不同采集点抗药性萤蔺种群的抗性水平差异明显,可能与不同地区用药历史、施药水平、生态环境等因素导致的高强度除草剂选择压力有关。根据整株盆栽法测定结果,在黑龙江省部分地区使用吡嘧磺隆防除萤蔺存在一定的抗性风险,建议哈尔滨市依兰县德裕乡和迎兰乡、哈尔市阿城区和平山镇等已对吡嘧磺隆产生抗性的地区避免单一使用吡嘧磺隆,科学轮换使用不同作用机制的除草剂,以延缓抗药性杂草的产生。
离体条件下ALS对吡嘧磺隆的敏感程度一方面可反映ALS与抗药性的关系,另一方面能从酶水平确定萤蔺对吡嘧磺隆的抗药性水平(付丹妮等,2018)。本研究中,抗性种群SC-1和SC-8的ALS活性抑制率整体上低于敏感种群SC-23,说明敏感种群萤蔺的ALS对吡嘧磺隆仍保持高度敏感,抗性种群敏感性明显降低,与Yasushi(2003)研究抗唑吡嘧磺隆萤蔺的结果相似。本研究中,抗性种群SC-1和SC-8的IC50分别为敏感种群SC-23的69.81和23.83倍,显著高于SC-23,进一步说明抗性种群萤蔺的ALS对吡嘧磺隆敏感性下降可能是其产生抗药性的重要原因之一,与吴明根等(2007)研究抗吡嘧磺隆雨久花、吴小虎等(2011)研究抗苯磺隆麦家公离体条件下的ALS抗性机理结果相似。活体条件下,喷施250 g/ha吡嘧磺隆后,敏感种群萤蔺的ALS相对活性整体呈下降趋势,试验结束时(施药后第9 d)仅为0.45,说明ALS相对活性受到强烈抑制后不能恢复,可能是造成其对吡嘧磺隆敏感的原因。隋标峰等(2007)研究发现敏感性低的泽漆(Euphorbia helioscopia L.)活体ALS活性最高可达对照的2.90倍,认为较高的ALS活性能引起靶标酶水平过量表达,进而提高泽漆对苯磺隆的耐药性。本研究中,抗性种群萤蔺的ALS相对活性始终显著高于敏感种群,且抗性种群萤蔺的ALS相对活性均呈先下降再上升的变化趋势,试验结束时ALS相对活性分别恢复至同期对照的92%和72%,与隋标峰等(2007)的研究结果存在差异,结合离体ALS活性测定结果推测,可能不是由于靶标酶的过量表达,而是由于抗性种群萤蔺的ALS对吡嘧磺隆敏感性下降,导致ALS相对活性受抑制程度较轻,随着时间延长,吡嘧磺隆不断被代謝,ALS相对活性又趋于恢复正常水平,与毕亚玲等(2013)研究抗苯磺隆荠菜活体ALS抗性机理的结果基本一致。此外,本研究发现,抗性和敏感种群萤蔺ALS活性均在吡嘧磺隆处理后第3 d降至最低,与崔海兰(2009)报道抗苯磺隆播娘蒿的活体ALS活性变化规律相似,可能与吡嘧磺隆本身是内吸传导型除草剂而引起的最佳药效发挥时间有关。
GSTs在抵御除草劑等外源物质损伤和抗逆性等方面扮演着重要角色,杂草体内的GST活性直接影响其对除草剂的解毒代谢能力(Riechers et al.,2010;Ma et al.,2013)。有研究表明,对不同生物或非生物胁迫GSTs可被特异性诱导,具有明确的特异性和表达模式(郭玉莲等,2008)。本研究发现,从施用吡嘧磺隆后第1 d起,抗性和敏感种群萤蔺的GSTs相对活性相比同期对照始终保持较高水平,且抗性种群萤蔺的GSTs相对活性显著高于敏感种群,说明抗性种群较敏感种群具有更高的诱导GSTs活性能力,GSTs对吡嘧磺隆解毒代谢能力的差异可能是萤蔺对吡嘧磺隆产生抗药性的部分原因,与彭学岗等(2009)研究抗苯磺隆猪殃殃、刘伟堂(2015)研究抗苯磺隆牛繁缕代谢抗性机理的结论相似。除草剂作为一种非生物逆境,与低温、干旱、重金属和盐等其他逆境一样会加剧植物的氧化胁迫(陈丽娜等,2010)。通常认为,GSTs通过清除脂类氢过氧化物和H2O2、催化毒性有机氢过氧化物的还原反应,在植物氧化应激反应中具有关键作用。本研究中,在吡嘧磺隆胁迫下,抗性和敏感种群萤蔺的GSTs相对活性均呈先上升再下降的变化趋势,其原因可能是萤蔺通过增加GSTs活性而阻止脂质过氧化的链式反应,保护植物细胞膜免受氧化应激。
本研究通过整株盆栽法测定黑龙江省23个萤蔺种群对吡嘧磺隆的抗性水平,进一步明确了黑龙江省部分地区稻田萤蔺对吡嘧磺隆的抗性水平;通过测定抗、感萤蔺种群的ALS和GSTs相对活性变化,初步明确黑龙江省稻田萤蔺对吡嘧磺隆的抗药性原因。近年来,萤蔺对吡嘧磺隆的抗性程度和防除难度不断提升,今后应加强对其抗性水平和蔓延趋势的监测;同时,杂草对除草剂产生抗性的机理十分复杂,有关萤蔺对吡嘧磺隆产生抗性的分子机理仍需进一步探究。
4 结论
黑龙江省部分地区稻田萤蔺已对吡嘧磺隆产生了低到中等水平抗性。抗性萤蔺种群的ALS对吡嘧磺隆敏感性下降和GSTs代谢作用增强可能与其抗性有关。
参考文献:
毕亚玲,刘君良,王兆振,卜东欣,郭文磊,王金信. 2013. 麦田抗性生物型荠菜对苯磺隆的抗性机制研究[J]. 农药学学报,15(2):171-177. [Bi Y L,Liu J L,Wang Z Z,Bu D X,Guo W L,Wang J X. 2013. Mechanism of resistance to tribenuron-methyl in a resistant biotype of Capsella bursa-pastoris from wheat fields[J]. Chinese Journal of Pesticide Science,15(2):171-177.]
陈丽丽,何付丽,范丹丹,张明波,李灼,郭晓慧,赵长山. 2013. 黑龙江省野慈姑对吡嘧磺隆的敏感性测定[J]. 植物保护,39(6):120-123. [Chen L L,He F L,Fan D D,Zhang M B,Li Z,Guo X H,Zhao C S. 2013. Sensitivity tests of Sagittaria trifolia from Heilongjiang Province to pyrazosulfuron-ethyl[J]. Plant Protection,39(6):120-123.]
陈丽娜,唐明灯,艾绍英,李盟军,曾招兵,王艳红. 2010. Pb胁迫条件下3种叶菜的生长和生理响应及其抗性差异[J]. 植物资源与环境学报,19(4):78-83. [Chen L N,Tang M D,Ai S Y,Li M J,Zeng Z B,Wang Y H. 2010. Growth and physiological responses and variance of Pb resistance of three leaf vegetables under Pb stress[J]. Journal of Plant Resources and Environment,19(4):78-83.]
崔海兰. 2009. 播娘蒿(Descurainia sophia)对苯磺隆的抗药性研究[D]. 北京:中国农业科学院. [Cui H L. 2009. The resistance of flix weed(Descurainia sophia) to tribenuron-methyl[D]. Beijing:Chinese Academy of Agricultural Sciences.]
范志金,钱传范,于维强,陈俊鹏,李正名,王玲. 2003. 氯磺隆和苯磺隆对玉米乙酰乳酸合成酶抑制作用的研究[J]. 中国农业科学,36(2):173-178. [Fan Z J,Qian C F,Yu W Q,Chen J P,Li Z M,Wang L. 2003. Study on enzymatic inhibition of acetolactate synthase from maize(Zea mays L.) by chlorsulfuron and tribenuron-methyl[J]. Scien-tia Agricultura Sinica,36(2):173-178.]
付丹妮,赵铂锤,陈彦,孙中华,纪明山. 2018. 东北稻田野慈姑对苄嘧磺隆抗药性研究[J]. 中国植保导刊,(1):17-23. [Fu D N,Zhao B C,Chen Y,Sun Z H,Ji M S. 2018. Resistance of Sagittaria trifolia L. to bensulfuron-methyl in paddy fields in northeast China[J]. China Plant Protection,(1):17-23.]
高興祥,李美,高宗军,房锋,张悦丽,齐军山. 2014. 山东省小麦田播娘蒿对苯磺隆的抗性测定[J]. 植物保护学报,41(3):373-378. [Gao X X,Li M,Gao Z J,Fang F,Zhang Y L,Qi J S. 2014. Determination of flixweed(Descurainia sophia) resistance to tribenuron-methyl in Shandong Province[J]. Journal of Plant Protection,41(3):373-378.]
郭玉莲,陶波,郑铁军,李宝英,翟喜海,潘亚清. 2008. 植物谷胱甘肽S-转移酶(GSTS)及除草剂解毒剂的诱导作用[J]. 东北农业大学学报,39(7):136-139. [Guo Y L,Tao B,Zheng T J,Li B Y,Zhai X H,Pan Y Q. 2008. Inducement action of plant GSTS and herbicides antidotes[J].Journal of Northeast Agricultural University,39(7):136-139.]
郎红,吴明根,李俭,吴松权. 2015. 延边慈姑抗磺酰脲类除草剂的分子机制[J]. 吉林农业大学学报,37(3):296-300.[Lang H,Wu M G,Li J,Wu S Q. 2015. Molecular me-chanism of herbicide resistant to sulfonylurea of Sagittaria sagittifolia in Yanbian[J]. Journal of Jilin Agricultural University,37(3):296-300.]
李丹,李香菊,于惠林,崔海兰. 2017. 我国部分地区水稻田鳢肠对吡嘧磺隆的抗性测定[J]. 植物保护,43(2):196-201. [Li D,Li X J,Yu H L,Cui H L. 2017. Detection of resistance of Eclipta prostrata L. to pyrazosulfuron-ethyl in some provinces of China[J]. Plant Protection,43(2):196-201.]
李平生,魏松红,纪明山,东琴,王海宁. 2015. 辽宁省稻田野慈姑对苄嘧磺隆的抗药性[J]. 植物保护学报,42(4):663-668. [Li P S,Wei S H,Ji M S,Dong Q,Wang H N. 2015. The resistance of Sagittaria trifolia populations in rice fields from Liaoning Province to bensulfuron-methyl[J]. Acta Phytophylacica Sinica,42(4):663-668.]
刘伟堂. 2015. 小麦田牛繁缕(Myosoton aquaticum L. Moench)对苯磺隆的抗性研究[D]. 泰安:山东农业大学. [Liu W T. 2015. Study on the resistance to tribenuron-methyl in water chickweed(Myosoton aquaticum L. Moench) in wheat fields[D]. Tai’an:Shandong Agricultural University.]
刘亚光,李敏,李威,朱金文,刘蓝坤,师慧. 2015. 黑龙江省萤蔺对苄嘧磺隆和吡嘧磺隆抗性测定[J]. 东北农业大学学报,46(10):29-36. [Liu Y G,Li M,Li W,Zhu J W,Liu L K,Shi H. 2015. Resistance identification of Scirpus juncoides Roxb to bensulfuronmethyl and pyrazosulfuron-ethyl in Heilongjiang Province[J]. Journal of Northeast Agricultural University,46(10):29-36.]
罗宝君. 2016. 黑龙江省西部地区水稻田恶性杂草的防除技术[J]. 农药,55(9): 692-695. [Luo B J. 2016. Study on malignant weed control technology in rice field of western regions of Heilongjiang Province[J]. Pesticides,55(9): 692-695.]
彭学岗,王金信,刘君良,杨纪辉. 2009. 麦田抗性生物型猪殃殃对苯磺隆的抗性机制[J]. 农药学学报,11(2):191-196. [Peng X G,Wang J X,Liu J L,Yang J H. 2009. Mechanism of resistance to tribenuron-methyl in a resistant biotype of Galium aparine[J].Chinese Journal of Pesticide Science,11(2):191-196.]
隋标峰,王金信,彭学岗,丁君,刘迎. 2007. 麦田不同杂草对苯磺隆敏感性差异的分子机制[J]. 植物保护学报,34(2):204-208. [Sui B F,Wang J X,Peng X G,Ding J,Liu Y. 2007. Molecular basis of sensitivity difference in wheat weeds to tribenuron-methyl[J]. Journal of Plant Protection,34(2):204-208.]
吳翠霞,马士仲,马冲,路兴涛,王金信. 2018. 山东省小麦田荠菜对苯磺隆的抗性测定[J]. 植物保护,44(1):170-173. [Wu C X,Ma S Z,Ma C,Lu X T,Wang J X. 2018.Resistant detection of Capsella bursa-pastoris to tribenuron-methyl in Shandong Province[J]. Plant Protection,44(1):170-173.]
吴明根,曹凤秋,刘亮. 2007. 磺酰脲类除草剂对抗、感性雨久花乙酰乳酸合成酶活性的影响[J]. 植物保护学报,34(5):545-548. [Wu M G,Cao F Q,Liu L. 2007. Effect of sulfonylurea herbicides on the acetolactate synthases activity between resistant and susceptive biotypes of Monochoria korsakowii[J]. Journal of Plant Protection,34(5):545-548.]
吴小虎,王金信,刘伟堂,郭鹤久,崔夕英,陈业兵. 2011. 山东省部分市县麦田杂草麦家公Lithospermum arvense对苯磺隆的抗药性[J]. 农药学学报,13(6):597-602.[Wu X H,Wang J X,Liu W T,Guo H J,Cui X Y,Chen Y B. 2011. Resistance of Lithospermum arvense to tribenuron-methyl in winter wheat fields in part of Shandong Pro-vince[J]. Chinese Journal of Pesticide Science,13(6):597-602.]
张朝贤,倪汉文,魏守辉,黄红娟,刘延,崔海兰,隋标峰,张猛,郭峰. 2009. 杂草抗药性研究进展[J]. 中国农业科学,42(4):1274-1289. [Zhang C X,Ni H W,Wei S H,Huang H J,Liu Y,Cui H L,Sui B F,Zhang M,Guo F. 2009. Current advances in research on herbicide resistance[J]. Scientia Agricultura Sinica,42(4):1274-1289.]
张玉池,刘琪,相世刚,强胜,宋小玲. 2018. 稻田杂草对草甘膦和草铵膦的敏感性差异[J]. 江苏农业学报,34(6):1260-1266. [Zhang Y C,Liu Q,Xiang S G,Qiang S,Song X L. 2018. Sensitivity difference of weeds in rice field to glyphosate and glufosinate[J]. Jiangsu Journal of Agricultural Sciences,34(6):1260-1266.]
张云月,卢宗志,李洪鑫,崔海兰. 2013. 杂草对乙酰乳酸合成酶抑制剂类除草剂抗药性的研究进展[J]. 杂草学报,31(2):1-5. [Zhang Y Y,Lu Z Z,Li H X,Cui H L. 2013. Research progress on weed resistance to acetolactate synthase inhibitors[J]. Weed Science,31(2):1-5.]
Bai S,Liu W T,Wang H Z,Zhao N,Jia S,Zou N,Guo W L,Wang J X. 2018. Enhanced herbicide metabolism and metabolic resistance genes identified in tribenuron-methyl resistant Myosoton aquaticum L.[J]. Journal of Agricultural and Food Chemistry,66(37):9850-9857.
Fu D N,Shafi J,Zhao B C,Li X W,Zhu H,Wei S H,Ji M S. 2017. Bensulfuron-methyl resistant Sagittaria trifolia L.multiple resistance,cross-resistance and molecular basis of resistance to acetolactate synthase-inhibiting herbicides[J]. Archives of Biological Sciences,69(4):649-658.
Ma R,Kaundun S S,Tranel P J,Riggins C W,McGinness D L,Hager A G,Hawkes T,Mc E,Riechers D E. 2013. Distinct detoxification mechanisms confer resistance to mesotrione and atrazine in a population of waterhemp[J]. Plant Physiology,163(1):363-377.
Pamela J H,David D. 1996. Glutathione transferase activities and herbicide selection in maize and associated weed species[J]. Pesticide Science,46:267-275.
Powles S B,Yu Q. 2010. Evolution in action: Plants resistant to herbicides[J]. Annual Review of Plant Biology,61(1):317-347.
Riechers D E,Kreuz K,Zhang Q. 2010. Detoxification without intoxication: Herbicide safeners activate plant defense gene expression[J]. Plant Physiology,153(1):3-13.
Sada Y,Ikeda H,Yamato S,Kizawa S. 2013. Characterization of sulfonylurea-resistant Schoenoplectus juncoides having a target-site Asp(376)Glu mutation in the acetolactate synthase[J]. Pesticide Biochemistry & Physiology,107(1):106-111.
Sada Y,Kizawa S,Ikeda H. 2012. Varied occurrence of diverse sulfonylurea-resistant biotypes of Schoenoplectus juncoides[Roxb.] Palla in Japan,as classified by an acetolactate synthase gene mutation[J]. Weed Biology & Management,12(4):168-176.
Uchino A,Ogata S,Kohara H,Yoshida S,Yoshioka T,Watanabe H. 2010. Molecular basis of diverse responses to ace-tolactate synthase-inhibiting herbicides in sulfonylurea-resistant biotypes of Schoenoplectus juncoides[J]. Weed Bio-logy & Management,7(2):89-96.
Yasushi Tanaka. 2003. Properties of acetolactate synthase from sulfonylurea-resistant Scirpus juncoides Roxb. var. ohwianus T. Koyama[J]. Pesticide Biochemistry & Physiology,77(3):147-153.
(責任编辑 麻小燕)
