半番鸭不同组织Cu/Zn-SOD基因表达及酶活性研究
2019-09-10郑嫩珠章琳俐李丽辛清武缪中纬朱志明黄一帆
郑嫩珠 章琳俐 李丽 辛清武 缪中纬 朱志明 黄一帆

摘 要:【目的】首次对半番鸭不同组织Cu/Zn-SOD基因表达、酶活性进行研究,以期了解半番鸭不同组织抗氧化特性,为深入研究半番鸭对环境因子的响应能力及相关分子机制提供参考。【方法】通过实时荧光定量法、黄嘌呤氧化酶法和硫代巴比妥酸法分别测定了半番鸭心脏、肝脏、脾脏、肺脏、肾脏、肌胃和胸肌中的Cu/Zn-SOD mRNA相对表达量、酶活力和MDA含量。【结果】 Cu/Zn-SOD mRNA在胸肌中相对表达量最高,总体趋势为胸肌>肝脏>肺>心脏>脾脏>肾脏/肌胃。酶活力测定结果显示,肝脏和肾脏Cu/Zn-SOD酶活力显著高于胸肌和肌胃。半番鸭胸肌MDA含量显著高于肝脏、肌胃和肾脏,提示胸肌可能更易受到氧化应激损伤。相关分析结果显示Cu/Zn-SOD活力与MDA含量呈显著负相关,而抗氧化酶活力与mRNA表达水平相关性不显著。【结论】半番鸭Cu/Zn-SOD基因表达和酶活力具有组织特异性。不同组织Cu/Zn-SOD活力差异可能与Cu/Zn-SOD自身的生理功能以及组织代谢水平有关。
关键词:Cu/Zn-SOD; mRNA表达; 酶活力; 半番鸭
中图分类号:X 131;X 53文献标识码:A文章编号:1008-0384(2019)08-933-06
Abstract:【Objective】 Expressions of Cu/Zn-SOD gene and activities of the antioxidant enzyme in various organs of mule ducks were determined. 【Method】 The gene expression in the heart, liver, spleen, lung, kidney, gizzard and chest muscles,antioxidant enzyme activities,and MDA contents of mule duck were determined by the qRT-PCR, xanthine-xanthine oxidase, and thiobarbituric acid methods. 【Result】 The greatest mRNA expression of Cu/Zn-SOD gene was found in the chest muscle followed by the tissues in the order of liver>lung> heart>spleen>gizzard/kidney of the ducks. The activities of Cu/Zn-SOD enzyme in the liver and kidney were significantly higher than those in the breasts and gizzard. The higher MDA content in the breasts than in the liver, gizzard or kidney indicated a greater susceptibility of the chest muscle to damage by oxidative stress. There was no significant correlation observed between the antioxidant enzyme activity and the mRNA expression level in different organs. However, the Cu/Zn-SOD enzyme activity was inversely correlated to MDA content in the tissues. 【Conclusion】 The Cu/Zn-SOD mRNA expression and enzyme activity were organ-specific. The differences in the enzymatic activities might stem from the diverse physiological functions of the enzymes and/or the tissue metabolism per se.
Key words:Cu/Zn-SOD; mRNA expression; enzyme activity; mule duck
0 引言
【研究意義】动物机体有氧代谢过程中不断产生自由基和其他活性氧。正常生理条件下,机体能通过抗氧化系统清除自由基。抗氧化系统失衡或异常将导致自由基过度累积,引起脂质过氧化、DNA损伤、酶失活等氧化损伤[1]。畜禽生产中抗氧化系统失衡可表现为畜禽对运输或运动过程的应激易感,使宰后组织氧化损伤、肉质下降,甚至病理损伤[2]。越来越多的证据显示,家禽生产中的许多应激都与氧化应激有关[3]。禽类疾病如鸡肾病、肉鸡腹水综合征、鸭病毒性肝炎发生过程中由于自由基清除系统失代偿或衰竭使细胞内累积过量自由基,导致细胞膜损伤和细胞成分的改变,引起病理性损伤[4-6]。了解组织抗氧化特性及相关基因表达的分子机制,对于研究如何减少家禽生产中各种应激的负面影响具有重要意义。【前人研究进展】抗氧化酶是抗氧化系统重要组成成员之一,是清除自由基和活性氧的第一道防线,其中超氧化物歧化酶(SOD)是抗氧化酶类中的重要成员[7],可快速歧化活性氧(·O-2),使其转化为过氧化氢和分子氧,从而特异性清除活性氧(·O-2) [8-9]。丙二醛(MDA)是自由基攻击生物膜中多不饱和脂肪酸引发脂质过氧化作用而形成,其含量可反映自由基的产生情况和器官组织中脂质过氧化的程度[10]。研究报道显示不同物种和组织间SOD的活性和基因表达水平不同 [11-12]。Surai等[13]报道鸡胚胎时期不同组织SOD活性变化趋势不同,新生雏鸡不同组织间酶活性也存在差异。【本研究切入点】目前对于动物抗氧化酶的研究多集中于哺乳动物以及禽类中的鸡,关于鸭抗氧化酶的研究较少。半番鸭是继北京鸭、番鸭后极具发展潜力的肉用鸭,是水禽肉用品种改良研究的热点之一,具有瘦肉率高、脂肪少、耐粗饲、抗病力强等特点,也是生产肥肝和羽毛的重要来源[14]。半番鸭产业的发展速度虽然很快,但阐述其各性状发展的资料还很少 [15-16],针对抗氧化酶在半番鸭各组织器官的分布和活性的研究未见报道。【拟解决的关键问题】因此,本研究通过测定半番鸭不同组织抗氧化酶基因表达、酶活力及丙二醛含量,探索半番鸭不同组织抗氧化特性,从而为半番鸭对环境因子(如应激)响应能力的研究提供理论参考,在科研和生产上都具有一定生物学意义。
1 材料与方法
1.1 试验动物与样品采集
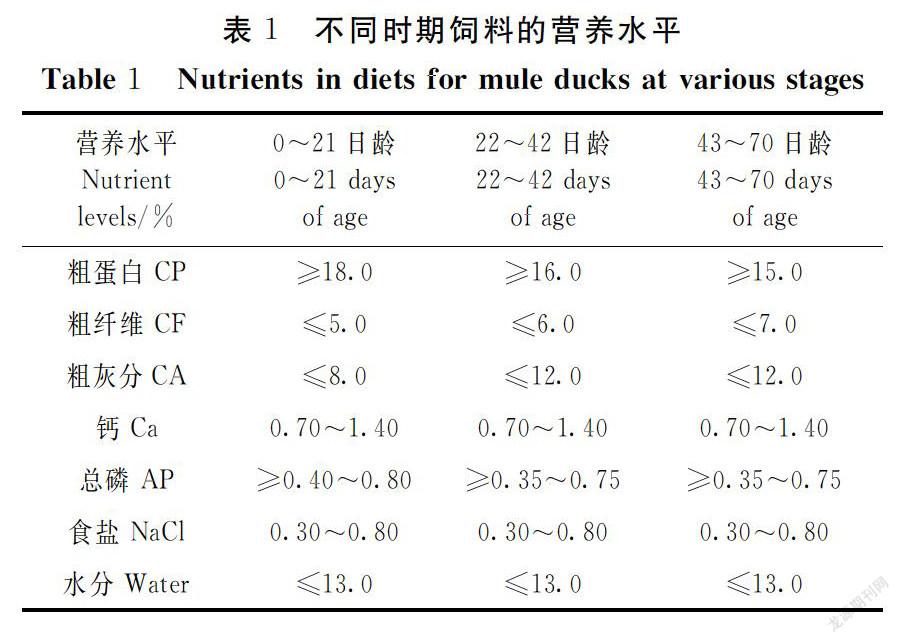
试验鸭饲养于福建省农业科学院畜牧兽医研究所动物养殖试验场。鸭饲养管理条件一致,自由采食,自由饮水,按常规操作程序对试验鸭进行管理。饲料由福建华龙集团饲料有限公司提供,不同生长时期的饲料营养水平见表1。70日龄时,随机选取5只同批次健康的半番鸭(体重约3 kg),颈动脉放血处死后,采集其组织样品(心脏、肝脏、脾脏、肺脏、肾脏、肌胃和胸肌),立即投入液氮中,-80℃保存备用。
1.2 总RNA提取和反转录
采用Trizol法提取组织总RNA,超微量紫外分光光度计(Thermo Scientific, 美国)检测RNA含量、纯度及质量,并调整总RNA浓度至1 μg·μL-1;利用Super ScriptTM III First-Strand Synthesis Super反转试剂盒(Invitrogen, 美国)将其反转录成cDNA,置于-80℃保存备用。
1.3 抗氧化酶基因的表达分析
根据GenBank已公布的鸭Cu/Zn-SOD(SOD1)和β-actin基因序列,应用Primer Premier 6.0和Beacon designer 7.8软件设计引物,生工生物工程(上海)股份有限公司合成,引物序列见表2。以β-actin基因为内参,CFX384多重实时荧光定量PCR仪(Bio-Rad, 美国)检测半番鸭各组织Cu/Zn-SOD mRNA表达情况,每个样品重复3次。反应体系(20 μL): Power SYBR Green Master Mix 10 μL(Applied Biosystems,美国)、SDW 8.0 μL、1 μg·μL-1 cDNA 1.0 μL、10 μmol·L-1 PCR-F 0.5 μL、10 μmol·L-1 PCR-R 0.5 μL和ddH2O 10.5 μL。反应条件:95℃ 1 min,95℃15 s,63℃ 25 s,40个循环;熔解曲线分析 55~95℃。通过熔解曲线判断定量PCR的特异性。采用2-ΔΔCt值方法计算mRNA相对表达量。
1.4 抗氧化酶活力及MDA含量测定
超氧化物歧化酶(Cu/Zn-SOD)和丙二醛(MDA)测定试剂盒和考马斯亮蓝蛋白测定试剂盒均购于南京建成生物工程研究所。样品用0.86%生理盐水制成10%的组织匀浆液,离心取上清,测定蛋白浓度后,应用相应试剂盒和ELX800通用酶标仪(BIO-TEK Instruments Inc, 美国)测定Cu/Zn-SOD活力和MDA含量,操作步骤按照试剂说明书进行。Cu/Zn-SOD采用黄嘌呤氧化酶法测定。丙二醛含量采用硫代巴比妥酸法(Thibabituric Acid, TBA)测定。
1.5 数据分析方法
采用SPSS 17.0软件对不同组织Cu/Zn-SOD mRNA相对表达量、酶活力和MDA含量进行描述性数据、多重比较、显著性检验及相关性分析。
2 结果与分析
2.1 半番鸭Cu/Zn-SOD基因的qRT-PCR检测
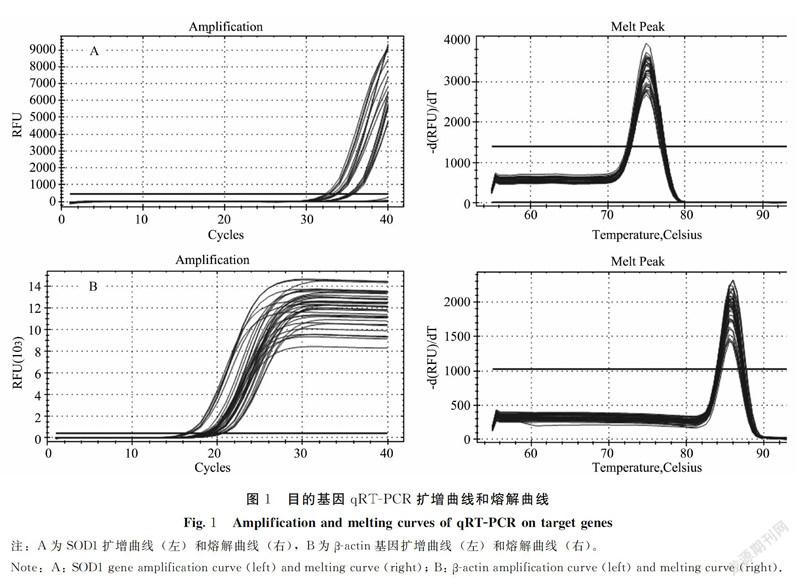
由图1可知,β-actin和目的基因的扩增曲线均呈 “S” 形,基线平缓并且未呈现明显的上扬趋势,表明各基因的动力学曲线整体平行性较好。各基因熔解曲线存在一个明显的單峰,表明扩增产物单一,荧光强度均来自特异性扩增产物,未见有引物二聚体和非特异性扩增产物产生。
2.2 Cu/Zn-SOD基因组织表达特点
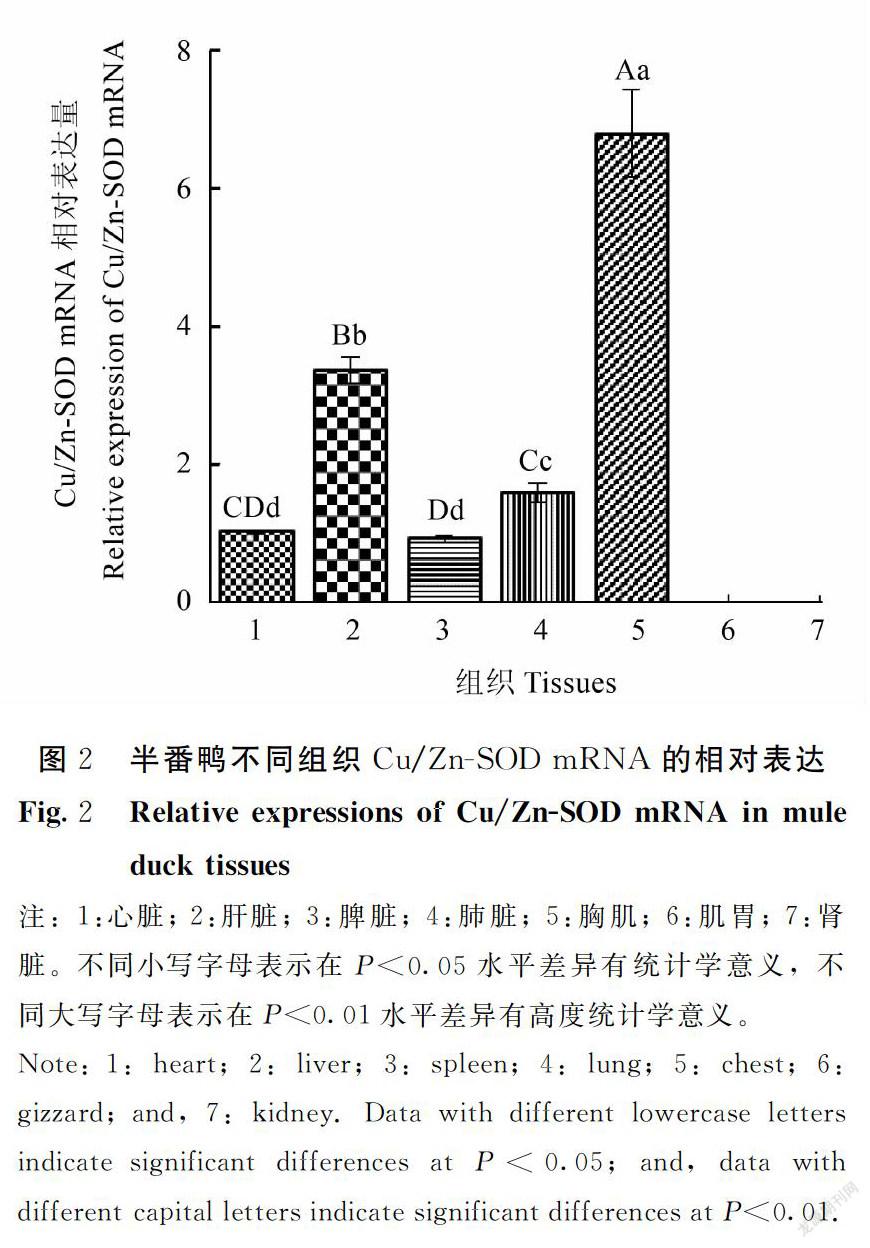
qRT-PCR结果显示(图2),Cu/Zn-SOD mRNA在心脏、肝脏、脾脏、肺脏和胸肌5种组织中有表达,肾脏和肌胃无表达或者表达量极低,不同组织间表达差异明显。其中胸肌表达量最高,其他组织间差异达到极显著水平(P<0.01), 总体趋势: 胸肌>肝脏>肺脏>心脏>脾脏>肾脏/肌胃。
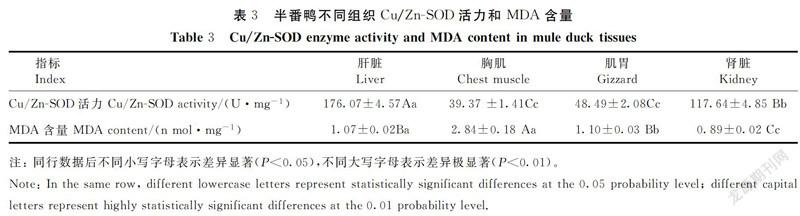
2.3 半番鸭组织Cu/Zn-SOD活力与MDA含量
选取肝脏、胸肌、肾脏、肌胃,检测Cu/Zn-SOD活力和MDA含量。由表3可知,不同组织间Cu/Zn-SOD酶活力明显不同,肝脏和肾脏Cu/Zn-SOD酶活力显著高于胸肌和肌胃(P<0.01),肝脏的Cu/Zn-SOD酶活力约为胸肌的4.5倍;胸肌和肌胃间差异不显著。总体情况为:肝脏>肾脏>肌胃>胸肌。MDA含量在胸肌中最高,肝脏、肌胃次之,肾脏最低。MDA含量胸肌极显著高于其他组织(P<0.01),肝脏MDA含量与肌胃间差异不显著,肾脏含量最低。2.4 Cu/Zn-SOD活力与mRNA表达量、MDA含量的相关性分析
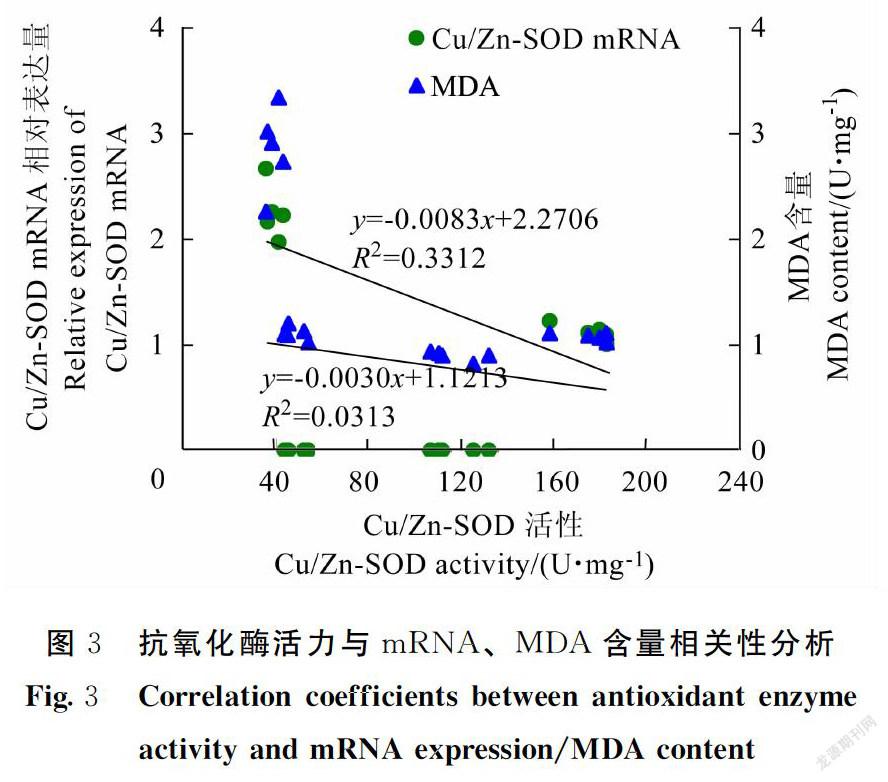
利用SPSS17.0软件对各组织抗氧化酶活力与mRNA表达、MDA含量进行相关性分析,结果显示,在半番鸭4个组织中,抗氧化酶活力与mRNA表达水平无显著相关;Cu/Zn-SOD活力与MDA含量呈显著负相关(P<0.05)(图3)。
3 讨 论
超氧化物歧化酶(Superoxide dismutase, SOD)是清除生物体内超氧阴离子自由基的抗氧化酶,在机体抗氧化系统中起到至关重要的作用。大量研究表明,自由基、活性氧增加或抗氧化物能力下降与基因表达的改变密切相关[17-18]。Cu/Zn-SOD是SOD家族中第一个被发现也是分布最广泛的一种,活性中心包含铜离子和锌离子,其基因序列和结构从原核生物到真核生物高度保守,但基因表达在不同物种和组织间不同。本研究中半番鸭Cu/Zn-SOD mRNA在多数器官表达,在胸肌中表达最高,这与Xu等[19]在猪上的报道相似;另有报道哺乳动物Cu/Zn-SOD mRNA在肝脏和肾脏高表达,如豚鼠Cu/Zn-SOD mRNA表达由强至弱顺序为: 肝>肾>肺 >脾>心[20-21]。
半番鴨不同组织的酶活力呈现出一定差异,肝脏和肾脏Cu/Zn-SOD活力高于胸肌和肌胃,这与朱子玉等[22]在丝毛乌骨鸡和北京油鸡上的报道类似;Marklund[23] 对猪、牛、羊等动物研究也显示肝脏和肾脏等代谢活跃的器官Cu/Zn-SOD活力较高,其他组织具有相似的中等酶活力。不同组织酶活力的差异可能与Cu/Zn-SOD自身的生理功能以及组织代谢水平有关。肝脏是动物物质、能量代谢的重要器官,也是体内重要的解毒器官,对动物生长起着重要作用,可产生大量活性氧自由基,需要较强的抗氧化能力加以清除,防止过量活性氧自由基损害肝脏。肾脏是禽类重要排泄器官,也具有较高的生理代谢水平。本研究中半番鸭Cu/Zn-SOD活力与mRNA表达水平并不完全一致,并且两者相关性不显著,可能由于抗氧化酶基因表达可受转录后调控影响[24],而抗氧化酶活力会受底物水平、营养等因素影响,因此抗氧化酶mRNA表达水平和其活力未呈现简单的相关性[19-20]。
半番鸭MDA含量与SOD 活力之间存在显著负相关,与Zhang等[25]在鸡上的报道类似,SOD活力的减少伴随MDA含量增加。半番鸭胸肌MDA含量显著高于肝脏、肌胃和肾脏,提示胸肌可能更易受到氧化应激损伤。在养殖和运输过程中应更注意减少应激,降低其对肉品质的影响。
参考文献:
[1]HPPI P S. The role of oxygen in health and disease-a series of reviews[J]. Pediatric Research, 2009, 65 (3): 261-268.
[2]FELLENBERG M, SPEISKY H. Antioxidants: their effects on broiler oxidative stress and its meat oxidative stability[J]. World's Poultry Science Journal, 2006, 62 (1): 53-70.
[3]SURAI P F. Antioxidant systems in poultry biology: superoxide dismutase[J]. Journal of Animal Research and Nutrition, 2016, 1 (1): 8.
[4]SURAI P. The relevance of the antioxidant system to the health and growth of the developing chick[J]. Australian Poultry Science Symposium, 2001: 126-134.
[5]郑明学, 韩克光, 高建广. 自由基在鸡肾病发生中的作用研究[J]. 农业生物技术学报, 2000, 8 (2): 176.
ZHENG M X, HAN K G, GAO J G. Effects of Free Radical in Pathogenesis of NePhrosis in Chicken[J]. Journal of Agricultural Biotechnology, 2000, 8 (2): 176.(in Chinese)
[6]XIONG W, CHEN Y, WANG Y, et al. Roles of the antioxidant properties of icariin and its phosphorylated derivative in the protection against duck virus hepatitis[J]. BMC Veterinary Research, 2014, 10 (1): 226.
[7]HALLIWELL B. Free radicals and antioxidants: updating a personal view[J]. Nutrition Reviews, 2012, 70 (5): 257-265.
[8]FANTEL A G. Reactive oxygen species in developmental toxicity: review and hypothesis[J]. Teratology, 1996, 53 (3): 196-217.
[9]JAESCHKE H. Mechanisms of oxidant stress-induced acute tissue injury[J]. Proceedings of the Society for Experimental Biology and Medicine, 1995, 209 (2): 104-111.
[10]GL, BELGE-KURUTA E, YILDIZ E, et al. Pollution correlated modifications of liver antioxidant systems and histopathology of fish (Cyprinidae) living in Seyhan Dam Lake, Turkey[J]. Environment International, 2004, 30 (5): 605-609.
[11]TAPPEL M E, CHAUDIERE J, TAPPEL A L. Glutathione peroxidase activities of animal tissues[J]. Comparative Biochemistry and Physiology B, Comparative Biochemistry, 1982, 73 (4): 945-949.
[12]DAUN C, KESSON B. Glutathione peroxidase activity, and content of total and soluble selenium in five bovine and porcine organs used in meat production[J]. Meat Science, 2004, 66 (4): 801-807.
[13]SURAI P F, SPEAKE B K, NOBLE R C, et al. Tissue-specific antioxidant profiles and susceptibility to lipid peroxidation of the newly hatched chick[J]. Biological Trace Element Research, 1999, 68 (1): 63-78.
[14]孙淑霞, 倪玉平, 张连江, 等. 半番鸭的养殖现状及发展前景[J]. 畜牧与饲料科学, 2015 (10): 113-115.
SUN S X, NI Y P, ZHANG L J, et al. Current situation and developing prospect of of mule duck[J]. Animal Husbandry and Feed Science, 2015 (10): 113-115.(in Chinese)
[15]郑嫩珠, 李丽, 辛清武, 等. 酵母硒, 黄芪多糖及其复合剂对半番鸭生长性能、肉品质和抗氧化能力的影响[J]. 动物营养学报, 2016, 28 (12): 3856-3866.
ZHENG N Z, LI L, XIN Q W, et al. Effects of selenium yeast, Astragalus polysaccharide and their compound on growth performance, meat quality and antioxidant ability of mule ducks[J]. Chinese Journal of Animal Nutrition, 2016, 28 (12): 3856-3866.(in Chinese)
[16]李丽, 缪中纬, 辛清武, 等. 酵母硒和黄芪多糖对半番鸭屠宰性能, 血清生化及抗氧化指标的影响[J]. 浙江大学学报 (农业与生命科学版), 2016, 43 (4): 502-510.
LI L, MIAO Z W, XIN Q W, et al. Effects of selenium-enriched yeast and astragalus polysaccharide on slaughter performance, serum biochemical and antioxidant indexes of mule duck[J]. Journal of Zhejiang University (Agriculture and Life Sciences), 2016, 43 (4): 502-510.(in Chinese)
[17]BAEK I J, SEO D S, YON J M, et al. Tissue expression and cellular localization of phospholipid hydroperoxide glutathione peroxidase (PHG-Px) mRNA in male mice[J]. Journal of Molecular Histology, 2007, 38 (3): 237-244.
[18]RHEE S G. Redox signaling: hydrogen peroxide as intracellular messenger[J]. Experimental & molecular medicine, 1999, 31 (2): 53.
[19]XU C, WANG Y, GUO J, et al. Comparison of age-related differences in expression of antioxidant enzyme mRNA and activity in various tissues of pigs[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 147 (3): 445-451.
[20]YUAN H T, BINGLE C D, KELLY F J. Differential patterns of antioxidant enzyme mRNA expression in guinea pig lung and liver during development[J]. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 1996, 1305 (3): 163-171.
[21]CULOTTA V C, YANG M, O′HALLORAN T V. Activation of superoxide dismutases: putting the metal to the pedal[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2006, 1763 (7): 747-758.
[22]朱子玉, 曹广力, 朱越雄, 等. 丝毛乌骨鸡和北京油鸡超氧化物岐化酶活性比较研究[J]. 中国畜牧杂志, 2000, 36 (6): 3-4.
ZHU Z Y, CAO G L, ZHU Y X, et al. Coimparison of superoxide dismutase activity in silkies and beijing fatty chickens[J]. Chinese Journal of Animal Science, 2000, 36 (6): 3-4.(in Chinese)
[23]MARKLUND S L. Extracellular superoxide dismutase and other superoxide dismutase isoenzymes in tissues from nine mammalian species[J]. Biochemical Journal, 1984, 222 (3): 649-655.
[24]LEI X G, ROSS D A, RONEKER K R. Comparison of age-related differences in expression of phospholipid hydroperoxide glutathione peroxidase mRNA and activity in various tissues of pigs[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1997, 117 (1): 109-114.
[25]ZHANG W, JIANG Y, ZHU Q, et al. Sodium butyrate maintains growth performance by regulating the immune response in broiler chickens[J]. British Poultry Science, 2011, 52 (3): 292-301.
(責任编辑:张 梅)
