基于化学、体内过程和代谢组学的甘草 解毒作用研究概况
2019-09-10王志琪张序晴王尚尧陈燕盈彭兰李赛曾嵘
王志琪 张序晴 王尚尧 陈燕盈 彭兰 李赛 曾嵘
〔摘要〕 甘草是一味可以解百毒、调和诸药的中药。通过研究甘草对有毒中药/毒性成分及其体内变化过程的影响和甘草对生物体内小分子代谢物的作用来探索其配伍减毒的机制,有助于更好地认识甘草与有毒中药/毒性成分的配伍规律。主要从化学、药动学和代谢组学3个方面介绍了甘草减缓有毒中药/毒性成分的作用及相关机制。
〔关键词〕 甘草;化学;超分子化学;体内过程;代谢组学;解毒;减毒
〔中图分类号〕R28 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.01.030
An Overview of Licorice Detoxification Research Based on Chemistry,
Pharmacokinetics, and Metabolomics
WANG Zhiqi1, ZHANG Xuqing2, WANG Shangyao1, CHEN Yanying1, PENG Lan2, LI Sai2, ZENG Rong1
(1. School of Pharmacy, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China;
2. Graduate School, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Licorice is a Chinese medicine which has the effects of reconciling various medicines and resolving hundreds of toxins. Its mechanism of compatibility and attenuation is explored by studying the effects of licorice on toxic Chinese medicines/components and their changing process in vivo and on small molecule metabolites in vivo, so as to better understand the laws of compatibility of licorice with other toxic Chinese medicines/components. In this paper, the effects of licorice on toxic Chinese medicines/components and related mechanisms are introduced from three aspects: chemistry, pharmacokinetics, and metabolomics.
〔Keywords〕 licorice; chemistry; supramolecular chemistry; process; in vivo; metabolomics
《中华人民共和国药典》中记载甘草(Glycyrrhizae Radix)是来源于“豆科植物甘草(Glycyrrhiza uralensis Fisch.)、胀果甘草(Glycyrrhiza inflata Bat).或光果甘草(Glycyrrhiza glabra L.)的干燥根和根茎”。其性甘、味平,具有“补脾益气,淸热解毒,祛痰止咳,缓急止痛,调和诸药”等功效[1]。甘草在各类方剂中使用频次高,素有“十方九草”之说。本文主要总结了近年来甘草与毒性中药/毒性成分之间的经典化学反应和超分子化学研究,及其对毒性中药/毒性成分体内过程的影响和代谢组学的研究。
1 甘草以化学为基础的解毒作用
已有的甘草解毒作用研究常与其化学成分密切关联。甘草的主要化学成分有黄酮类(如,甘草素、甘草苷等)、三萜类(如,甘草酸、甘草次酸等)、生物碱和多糖[2]。一般认为,甘草与有毒中药配伍时其所含的甘草酸发生的酸碱中和反应及其水解产物与毒物发生的结合反应是常见的解毒反应。有研究发现甘草中的甘草酸可与马钱子中的生物碱发生化学反应生成沉淀,以此降低生物碱的含量而解毒[3]。甘草酸在肝脏中分解可生成葡萄糖醛酸和甘草次酸,其中葡萄糖醛酸能与体内含有羰基或羧基的毒性成分等结合,形成低毒或无毒的化合物由尿排出,从而达到解毒的效果[4]。
两种或多种化学物质之间的相互作用,除经典分子化学方式外,即原子之间以化学键相互作用,还可通过非化学键相互作用。研究分子間通过非化学键相互作用而生成的分子聚集体的化学被称为超分子化学,1987年,3位化学家因在超分子化学上的成就获得了当年的诺贝尔化学奖[5]。超分子化学被认为能模仿自然界已存在物质的许多结合方式及特殊功能,其研究包括主客体化学、分子识别化学和自组装化学3种类型或研究阶段[6]。其中,主客体化学又称为大环化学,研究的是主体洞穴(即大环,如药物载体)包裹客体(即小分子,如药物)的超分子化学。
甘草次酸一直被认为是甘草的主要解毒成分之一,而早在1991年研究者就发现肝脏中有甘草次酸的特异性结合蛋白[5]。从经典化学的角度看,这很可能正是甘草次酸与肝脏中某种蛋白质之间易于形成化学键。另一方面,大环化学的研究发现将甘草次酸(客体小分子)包裹于硫酸壳聚糖纳米颗粒(主体大分子)内,则其肝靶向作用更加快速而显著[7];无独有偶,实验中发现以甘草次酸-聚乙二醇-聚乳酸-乙醇酸共聚物为大分子洞穴(主体)装载穿心莲内酯(客体)后,该胶束不仅在肝脏中保留时间更长,还具有更好的肿瘤治疗效果[8]。上述研究从经典化学和超分子化学的不同视角证明甘草次酸的解毒活性与其趋肝性相关。
自组装化学也属于超分子化学,其中蛋白质分子自组装是指特定蛋白结构单元(即蛋白质亚基)之间因结构互补和对称驱动的正确方向自发形成有序结构的行为[9]。甘草中的甘草蛋白可通过自组装形成稳定的颗粒。那么甘草解毒作用与这种现象又是否有关呢?Ke等[10]在研究甘草与乌头配伍时证实:甘草蛋白通过自组装形成的纳米颗粒可与乌头碱结合,注射甘草蛋白-乌头碱纳米颗粒和甘草-乌头合煎液的小鼠均出现轻度停药后可缓解的不良反应,无死亡;而注射乌头碱或乌头单煎液可使小鼠发生严重的毒性反应并全部死亡。该实验结果提示甘草的解毒作用可能与甘草蛋白自组装有关。
2 甘草与体内过程相关的解毒作用
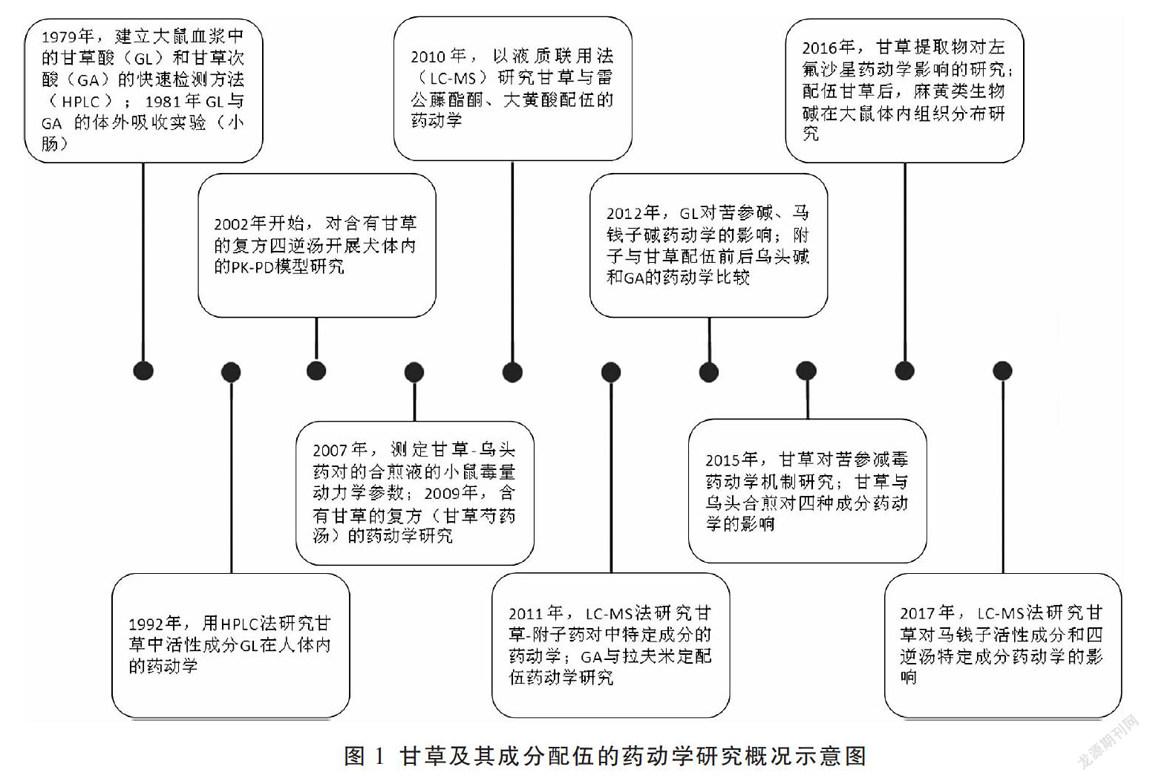
中药药动学是指在中医药理论的指导下,运用数学原理与方法,定量地对中药(组分、有效部位、单味药或复方)在机体内的动态变化过程及其规律进行描述。中药的体内过程是中药药动学研究的主要内容之一,而中药复杂体系的特征决定了中药体内过程研究也是中藥药动学研究的难点。早期的中药药动学研究主要采用生物效应法,而为获得药物浓度-时间数据通常需要测定药物浓度,特别是血药浓度,目前中药药动学研究的热点是构建复方药动学-药效学(PK-PD)结合模型。甘草药动学的研究始于20世纪70年代,甘草药动学研究概况见图1,其中包含了甘草及其配伍药物的药动学研究[11-27]。从图1可见,在开展甘草相关的药动学研究近40年以来,其研究方法上以血药浓度法为主,定量指标多选择生物样本中的药物活性/毒性成分/成分群,分离检测则一般应用各类色谱技术,药-时数据解析上以房室模型拟合为多。
2.1 配伍甘草对有毒成分体内过程的影响
在药动学的研究中,一般将机体对药物的作用分为吸收、分布、代谢、排泄4种类型,药动学参数可直观反映药物体内动态变化规律。其中房室模型药动学参数达峰时间(Tmax)、峰浓度(Cmax)和曲线下面积(AUC)主要反映药物的吸收、分布情况;半衰期(t1/2)和清除率(CL)主要反映药物的代谢、排泄情况。从已有的实验结果看,甘草对中药毒性成分的主要药动学参数的基本影响为增大Tmax和CL,减小Cmax、AUC和t1/2,即甘草可延缓毒物的吸收和分布,加快其代谢和排泄。
2.1.1 甘草对有毒成分吸收、分布的影响 实验结果表明甘草可以通过抑制有毒成分在体内的吸收和分布而产生减毒效果。如大鼠体内药动学影响的研究显示,甘草可使士的宁的Tmax延长,AUC和Cmax降低,并降低马钱子碱的Cmax[28];配伍甘草可使附子中的乌头碱在大鼠体内的Tmax延迟,Cmax降低[21]。也有研究发现附子与甘草配伍在延迟次乌头碱在大鼠体内Tmax的同时增大其吸收量[18]。研究者们推测甘草的解毒作用可能与延缓了乌头碱的吸收有关,而甘草所含的皂苷类成分的表面活性作用则可能与次乌头碱的吸收增加有关。
2.1.2 甘草对有毒成分排泄、代谢的影响 研究显示甘草可加快有毒成分在体内的代谢和排泄,降低其在体内的蓄积,从而发挥减毒作用。有实验发现附子配伍甘草后,乌头碱在大鼠体内的t1/2缩短,提示乌头碱消除增快[21];有研究者认为甘草可能通过促进雷公藤内酯在体内的代谢和排泄以及降低组织药物浓度而缓解雷公藤的毒性[16];韩刚等[17]证实甘草与大黄配伍后可以加快大黄酸的代谢;卫平等[25]的实验结果显示,甘草与麻黄配伍可以不同程度地加快麻黄类生物碱成分在不同组织和器官中的消除。
2.2 甘草解毒作用与Caco-2细胞P-糖蛋白
Caco-2细胞模型是研究药物吸收的经典体外模型和重要工具[29],而细胞膜的P-糖蛋白(P-gp,即ABCB1)在外源性物质的清除中起主要作用[30]。配伍甘草减毒的作用环节之一可能是甘草调控Caco-2细胞P-gp功能与表达以延缓或减少有毒中药/毒性成分的吸收。研究表明甘草提取物及甘草甜素、甘草次酸和甘草苷均能增强Caco-2的P-gp的功能和表达[31-32];叶敏通过Caco-2细胞模型实验证实甘草苷不仅能够显著抑制马钱子碱的转运,还能增强P-gp对次乌头碱的外排作用[33]。
2.3 甘草影响细胞色素P450以解毒
由I相代谢和II相代谢组成的生物转化是药物体内过程的重要环节,细胞色素P450(CYP450)是催化I相氧化反应的主要酶系统,约占药酶的75%[34]。在体内参与药物代谢的CYP450主要为CYP1、CYP2、CYP3家族中的7种亚型,其中CYP3家族是药物代谢的主要酶[35]。甘草对CYP酶的诱导或抑制作用可能是解毒作用的一个重要环节。
研究发现甘草对吸烟者有减毒作用。因为长期饮用甘草饮料可诱导CYP450,从而通过加速机体对烟草中尼古丁的代谢;而在甘草的作用下尼古丁更多地转化为可替宁及尼古丁氮氧化物,这些亲水型的代谢产物也更易于排泄,从而解毒[36];刘星雨[37]的实验结果证明,甘草水提物可以通过诱导CYP3A4发挥对雷公藤内酯醇的解毒作用;邢盼盼等[38]的研究表明,甘草对马钱子解毒的重要机制可能是甘草次酸抑制CYP2E1和CYP1A2,以及甘草所含的甘草苷可拮抗马钱子碱诱导的CYP450酶异常变化。实验研究还显示,甘草及其不同活性成分对CYP450不同亚型作用不完全一致。如甘草酸可以抑制CYP2E1和CYP1A2,诱导CYP3A4[39];甘草次酸可以抑制CYP2C19[39]、CYP2E1[40]和CYP3A4[41],诱导CYP1A2[42]。
甘草影响细胞色素P450的机制可能是与羟化反应有关。早期发现CYP450可催化甘草次酸C-22α和C-24位置上的羟化反应[43],近期的实验结果间接证明甘草次酸可以抑制CYP3A4和CYP2C19介导的羟化作用[39]。
2.4 甘草誘导II相药物代谢酶以解毒
甘草的解毒作用可能还与诱导II相代谢反应酶从而加速毒物/有毒成分的代谢有关。相对于I相代谢,因药物II相代谢产物通常水溶性更高,故药物II相代谢往往被认为更具有解毒作用。尿苷二磷酸葡萄糖醛酸转移酶(UGT)催化的葡萄糖醛酸结合反应被认为是肝脏中的主要解毒过程,甘草中的甘草素则具有诱导UGT以及结合肝中葡萄糖醛酸的能力[44-45];甘草中提取的脱氢脂肪酶C可诱导多种II相酶以解毒[46]。有研究发现Nrf2/ARE信号通路介导了甘草对II相代谢酶和III相转运体的作用,故甘草诱导II相解毒酶的机制可能与Nrf2通路有关[47-48]。
3 甘草解毒的代谢组学研究
代谢组学是一种表征和量化生物体内小分子代谢物的方法,能整体、动态地观察机体的代谢反应,该方法符合中药多成分、多靶点的特点,与中药作用的整体性相辅相成,近几年被广泛应用于配伍的研究[49]。
目前复方代谢组学的主要研究方法为对比配伍前后尿液中代谢物谱或(活性/毒性)生物标志物的变化,甘草能通过影响有毒中药/毒性成分的代谢组学达到解毒效果。2014年,研究者利用核磁共振波谱法进行了甘草次酸配伍新乌头碱的代谢组学研究,发现甘草次酸可缓解大鼠体内的由新乌头碱所引起的氨基酸代谢异常,而新乌头碱的毒性作用主要表现为干扰机体氨基酸的生物合成[50]。故该实验结果提示某些易于检测的氨基酸可作为衡量新乌头碱毒性(活性)大小的定量指标。一般认为,雷公藤中的雷公藤甲素和雷公藤内酯酮的毒性作用可能与其影响机体的色氨酸、泛酸及卟啉代谢有关。甘草提取物对雷公藤内酯酮所致毒性反应的代谢组学的干预作用实验研究发现:甘草的解毒作用主要表现为可调节色氨酸等的代谢及与雷公藤内酯酮毒性有关的4个毒性生物标志物水平[51]。
代谢组学研究表明甘草还可从缓解化学药物的不良反应,即甘草对化学药物的配伍减毒也具有极大的实用价值。如实验表明,甘草可以抑制脂肪酸代谢的逆转,减轻大剂量对乙酰氨基酚对肝脏的损害[52]。此外,代谢组学还可对甘草进行非靶点代谢分析[53],如通过化学计量方法(PCA,HCA)阐明其代谢物组成模式的主要差异,从而突出相应的分子标记,以便于后继的甘草配伍代谢组学研究。近年来DNA条码法在药物尤其是植物药的研究中得到了应用[54],因该方法与代谢组学在研究配伍解毒方面具有一致性和互补性,故,也可通过DNA条码来了解甘草的化学特性和代谢特性。
4 总结与展望
现有的临床实践和实验研究均证实甘草及其成分或制剂具有解毒作用,但甘草解毒作用机制尚待阐明,其与有毒药物剂量配比和减毒存效作用之间关系的科学内涵仍未完全明晰。定量研究甘草的解毒作用、机制和规律,既有助于阐明其缓和药性的理论基础,也可为其临床上的合理用药提供指导。
研究甘草解毒成分发现,甘草中的甘草酸、甘草次酸、甘草蛋白等与其解毒作用关系密切。因此,在甘草发挥解毒功效时,可考虑将这些解毒成分的含量作为评价其解毒的质量评价与控制指标。另一方面,甘草中的生物大分子甘草蛋白在加热的条件下可经自组装形成纳米颗粒,该颗粒的包埋特性与其解毒作用可能有关[55]。所以,也可从胶体和超分子化学的角度进一步探索甘草解毒机制。
目前,甘草配伍的药动学研究的主要思路是先应用色谱方法检测生物样本中的药物浓度,以此获得药物浓度-时间数据,再经数学模型拟合来测算药动学参数。随着PK-PD模型在药动学研究中的发展,今后的研究可以更多地将血药浓度法与生物效应法相结合,通过中药谱动学建立毒效成分的浓度-时间关系,通过中药谱效学建立解毒的效应-时间关系,并以此计算谱效动力学参数,从而实现对甘草与有毒中药配伍解毒的定量研究。还可通过探索生物标志物的浓度-时间关系,以揭示甘草与有毒中药配伍减毒存效/增效的定量规律。
代谢组学对中药的毒性评估和寻找解毒方法具有极其重要的意义,生物标志物的确定有助于明确代谢物组中代谢物的相互作用[56]。甘草配伍减毒的代谢组学研究显示该方法的应用仍存在着一些问题和挑战,如大多数分析只能定性分析而难以定量;代谢产物过于复杂,现有技术不能够全面地分析代谢产物等等[57]。
综上所述,在总结甘草临床配伍用药规律的基础上,借助现代色谱技术,应用代谢组学和化学计量学方法,是研究其配伍减毒定量规律的可行范式,这些研究将为甘草及相关制剂的研发、质量控制和合理使用提供依据。
参考文献
[1] 中华人民共和国药典委员会.中华人民共和国药典.一部[M].北京:中国医药科技出版社,2015:86-87.
[2] 郑雪峰,赵运峰.甘草化学成分及药理作用分析[J].中国保健营养,2017,27(10):328-329.
[3] 唐进法.马钱子配伍甘草前后汤液中生物碱含量变化[J].航空航天医药,2010,21(8):1529.
[4] 杨 明,刘小彬,黄庆德.附子甘草配伍减毒增效机理探析[J].时珍国医国药,2003,14(4):197-198.
[5] 张来新,陈 琦.植根深远的超分子化学[J].化工科技,2018,26(1):63-66.
[6] 贺福元,周逸群,邓凯文,等.超分子化学对中医药理论的特殊影响[J].中国中药杂志,2014,39(8):1534-1543.
[7] TIAN Q, WANG X H, WANG W, et al. Self-assembly and liver targeting of sulfated chitosan nanoparticles functionalized with glycyrrhetinic acid[J]. Nanomedicine Nanotechnology Biology & Medicine, 2012, 8(6):870-879.
[8] ZHANG J, ZHANG M, JI J, et al. Glycyrrhetinic acid-mediated polymeric drug delivery targeting the acidic microenvironment of hepatocellular carcinoma[J]. Pharmaceutical Research, 2015, 32(10):3376-3390.
[9] 何乃普,逯盛芳,赵伟刚,等.基于蛋白质分子自组装体系的构建[J].化学进展,2014,26(z1):303-309.
[10] KE L J, GAO G Z, SHEN Y, et al. Encapsulation of aconitine in self-assembled licorice protein nanoparticles reduces the toxicity in vivo[J]. Nanoscale Research Letters, 2015, 10(1):449.
[11] SAKIYA Y, AKADA Y, KAWANO S, et al. Rapid estimation of glycyrrhizin and glycyrrhetinic acid in plasma by high-speed liquid chromatography[J]. Chemical & Pharmaceutical Bulletin, 1979, 27(5):1125-1129.
[12] 孙成春.HPLC法测定健康志愿者甘草甜素的药动学特征[J].国外医学:药学分册,1993(4): 250-251.
[13] 李 锐,晏亦林,周莉玲,等.四逆汤的药动学研究[J].中成药,2002,24(10):777-780.
[14] 黄 洁,谭牛仔,贺龙刚,等.甘草与乌头液对小鼠乌头毒量药动学参数的影响[J].湖南中医药大学学报,2007,27(5):53-54.
[15] WANG W, WANG C, GU S, et al. Pharmacokinetic Studies of the Significance of Herbaceous Compatibility of Peony Liquorice Decoction[J]. World Science & Technology, 2009, 11(3):382-387.
[16] 張 锐,李 青,刘 芳,等.LC-MS/MS法研究甘草对雷公藤内酯酮药代动力学及组织分布与排泄的影响[J].药物分析杂志,2010,16(9):151-156.
[17] 韩 刚,康 欣,翟冠钰,等.甘草与大黄配伍对大黄酸在大鼠体内药动学的影响[J].中国实验方剂学杂志,2010,16(9):72-74.
[18] 章津铭,傅超美,秦素红,等.LC-MS/MS比较研究附子配伍甘草对大鼠体内次乌头碱药动学影响[J].世界科学技术-中医药现代化,2011,13(6):1048-1053.
[19] 李菊花,蔡文涛,陈 勇,等.拉米夫定与甘草次酸合用的大鼠药动学研究[J].湖北大学学报(自然科学版),2011,33(1):115-118.
[20] 漆林艳,黄 亮,杨宝春,等.甘草甜素对大鼠体内苦参碱药动学的影响[J].中国药房,2012,23(11):985-986.
[21] 王志琪,曾 嵘,谭志荣,等.附子与甘草配伍前后乌头碱和甘草次酸在大鼠体内的药动学比较[J].中成药,2012,34(12):2305-2309.
[22] SHI L, TANG X, DANG X, et al. Investigating herb-herb interactions: the potential attenuated toxicity mechanism of the combined use of Glycyrrhizae radix et rhizoma (Gancao) and Sophoraeflavescentis radix (Kushen)[J]. Journal of Ethnopharmacology, 2015, 165(4):243-250.
[23] ZHOU B, ZHANG J, WU S, et al. The influence of compatibility of processed radix AconitiKusnezoffii, on the pharmacokinetic of four components in Glycyrrhizauralensis, Fisch[J]. Journal of Ethnopharmacology, 2015, 169(8): 1-7.
[24] 杨 锐,李金良,王 斌,等.甘草提取物对左氧氟沙星在大鼠体内药动学及组织分布的影响[J].中国兽药杂志,2016,50(3):35-38.
[25] 卫 平,马钦海,任孟月,等.配伍对麻黄甘草药对中麻黄类生物碱在大鼠体内组织分布的影响[J].药学研究,2016,35(4):187-192.
[26] ZHANG M, DENG Y, WANG C, et al. AnLC–MS/MS method for determination of bioactive componentsof liquorice and Semen Strychni in rat plasma: Applicationto a pharmacokinetics study[J]. Drug Test Anal, 2018, 10(2): 262-271.
[27] SUN S, CHEN Q, GE J, et al. Pharmacokinetic interaction of aconitine, liquiritin and 6-gingerol in a traditional Chinese herbal formula, Sini Decoction[J]. Xenobiotica, 2018, 48(1):1-8.
[28] GU L, WANG X, LIU Z, et al. A study of Semen Strychni-induced renal injury and herb-herb interaction of Radix Glycyrrhizae extract and/or RhizomaLigustici extract on the comparative toxicokinetics of strychnine and brucine in rats[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2014, 68(4):226-233.
[29] 王 敏,齊 云.Caco-2细胞模型及其在药物吸收研究中的应用新进展[J].中国药学杂志,2007,42(16):1201-1204.
[30] VERHALEN B, DASTVAN R, THANGAPANDIAN S, et al. Energy transduction and alternating access of the mammalian ABC transporter P-glycoprotein[J]. Nature, 2017, 543(7647):738-741.
[31] 彭 燕,谭晓斌,贾晓斌.甘草黄酮类成分对Caco-2细胞P-糖蛋白功能和表达的影响[J].中草药,2013,44(19):2703-2709.
[32] 何 丹,颜 苗,李焕德,等.甘草提取物及其主要成分对Caco-2细胞膜上P-gp功能和表达的影响[J].中国药学杂志,2010,45(10):751-755.
[33] 叶 敏.马钱子碱、次乌头碱的体外吸收机制及其它们分别与甘草苷的转运相互作用研究[D].武汉:湖北大学,2012.
[34] GUENGERICH F P. Cytochrome p450 and chemical toxicology[J]. Chemical Research in Toxicology, 2008, 21(1):70-83.
[35] BROWN C M, REISFELD B, MAYENO A N. Cytochromes P450: a structure-based summary of biotransformations using representative substrates[J]. Drug Metabolism Reviews, 2008, 40(1):91-100.
[36] 徐 硕,徐文峰,金鹏飞,等.甘草对药物代谢酶以及化学药物体内代谢的影响[J].中南药学,2017,15(3):329-334.
[37] 刘星雨.甘草水提物对细胞色素P450酶主要亚型的表达影响及其对雷公藤内酯醇的减毒增效作用[D].镇江:江苏大学,2014.
[38] 邢盼盼,吴文华,杜 鹏,等.马钱子碱与甘草次酸、甘草苷配伍后对大鼠肝脏CYP450的影响[J].药学学报,2011,36(5):573-580.
[39] 涂江华.甘草酸对CYP450酶的影响及其机制研究[D].长沙:中南大学,2010.
[40] HYE G J, HO J Y, SUNG J P, et al. Hepatoprotective effects of 18β-glycyrrhe-dnicaeid on carbon tetrachloride-induced liver injury:inhibition of cyt-ochrome P4502E1 expression[J]. Pharnacological Research,2002, 46(3): 221-227.
[41] 熊月琴.甘草次酸对大鼠肝脏CYP450酶基因表达与蛋白活性的影响[D].武汉:湖北大学,2010.
[42] LI H Y, XU W, SU J, et al. In vitro and in vivo inhibitory effects of glycyrrhetinic acid on cytochrome P450 3A activity[J]. Pharmacology, 2010, 86(5/6):287-292.
[43] AKAO T, AKAO T, AOYAMA M, et al. Metabolism of glycyrrhetic acid by rat liver microsomes-III. Male-specific glycyrrhetinate
dehydrogenase[J]. Biochemical Pharmacology, 1990, 40(2):291.
[44] 郭建明,段金廒,郝海平,等.基于药物体内代谢过程的中药配伍禁忌研究思路与方法[J].中草药,2011,42(12):2373-2378.
[45] KIM Y W, KANG H E, LEE M G, et al. Liquiritigenin, a flavonoid aglycone from licorice, has a choleretic effect and the ability to induce hepatic transporters and phase-II enzymes[J].Am J Physiol Gastrointest Liver Physiol, 2009, 296(2):G372-G381.
[46] SEO J Y, LEE Y S, KIM H J, et al. Dehydroglyasperin C isolated from licorice caused Nrf2-mediated induction of detoxifying enzymes[J]. J Agric Food Chem, 2010, 58(3): 1603-1608.
[47] GONG H, LI H D, YAN M, et al. Effect of licorice on the induction of phase II metabolizing enzymes and phase III transporters and its possible mechanism[J]. Die Pharmazie, 2014, 69(12):894.
[48] GONG H, ZHANG B K, YAN M, et al. A protective mechanism of licorice (Glycyrrhizauralensis): isoliquiritigenin stimulates detoxification system via Nrf2 activation[J]. Journal of Ethnopharmacology, 2015, 162(24):134-139.
[49] SONG Q, ZHANG A, YAN G, et al. Technological advances in current metabolomics and its application in tradition Chinese medicine[J]. Rsc Advances, 2017,7(84):53516-53524.
[50] SUN B, ZHANG M, ZHANG Q, et al. Metabonomics study of the effects of pretreatment with glycyrrhetinic acid on mesaconitine-induced toxicity in rats[J]. Journal of Ethnopharmacology, 2014, 154(3):839-846.
[51] 劉建群,王 卓,徐金娣,等.甘草干预雷公藤内酯酮的代谢组学分析[J].中国实验方剂学杂志,2016,22(19):70-75.
[52] YU J, JIANG Y S, JIANG Y, et al. Targeted metabolomic study indicating glycyrrhizin’s protection against acetaminophen-induced liver damage through reversing fatty acid metabolism[J]. Phytotherapy Research, 2014, 28(6):933-936.
[53] RIZZATO G, SCALABRIN E, RADAELLI M, et al. A new exploration of licorice metabolome[J]. Food Chemistry, 2017, 221(22):959-968.
[54] SIMMLER C, GAUTHIER L, ANDERSON J R, et al. The combination of DNA barcoding and metabolomics for the multi-constituents characterization of Licorice botanicals[J]. Planta Medica, 2015, 81(11):3.
[55] 贺小燕.甘草蛋白自组装行为研究[D].福州:福州大学,2013.
[56] CHU H, ZHANG A H, HAN Y, et al. Metabolomics and its potential in drug discovery and development from TCM[J]. World Journal of Traditional Chinese Medicine, 2015, 1(4):26-32.
[57] YUAN Y L, XIA X, LI Q W, et al. Study of pharmacodynamic material basis of single-component Chinese medicine based on metabolomics[J]. Curr Res Integr Med, 2015, 1(1): 41-44.
