热应激前后湖羊下丘脑差异表达新基因的筛选与注释
2019-09-10李隐侠冯小品张莉张俊钱勇孟春花王慧利仲跻峰曹少先
李隐侠 冯小品 张莉 张俊 钱勇 孟春花 王慧利 仲跻峰 曹少先




摘要:湖羊是中国南方唯一的绵羊品种,耐湿热是其重要的特色性状之一。但目前关于其耐湿热机制尚不清楚。本研究以湖羊为研究对象,通过转录组测序技术鉴定热应激前后下丘脑组织中的新基因及其差异表达,并通过不同数据库比对和分析,进行新基因功能注释。结果表明,热应激前后在湖羊下丘脑组织中共检测到1990个新转录本,通过功能注释,发现1344個新基因。在热应激组和对照组湖羊中,差异表达新基因186个,其中130个新基因表达上调,56个新基因表达下调,通过比对发现这些基因分别与细胞免疫、繁殖、生长代谢及相关信号通路相关。Real-time PCR验证试验结果表明,10个热应激前后表达差异基因中有9个与转录组测序结果一致。这些结果为绵羊基因组的进一步完善及基因功能的挖掘提供了一定的数据基础,为全面解析绵羊热应激的分子机制提供更多的依据。
关键词:湖羊;热应激;下丘脑;转录组测序;real-time PCR
中图分类号:Q781
文献标识码:A
文章编号:1000-4440(2019)02-0363-07
热应激是指高温环境下,动物机体对热环境刺激产生的非特异性生理反应的总称。研究结果表明,影响家畜生产性能的主要环境因素有温度、湿度、太阳辐射和风速[2],在以高太阳辐射和高温著称的热带地区,热应激是一个限制动物发育和生产的主要因素[3]。研究结果表明,急性热应激使鸡生长性能下降,营养成分重分配,脂肪沉积增加[4-5];高温环境破坏蛋鸡内分泌系统进而妨碍生殖活动[6];热应激影响绵羊的产奶量和繁殖性能[7-8]。
热应激原因很简单,但其影响和调控机制到目前为止尚不清楚。通过垂体将神经系统和内分泌系统连接起来的下丘脑组织是一个调节体温的关键中枢[9]。众所周知,下丘脑的前视区(POA)和前下丘脑区(AH)是体温调节中心,下丘脑区域如室旁下丘脑核(PVN)、视神经核(SO)和外侧下丘脑在热应激状态下被激活。热应激状态下,下丘脑通过下丘脑-垂体-肾上腺轴、交感神经系统和其他神经内分泌途径保存或者消散热量,从而调节动物体温[10]。
湖羊是中国南方主要的绵羊品种,具有非常重要的优良特性,在中国低繁殖力绵羊品种遗传改良和新品系培育中做出了一定的贡献,其中耐湿热是众多优良特性之一。本研究以湖羊下丘脑组织为研究对象,在热应激状态和非热应激状态下,通过转录组测序技术、参考基因组比对技术挖掘湖羊新转录本,解析调控湖羊热应激的差异表达新基因,并进行功能注释,为进一步解析热应激调控的分子机制提供一定的理论依据。
1 材料与方法
1.1 试验动物与试验设计
一周岁健康、体质量[(33.00+1.58)kg]相近的湖羊母羊6只,急性热应激组和对照组各3只,自由采食和饮水。急性热应激组温度42℃ 左右4 h,热应激模型和温度参照文献[11];对照组温度22℃ 左右。基础饲料组成及营养水平见文献[12]。
1.2 样品采集及RNA提取
热应激组和对照组湖羊处理后立即屠宰,取完整的下丘脑组织置于液氮中贮存。在液氮中将整个下丘脑组织研磨完全,用Trizol 法提取总RNA,并分别采用Nanodrop、Qubit 2.0和Agilent 2100方法检测RNA样品的纯度、浓度和完整度等,符合测序要求的RNA送往北京百迈客生物科技有限公司进行转录组测序。
1.3 cDNA文库构建和测序
使用NEBNext UltraTM RNA文库试剂盒(NEB,美国),按照其说明书进行文库构建,具体步骤参照文献[13]。应用llumina Hiseq 2500高通量测序平台对构建的eDNA文库进行测序,测序读取长度为125 bp(双末端测序)。
1.4 RNA-seq分析
将原始数据进行数据过滤获得高质量的Cleandata,利用TopHat2将Clean reads 与参考基因组进行序列比对,并统计比对效率。使用Cufflinks软件对新转录本和新基因的表达水平进行定量。同时对差异表达基因(DEG)进行统计,以差异倍数(FC)≥2且错误发现率(FDR)<0.01为标准。
1.5 功能注释
使用BLAST软件将差异表达新基因与Nr、Swiss-Prot、GO、COG、KOG、KEGG数据库进行序列比对,使用KOBAS2.0得到新基因的KEGG orthology结果,预测完新基因编码的蛋白质氨基酸序列后使用HMMER软件与Pfam数据库比对,获得新基因的注释信息。
1.6 Real-time PCR
以转录组测序相对应的RNA为模板,用逆转录试剂盒(TaKaRa,大连)逆转录为cDNA。Real-time PCR反应体系为2.0 μleDNA模板,10 U的上下游引物各0.4 μl,2 ChamQ SYBR qPCR Master Mix10.0 μl。反应程序为95℃ 预变性30s;95℃ 10s,60℃ 30s,40个循环;95℃ 15s,60℃ 60s,95℃ 15s。每个样本重复3次。
2 结果与分析
2.1 测序数据结果
完成6只湖羊下丘脑组织的转录组分析,共获得48.66 Gb Clean data,Q30碱基百分比在89.79%以上,得到大量高质量原始数据。分别将各样本的Cleanreads与绵羊参考基因组进行序列比对,比对效率从65.05%到71.20%不等。
2.2 新基因预测及数据库注释
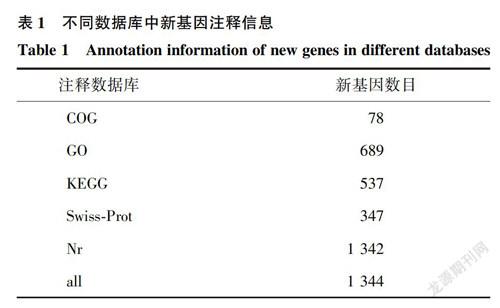
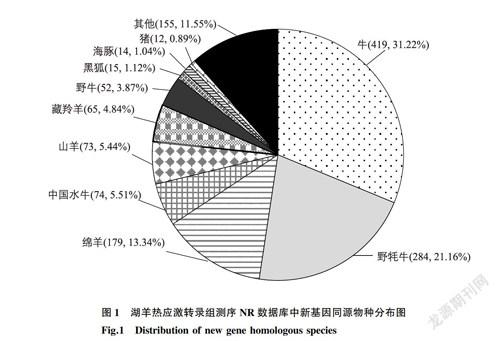
通过与绵羊参考基因组(Oar_v4.0)进行序列比对,在2组湖羊下丘脑组织中共检测到1990个新基因,其中绵羊以外数据库被注释的新基因为1344个。新基因在不同数据库中进行注释,结果发现Nr数据库新基因数量最多,达1342个,而COG数据库注释的新基因数量最少,为78个(表1)。Nr数据库中新基因同源物种分布结果显示约99.98%新转录本注释到最高的10个物种(图1),即牛(Bostaurus)(31.22%)、野牦牛(Bos mutus)(21.16%)、绵羊(Ovisaries)(13.34%)、中国水牛(Bubalus bubalis)(5.51%)、山羊(Capra hircus)(5.44%)、藏羚羊(Pantholops hodgsonii)(4.84%)、野牛(Bison bison)(3.87%)、黑狐(Pteropus alecto)(1.12%)、海豚(Tursiops truncatus)(1.04%)和猪(Sus scrofa)(0.89%)。
2.3 新基因GO分类
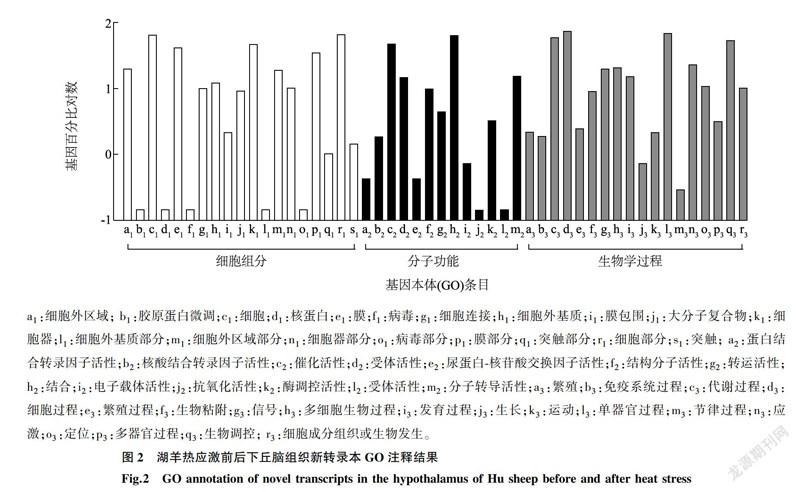
GO分类发现690个新基因分别分类到50个基因本体(GO)条目中,细胞组分19个、分子功能13个和生物学过程18个(图2),其中动物生长、繁殖、免疫系统、代谢及信号通路等生物学过程新基因所占比例最大,细胞组分次之,分子功能最少。
2.4 熱应激前后差异表达新基因的筛选和注释
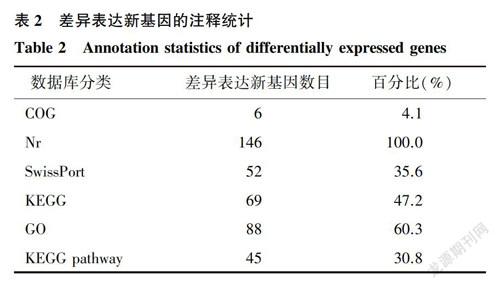
对热应激和对照组湖羊的下丘脑组织差异表达新基因进行筛选。结果表明,两组间共有186个新基因表达差异显著,其中上调基因130个,下调基因56个。186个新基因只有146个在不同数据库中被注释,其中在Nr数据库中被注释的差异表达新基因数目最多(146个),在COG数据库中最少(6个)(表2)。
45个差异表达新基因参与到65个信号通路,包含氧化磷酸化、MAPK信号通路、钙信号通路、代谢通路等。根据GO分类注释信息发现,其中参与湖羊生长调控的新基因有4个,参与繁殖调控的新基因有1个,参与免疫调控的新基因有2个,参与代谢调控的新基因有9个,参与氧化应激调控的新基因有21个,对应新基因编号及参与功能见表3。
2.5 热应激前后差异表达新基因的Real-time PCR验证
为了进一步确认转录组测序得到的差异表达新基因在热应激前后表达量差异,设计12对引物(表4),以热应激前后湖羊下丘脑组织cDNA为模板,Real-time PCR验证热应激前后基因表达差异。结果发现在10个表达有差异的新基因组中,9个基因的验证结果都与转录组测序的结果一致,Ovis_aries_newGene_12971基因转录组测序结果显示热应激后该基因表达量显著下降,而Real-time PCR结果显示该基因热应激后表达量下降,但是未达到显著水平(图3)。转录组测序热应激前后基因表达差异与Real-time PCR验证热应激前后基因表达差异比较见表5。
3 讨论
Marai等[13]根据温湿指数(THI)将热应激划分为不同的等级:22.2~23.3是普通热应激、23.4~25.6为严重热应激>25.6属于极严重热应激。研究结果表明不同动物诱发热应激的温度不同,对于羊而言,通常认为羊的临界温度为25~30℃ ,当绵羊暴露于超过30℃时被认为发生热应激[14]。Srikandakumar等[15]在温度为35.5~43.9℃ 时发现白毛澳大利亚美利奴产生热应激,呼吸频率上升到每1min128次。DaCosta等在温度为24~45℃ 的气候室中观察32只Polwarth母羊在不同级别热应激条件下饮食、反刍情况[11]。本研究根据Srikandaku-mar[15]和DaCosta[11]的研究模型选择热应激时间和温度对湖羊进行热应激研究。通过对对照组和热应激组湖羊下丘脑组织进行转录组测序,与之前的绵羊参考基因组序列相比,共检测到1990个新转录本,其中有数据库注释的基因1344个。这些新转录本比对到GO、Nr、Swiss-Prot、KEGG数据库的数量分别为689、1344、347和537,与这些数据库的成功比对为进一步证实这些新基因的存在提供了理论依据。同源物种比对分析发现,与牛的相似基因最多(31.22%),与绵羊的相似基因为13.34%,此结果一方面表明同为反刍动物的牛和羊在基因组序列中的高度保守性[1617],同时也表明现有的绵羊参考基因组的不完整性,本研究鉴定的绵羊新基因对进一步完善绵羊参考基因组具有非常重要的意义。
研究结果表明,当动物经历热应激后,动物体温上升,从而触发进化保守的能调控多个细胞活性的热应激转录组反应调节基因,包括蛋白折叠、蛋白讲解转运、代谢、DNA修复和复制等变化[1819],调控相关基因通路的变化,进而调控机体的氧化应激[20]、生长[21]、繁殖[22]、代谢[23].免疫[24]等。本研究结果经过与KEGG数据库比对发现,在热应激前后差异表达的新基因中有45个新基因参与到65个信号通路,包含氧化磷酸化、MAPK信号通路,钙信号通路、代谢通路等。研究发现热应激能激活MAPK信号通路,进而阻断细胞生长和引发凋亡[25],同时发现其参与热应激诱导的精子损伤[26],进而调控动物的繁殖。根据GO分类注释信息,发现参与湖羊生长调控的新基因有4个,参与繁殖调控的新基因有1个,参与免疫调控的新基因有2个,参与代谢调控的新基因有9个,参与氧化应激调控的新基因有21个。该结果表明,存在潜在的新基因,其在湖羊热应激后参与调控湖羊生长、繁殖、免疫、代谢和氧化应激等功能。
本试验对湖羊热应激前后下丘脑组织差异表达新基因进行GO功能分类和信号通路分析,有助于进一步解析调控湖羊热应激的分子机制,为尽早挖掘出完备的湖羊耐湿热特性的分子机理提供依据。
参考文献:
[1]黄艳,周阿容,池文文,等.果蝇热应激生理机制研究进展[J].南方农业学报,2018,49(5):912-921.
[2]HULME P E.Adapting to climate change:is there scope for ecological management in the face of a global threat[J].Journal ofApplied Ecology,2005,42:784-294.
[3]MCMANUS C,HERMUCHE P,PAIVA S R,et al.Geographical distribution of sheep breeds in brazil and their relationship with climatic and environmental factors as risk classification for conservation[J].Brazilian Journal Science and Technology,2014,1:1-15.
[4]刘梅.急性热应激对肉仔鸡生长性能及脂肪代谢的影响[J].动物营养学报,2011,23(5):862-868.
[5]唐姣玉,谢宇洁,刘兆辉,等.大蒜素对热应激湘黄鸡生产性能及营养物质代谢的影响[J].江苏农业学报,2017,33(3):638-641.
[6]TU W L,CHENGC Y,WANGS H,et al.Profiling of differential gene expression in the hypothalamus of broiler-type Taiwan country chickens in response to acute heat stress[J].Theriogenology,2016,85(3):483-494.
[7]MARAI I F M,EI-DARAWANY A A,FADIEL A,et al.Physiological traits as affected by heat stress in sheep-a review[J].Small Ruminant Research,2007,71:1-12.
[8]FINOCCHIARO R,VAN KAAMJ BC H M,PORTOLANOB,et al.Effect of heat stress on production of Mediterranean dairy sheep[J].Journal of Dairy Science,2005,88:1855-1864.
[9]HAMMEL H T,JACKSON D C,STOLWIJKJ A,et al.Temperature regulation by hypothalamic proportional control with an adjust-able set point[J].Journal of Applied Physiology,1963,18:1146-1154.
[10]MILLER D B,O'CALLAGHAN J P.Neuroendocrine aspects of the response to stress[J].Metabolism,2002,51:5-10.
[11]DA COSTA MJ,DA SOLVA RG,DE SOUZA R C. Effect of air temperature and humidity on ingestive behavior of sheep[J].International Journal of Biometeorology,1992,36(4):218-222.
[12]李隱侠,王慧利,邓唯,等.高温环境下湖羊直肠温度和血液生化指标的监测[J].中国畜牧兽医,2018,45(1):271-277.
[13]MARAIIF M,AYYAT MS,ABD EI-MONEM U M.Growth performance and reproductive traits at first parity of New Zealand White female rabbits as affected by heat stress and its alleviation,under Egyptian conditions[J].Tropical Animal Health and Production,2001,33:451-462.
[14]FUQUAY J W.Heat stress as it affects animal production[J].Journal of Animal Science,1981,52(1):164-174.
[15]SRIKANDAKUMAR A,JOHNSON E H,MAHGOUB O.Efect of heat stress on respiratory rate,rectal temperature and blood chemistry in Omani and Australian Merino sheep[J].Small RuminantResearch,2003,49:193-198.
[16]李隐侠,张俊,钱勇,等.乌骨绵羊NR5A2基因编码区序列克隆及特征分析[J].江苏农业学报,2014,30(6):1375-1382.
[17]张春香,张国林,郭丽娜,等.基于高通量转录组测序的山羊睾丸和附睾头差异表达基因分析[J].畜牧兽医学报,2014,45(3):391-401.
[18]FEDER M E,HOFMANN G E.Heat-shock proteins,molecular chaperones,and the stress response:evolutionary and ecological physiology[J].Anual Review of Physiology,1999,61:243-282.
[19]KREGEL K C.Heat shock proteins:modifying factors in physiological stress responses and acquired thermotolerance[J].Jourmal of Applied Physiology,2002,92(5):2177-2186.
[20]ALEMUT W,PANDEY H O,SALILEW WONDIM D,et al.Oxidative and endoplasmic reticulum stress defense mechanisms of bovine granulosa cells exposed to heat stress[J].Theriogenology,2018,110:130-141.
[21]PRAGNA P,SEJIAN V,BAGATH M,et al.Comparative assessment of growth performance of three different indigenous goatbreeds exposed to summer heat stress[J].Journal of Animal Physiology and Animal Nutrition (Berl),2018,102(4):825-836.
[22]RAHMAN M B,SCHELLANDER K,LUCENO N L,et al.Heat stress responses in spermatozoa:Mechanisms and consequences forcattlefertility[J].Theriogenology,2018,113:102-112.
[23]GANESAN S,SUMMERS C M,PEARCE S C,et al.Short-term heat stress altered metabolism and insulin signaling in skeletalmuscle[J].Journal of Animal Science,2018,96(1):154-167.
[24]SAEED-ZIDANE M,LINDEN L,SALILEW-WONDIM D,et al.Cellular and exosome mediated molecular defense mechanism inbovine granulosa cells exposed to oxidative stress[J].PLoS ONE,2017,12(11):e0187569.
[25]WADA T,PENNINGER J M.Mitogen-activated protein kinases in apoptosis regulation[J].Oncogene,2004,23(16):2838-2849.
[26]RAHMAN M B,VANDAELE L,RIJSSELAERE T,et al.Bovine spermatozoa react to in vitro heat stress by activating the mitogen-activated protein kinase 14 signaling pathway[J].ReproductionFertility and Development,2014,26(2):245-257.
