蔓三七茎多糖理化性质及抗氧化和免疫调节研究
2019-09-05胡居吾涂招秀
胡居吾,罗 斌,吴 磊,涂招秀,谢 欣
1江西省科学院应用化学研究所,南昌 330096;2江西省食品检验检测研究院,南昌 330001
蔓三七(GynuraProcumbens),又名平卧菊三七,为多年生草本植物,2012 年 5月被国家卫生部批准为新资源普通食品。蔓三七茎叶营养丰富,富含粗多糖和绿原酸等成分。民间利用其消炎止咳,通经活络,消肿止痛,现代生物化学和医学研究证明,蔓三七具有保肝[1]、降压[2]、调脂降糖[3]、抗炎镇痛[4-7]、抗癌[8-10]等多种药理活性。另一方面,其具有极好的营养价值,蔓三七叶是一种药食兼可的独特植物,它和现在人们食用的木耳菜同属。食味柔滑,清香可口。可清炒、凉拌、氽汤,其叶也可生吃,或取鲜叶开水冲泡当茶饮,是一种高经济价值的“药食两用”植物。但是,由于蔓三七叶占整株植物的28%,蔓三七茎占目前68%,这部分作为废弃物处理,目前还没有得到很好利用。
本实验以水提醇沉法提取蔓三七茎多糖,研究了蔓三七茎多糖的理化性质,首次应用 GC 分析蔓三七茎多糖的单糖组成;评价了蔓三七茎多糖的抗氧化活性(包括总抗氧化能力、DPPH和 OH自由基的清除能力);最后,初步探讨了蔓三七茎多糖对细胞的免疫调节活性,旨在为蔓三七叶的综合开发和利用提供理论基础。
1 材料与方法
1.1 材料与仪器
蔓三七茎,江西华紫仁农业开发有限公司,烘干、粉碎后过20目筛备用。
阿拉伯糖、鼠李糖、木糖、甘露糖、半乳糖、葡萄糖均购自中国食品药品检定研究院。三氟乙酸、盐酸羟胺、吡啶、醋酸酐均为分析纯,肌醇为生化试剂均购自国药集团;维生素C(Vc),北京鼎国昌盛生物技术有限责任公司;总抗氧化能力(T-AOC)测定试剂盒,南京建成生物工程研究所。1,1-二苯基-2-三硝基苯肼(DPPH),美国Sigma公司;苯酚、抗坏血酸、水杨酸钠、三氟乙酸、甲醇、盐酸羟胺、溴化钾、硫酸亚铁、浓硫酸、葡萄糖均为分析纯,购自绵阳市信捷商贸有限公司。
1.2 仪器与设备
气相色谱仪GC-2010(SHIMADZU公司),检测器:FID;色谱柱:WondaCap5毛细管柱 (0.25 mm×30.0 m×0.25 μm);自动进样器AOC-20S(SHIMADZU公司);自动注射器AOC-20i(SHIMADZU公司)。傅立叶红外光谱仪FTIR-7600(lambad公司);压片机DF-4型(天津港东科技发展股份有限公司);UV-1800 紫外可见分光光度计,日本岛津仪器有限公司;METTLER-TOLEDOAL104型电子天平,瑞士梅特勒-托利多公司;Milli-Q型超纯水制备系统,美国Millipore公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;DZF-6090Z型真空干燥箱,上海跃进医疗器械有限公司。TGL-16GA CO2培养箱,美国Thermo公司。
1.3 方法
1.3.1 蔓三七茎粗多糖(GPSCP)提取工艺流程[11]
取蔓三七叶烘干、粉碎、过筛,按照一定料液比1∶15加入蒸馏水,于65 ℃恒温水浴2.5 h,然后采用抽滤方式分离。滤渣部分继续用同样方法浸提,上清液合并浓缩后缓慢加入4倍体积的无水乙醇沉淀粗多糖,于4 ℃低温静置24 h,再以4 800 rpm离心10 min,收集下层粗多糖沉淀,最后用无水乙醇洗涤2次,得蔓三七粗多糖,测定的蔓三七叶粗多糖得率。
1.3.2 蔓三七茎多糖(GPSP)纯化工艺流程
采用Sevage试剂(氯仿∶正丁醇=4∶1)进行脱蛋白,重复操作6次后,溶液体系在旋转于蒸发仪上(45 ℃,-0.01 MPa)除去残留的Sevage试剂。再配成10 mg/mL的多糖溶液,装入截留分子量为3 000 u的透析袋中透析24 h,收集透析袋内的多糖溶液,冷冻干燥制得蔓三七茎多糖(GPSP)样品。
1.3.3 蔓三七茎多糖总糖含量测定
1.3.3.1 多糖含量的测定
采用赵会然的苯酚-硫酸法[21],体系略作改动。在490 nm处的吸光度,得到回归方程为y=7.55x-0.078,R2=0.999 4,表明总糖在0.021~0.166 mg/mL范围内与吸光度呈良好的线性关系。
样品液按上面步骤得糖浓度,按下式计算多糖提取量:
多糖提取量(mg/g)=(C×V×N)/1 000M
式中:C—多糖浓度(μg /mL),V—提取液总体积(mL),N—稀释倍数,M—干粉重量(g)。
1.3.3.2 方法学考察
1.3.3.2.1 精密度
取0.1 mg/mL的葡萄糖对照品溶液,按上述的方法进行测定,平行六份,计算吸光度的RSD值。
1.3.3.2.2 重复性
称取六份蔓三七茎粗多糖样品,分别配制成0.2 mg/mL的供试品溶液,按上述的方法测定其吸光度,计算多糖总糖含量的RSD值。
1.3.3.2.3 稳定性
精密称取六份蔓三七茎粗多糖样品,按上述的方法测定吸光度,每15 min,测定一次,在2 h内显色稳定,计算吸光度的RSD值。
1.3.3.2.4 加样回收率
取已知含量的六份蔓三七茎粗多糖样品,精密加入等量的无水葡萄糖,制成供试品溶液,按上述的方法测定吸光度,计算加样回收率。
1.3.4 GPSP中单糖组成(GC分析)[12]
1.3.4.1 标准单糖衍生物的制备
精密称取鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖六种单糖标准品各10 mg,分别放入10 mL具塞试管中,分别往各具塞试管中加入盐酸羟胺10 mg和内标8 mg,再分别加入吡啶0.5 mL,盖上塞子,在振荡机上摇匀,然后放入水浴锅中于90 ℃下加热反应30 min,在反应时间内间歇振荡。反应结束后,取出后冷却至室温,最后往各具塞试管中加入0.5 mL醋酸酐,继续放入水浴锅中于90 ℃下加热反应30 min。取下塞子后于70 ℃水浴中将试管中的溶液蒸发至干,得到的固体物质加入1 mL氯仿震荡溶解完全后,取样进行气相色谱分析[15]。
1.3.4.2 多糖的水解和衍生化
多糖的水解:精密称取GPSP样品50 mg于50 mL旋蒸瓶中,加入4 mol/L的三氟乙酸溶液5 mL,加玻璃塞封口。振荡使多糖溶解。在100 ℃下水解6 h,取出于70 ℃温度下旋转蒸发至干。
多糖的衍生化:水解后的多糖,按照“1.3.4.1”项下标准单糖衍生化的方法分别衍生化。
1.3.4.3 气相色谱分析
气相色谱条件设置:氢气流量40.0 mL/min,空气流量400 mL/min,氮气吹尾流量30.0 mL/min,进样压力100.0 kpa;进样温度为240 ℃,检测器温度为260 ℃,色谱柱初始温度为140 ℃,维持3 min,以10 ℃ /min升至240 ℃,维持15 min,进样体积为 1 μL。
1.3.4.4 重复性考察
精密称取6 份GPSP样品50 mg,按1.3.4.2“多糖的水解和衍生化”项下操作,取1 μL样进行气相色谱分析,记录各峰面积,计算鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖的峰面积,RSD分别为:0.98%、1.18%、1.23%、0.89%、1.17%、1.04%。结果表明本研究方法重复性良好。
1.3.4.5 稳定性试验
取供试品溶液,室温放置,分别在0、2、4、6、8、12、24 h,取1 μL,按“1.3.4.4”项下色谱条件进行测定,记录峰面积,峰面积的RSD分别为1.35%、1.46%、2.43%、2.58%、2.64%、1.89%。结果表明,鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖的衍生化产物在 24 h 内稳定性良好。
1.3.4.6 单糖组成
按下列公式计算GPSP中单糖质量,并求得相应单糖的摩尔数。
式中m0、mr、ms分别表示待测单糖、单糖标准品和内标物质的质量,A0、Ar、As分别表示待测单糖、单糖标准品和内标物质的峰面积,f表示相对校正因子。
1.3.5 红外光谱分析[13]
取少量干燥后的GPSP粉末,往其中加入适量的溴化钾晶体,在红外灯照射下于玛瑙研钵中轻轻研磨,至极细粉末,用压片机压制成透明薄片,经显微红外光谱仪400 cm-1~4 000 cm-1中红外区扫描。
1.3.6 GPSP的抗氧化活性测定
1.3.6.1 总抗氧化能力的测定[14]
采用总抗氧化能力(T-AOC)测定试剂盒测定GPSP总抗氧化能力。分别准确配制不同浓度的GPSP和抗坏血酸(Vc)溶液样品,按照T-AOC测定试剂盒说明书进行操作。在520 nm测定管样品吸光度(A测定)和对照管吸光度(A对照),根据下列公式计算GPSP及Vc的总抗氧化能力(η总):
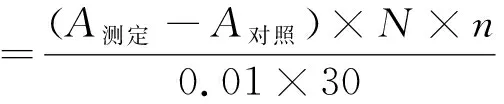
式中:
N—反应体系稀释倍数(反应液总量/取样量);
n—样品测试前稀释倍数。
在37 ℃时,每分钟每毫升样品使反应体系的吸光度值每增加0.01时,为一个总抗氧化能力单位。
1.3.6.2 DPPH自由基清除能力的测定[15]
分别取不同浓度的GPSP和抗坏血酸(Vc)溶液2 mL,加入2 mL的DPPH乙醇溶液,混匀后室温放置30 min后,在517 nm处的吸光度(A1)。同时测定不加DPPH的多糖溶液与乙醇混合后的吸光度(A2),不加样品的DPPH乙醇溶液作为空白对照的吸光度(A0)。根据公式计算GPSP及Vc的DPPH自由基清除率(ηDPPH·):
1.3.6.3 OH自由基清除能力的测定[16]
取0.5 mL 2 mmol/L水杨酸钠-乙醇溶液,往其中加入9 mmol/L硫酸亚铁溶液0.5 mL,再分别加入1.5 mL不同浓度GPSP溶液和抗坏血酸(Vc)溶液,最后加入0.5 mL 6 mmol/L双氧水。在510 nm下测定吸光度(Ax)。同时测定用蒸馏水代替硫酸亚铁溶液的吸光度(Ay),蒸馏水代替样品溶液作为空白对照的吸光度(A0)。根据下列公式计算GPSP及VC的OH自由基清除率(η·OH):
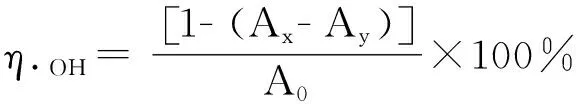
1.3.7 细胞培养和药液配制
RAW 264.7 细胞购于美国典型培养物保藏中心(ATCC)。RAW 264.7 细胞用RPMI 1 640培养基(含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素)在恒温37 ℃、5% CO2培养箱中培养至对数生长期。将GPSP溶解于二甲基亚砜试剂(DMSO)中,用RPMI 1 640培养基稀释成供试液浓度,所配制的药液中DMSO含量不能超过0.1%。
1.3.8 细胞活性检测-MTT法
采用MTT法[17]检测细胞存活率。选取对数生长期RAW 264.7细胞,按1×106个/mL、100 μL/孔接种于96孔板中,置于CO2培养箱培养过夜后,吸取旧培养基,加入待测药物的新培养基继续培养24 h,吸取旧培养基,于每孔中加入MTT工作液100 μL,继续孵育3 h后每孔加入MTT终止液100 μL继续培养16~20 h后,用酶标仪在550 nm处测定OD值,实验重复3次,计算细胞的相对存活率。
细胞的相对存活率(%)=(实验组孔吸光值-空白
组孔吸光值)/(实验组孔吸光值-空白组孔吸光值)
1.3.9 对RAW264.7细胞NO、PEG2和TNF-α分泌的影响[18]
将密度为1×105个/mL细胞接种于96孔板中,每孔100 μL置于CO2培养箱中培养过夜,洗掉旧培养基,加入不同浓度供试药物的新培养基继续培养24 h,以加入1 μg/mL LPS处理的细胞作为阳性对照组。检测细胞上清液中NO的分泌量,按ELISA检测试剂盒操作方法测定TNF-α及PGE2的分泌量。
1.3.10 数据处理
实验数据以x±s表示,采用Origin 8.0软件作图,SPSS13.0软件进行方差分析,P<0.05表示组间有显著性差异。
2 结果与分析
2.1 方法学考察及多糖样品测定结果
精密度实验结果表明,葡萄糖对照品的吸光度RSD值为1.87%,说明本研究采用的UV-1800紫外可见分光光度计精密度良好;重复性实验结果表明,供试品总糖含量的RSD值为2.35%,说明该方法重复性良好;稳定性结果显示该方法在2 h内稳定,RSD值为0.65%;回收率实验结果显示加样回收率范围96.65%~104.12%,RSD为1.89%。
2.2 GPSP中糖醛酸、硫酸根、蛋白质含量的测定
通过测定,蔓三七叶多糖的得率、含量及蔓三七叶多糖中的糖醛酸、硫酸根、蛋白质含量见表1。
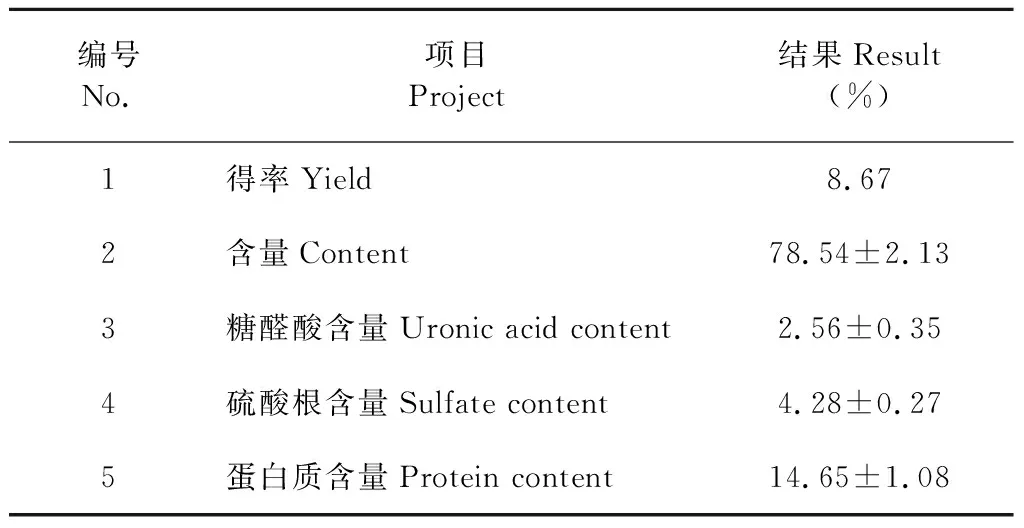
表1 蔓三七茎多糖(GPSP)的相关基本成分
与其他提取多糖方法(如碱提法、酶提法)相比,水提醇沉法获取的糖醛酸及硫酸根含量较低,因为,稀碱溶液能使蔓三七茎细胞壁致密结构变得疏松,打断了葡萄糖醛酸与半纤维素或纤维素之间分子的连接,从而使糖醛酸溶于稀碱溶液中,故碱提法得到糖醛酸和硫酸根含量最高。酶提法在一定程度上会破坏纤维素、半纤维素的结构,减少糖醛酸基团在溶剂中的暴露,故纤维素酶法得到的糖醛酸含量低于碱法提;水法提取其中的水溶性多糖,故糖醛酸和硫酸根含量均较低。蔓三七茎除含有多糖类外,还含有蛋白质、矿物质、维生素等。
2.3 单糖组成
本研究首次采用GC分析鉴定了GPSP的单糖组成,采用盐酸羟胺肟化和乙酸酐乙酰化衍生法有效克服由于多糖的异构化而造成的多峰现象,使得每种单糖都能获得单一的色谱峰,有利于进行气相色谱的定性和定量分析。图1和图2表明,GPSP主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖六种单糖组成。其中,木糖含量最大,半乳糖和阿拉伯糖次之,六种单糖的摩尔比为1.69∶4.64∶9.17∶1.00∶1.92∶4.85。
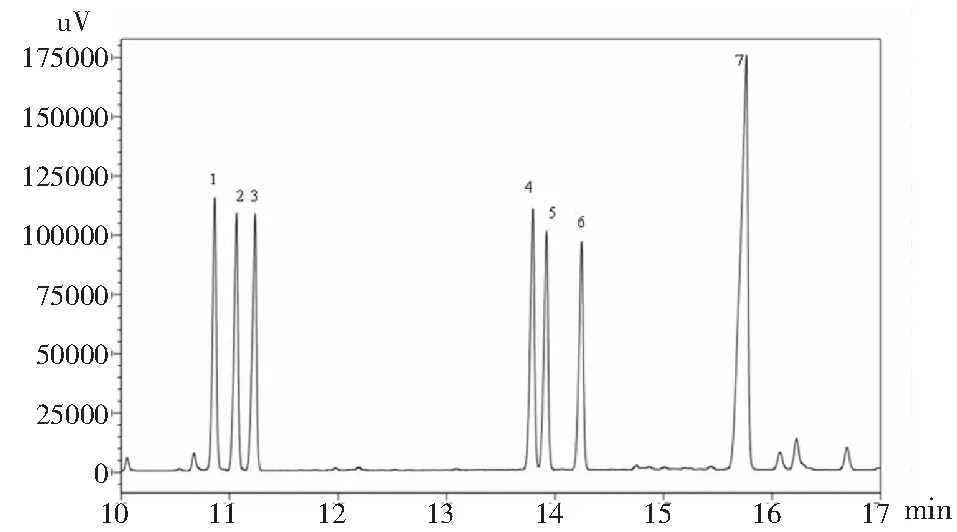
图1 标准单糖气相色谱图Fig.1 GC chromatogram of complex monosaccharide derivative注:1.鼠李糖;2.阿拉伯糖;3.木糖;4.甘露糖;5.葡萄糖;6.半乳糖;7.肌醇。Note:1.Rhamnose;2.Arabinose;3.Xylose;4.Mannose;5.Glucose;6.Galactose;7.Inositol.
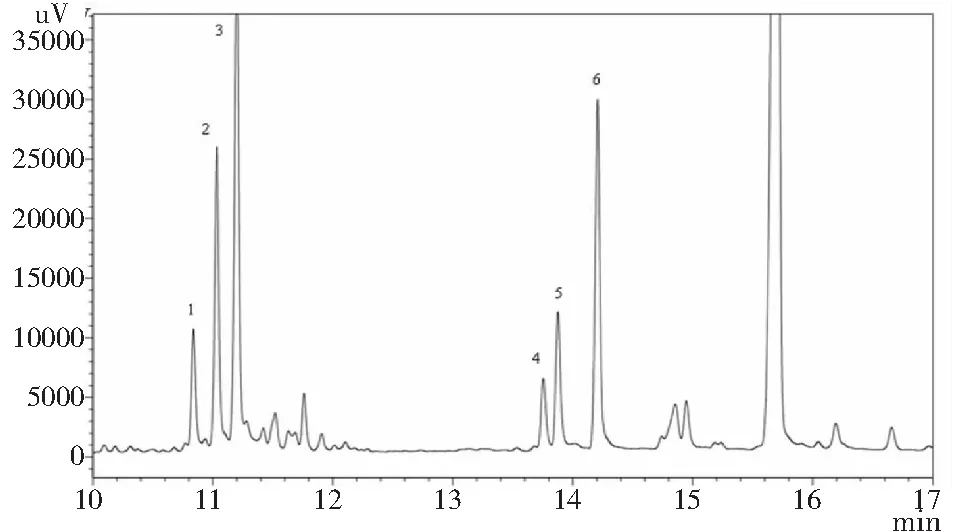
图2 GPSP气相色谱图Fig.2 GC chromatogram of polysaccharide from Gynura procumbens stem注:1.鼠李糖;2.阿拉伯糖;3.木糖;4.甘露糖;5.葡萄糖;6.半乳糖。Note:1.Rhamnose;2.Arabinose;3.Xylose;4.Mannose;5.Glucose;6.Galactose.
2.4 光谱分析
红外光谱是研究聚合物结构和化学键,表征不同化合物的常用手段之一,具有高度的特征性,一种有效研究分子官能团特征的手段。图3结果显示,GPSP在3 409.529 cm-1处出现的宽峰为分子间和分子内羟基(O-H)伸缩振动特征峰。2 964.053 cm-1处吸峰收为糖链中饱和甲基或亚甲基(C-H)伸缩振动峰,1 614.126 cm-1处吸峰收为 C=O伸缩振动峰。1 398.138 cm-1处吸收峰为C-H的变角振动峰。1 043.300 cm-1处吸收峰可能是吡喃糖环的特征吸收峰[19]。
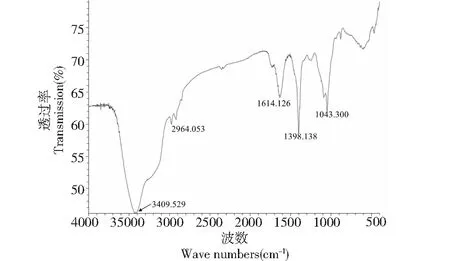
图3 GPSP的红外光谱图Fig.3 Infrared spectra of polysaccharide from Gynura procumbens stem
2.5 GPSP的抗氧化活性
2.5.1 总抗氧化能力
不同质量浓度GPSP样品总抗氧化能力研究结果见图4。由图4可见,GPSP的总抗氧化能力随着溶液浓度增大,抗氧化能力随之增强,与Vc在不同质量浓度的总抗氧化能力走向趋势相同。当GPSP样品质量浓度为5.00 mg/mL时,GPSP的总抗氧化能力达到了11.96±0.50 U/mL,达到相同质量浓度的Vc总抗氧化能力2.65±0.66 U/mL的95.0%以上。可以看出,GPSP总抗氧化能力较强。
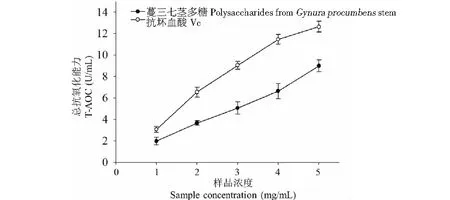
图4 GPSP总抗氧化能力Fig.4 Total antioxidant capability of polysaccharide from Gynura procumbens stem
2.5.2 对DPPH自由基清除能力
不同质量浓度GPSP对DPPH自由基清除能力实验结果见图5。GPSP与Vc的DPPH 自由基清除能力均随着质量浓度增大具有增强趋势。各浓度GPSP对DPPH 自由基清除能力低于同质量浓度下Vc对DPPH 自由基清除能力。但是,各质量浓度下的GPSP对DPPH 自由基清除效果也很明显,在浓度为4 mg/mL时,对DPPH 自由基清除率高达63.4%±2.36%,在此质量浓度下GPSP清除DPPH自由基的IC50为2.76±0.17 mg/mL。说明GPSP对DPPH自由基清除能力较好,尽管GPSP对DPPH自由基的清除能力低于Vc,但由于其良好的抗氧化活性和无任何毒性,可开发一种天然的抗氧化剂。
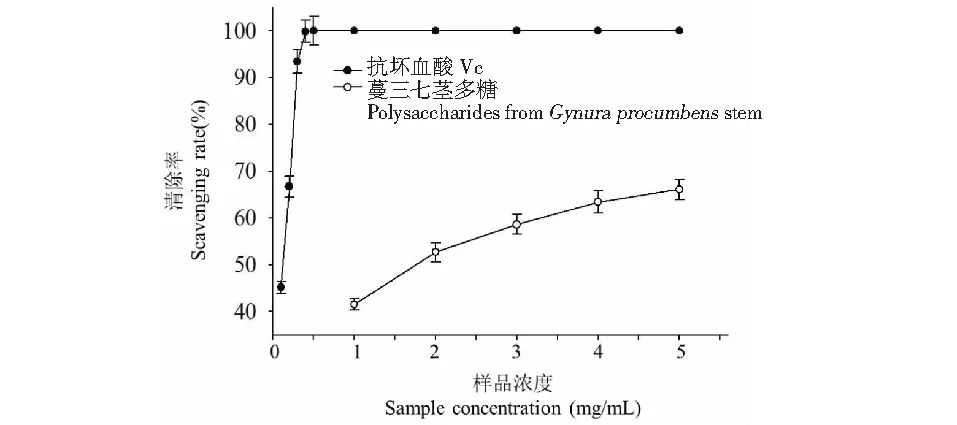
图5 GPSP对DPPH自由基清除能力Fig.5 The scavenging effect on DPPH free radical of polysaccharide from Gynura procumbens stem
2.5.3 对OH自由基清除能力
不同质量浓度GPSP对OH自由基清除能力实验结果见图6。GPSP与Vc的OH自由基清除能力均随着质量浓度增大具有增强趋势。各浓度GPSP对OH自由基清除能力低于同质量浓度下Vc对OH自由基清除能力。但是,各质量浓度下的GPSP对OH自由基清除效果也很明显,在浓度为5 mg/mL时,GPSP对OH自由基清除率为68.12%±1.12%,在此质量浓度下GPSP清除OH自由基的IC50为1.43±0.11 mg/mL,说明GPSP对OH自由基清除效果较好。
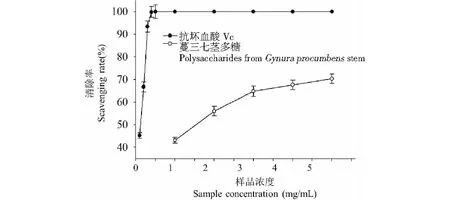
图6 GPSP对OH自由基清除能力Fig.6 The scavenging effect on OH free radical of polysaccharide from Gynura procumbens stem
2.6 对炎症因子释放的影响
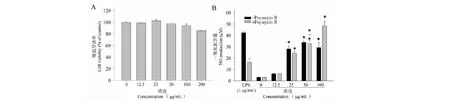
图7 GPSP对RAW 264.7细胞存活率及炎症因子含量的影响 Fig.7 The effects of GPSP on cells viability and the contents of cytokines secretion in RAW 264.7
本实验采用MTT法检测GPSP在一定的质量浓度范围内对RAW 264.7细胞存活率的影响,以考察GPSP的安全性。研究结果如图7(A)所示,样品浓度在12.5~100 μg/mL范围内,RAW 264.7细胞存活率所呈现的趋势与空白对照组相比基本一致,这说明GPSP在浓度12.5~100 μg/mL范围内对RAW 264.7细胞并无毒性。但是,当样品浓度在200 μg/mL时,RAW264.7细胞存活率所呈现的下降趋势。
由免疫和非免疫细胞分泌细胞因子是细胞间的信号分子,在免疫反应中起到重要的作用。活化的巨噬细胞能够释放大量的细胞因子(比如NO)。这些炎症因子在细胞毒性/抑制细胞生长的机制中发挥着重要的作用[20]。因此,本研究中将NO的释放水平作为免疫刺激中巨噬细胞活化的指标之一。采用Griess试剂法测定NO的含量,实验结果如图7(b)所示,正常组中RAW264.7细胞只释放少量的NO(3.03±0.11 μM),随着加入的GPSP样品浓度的增加,RAW264.7细胞释放NO的含量逐渐增加,并呈现出浓度依赖性关系。在GPSP样品浓度为50.0 μg/mL 时,NO的分泌量达到最大(39.28±3.25 μM)。另一方面,在样品浓度在12.5~100 μg/mL范围内,RAW264.7细胞释放NO的含量比LPS组低,说明GPSP比LPS更温和,适合作为免疫调节剂。
3 结论
苯酚-硫酸法是常用的测定多糖含量的方法,结果表明该方法重复性、稳定性好。采用气相色谱法(GC)分析测定GPSP中单糖组成,实验结果表明单糖组成为鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖,摩尔比为1.69∶4.64∶9.17∶1.00∶1.92∶4.85。该方法具有简便灵敏、衍生物杂质少、精密度高、重复性好等优点,能准确测定出GPSP中单糖的组成,具有较强的适用性。体外抗氧化活性结果证实GPSP对总抗氧化能力、DPPH自由基、OH自由基的清除能力具有较好的清除效果,并表现出明显的量效关系。
采用MTT法检测研究GPSP对RAW264.7 细胞活性的影响时,在GPSP样品浓度12.5~100 μg/mL范围内,细胞存活率所呈现的趋势与空白对照组相比基本一致,这说明GPSP在浓度12.5~100 μg/mL范围内对RAW264.7细胞并无毒性。总体而言,蔓三七茎多糖的抗氧化活性和免疫调节较强。下一步的研究工作主要集在对蔓三七茎粗多糖进行进一步纯化,再详细探讨其免疫调节机制,并使蔓三七茎多糖的免疫功效效果得到更详实的数据。
