基于金属硫蛋白铜纳米簇的过氧化物酶活性检测尿酸
2019-09-04刘然左利刘士蒙杨桂英李诗雅吕昌银
刘然,左利,刘士蒙,杨桂英,李诗雅,吕昌银
(南华大学 公共卫生学院,衡阳市健康危害因子检验检疫新技术研究重点实验室,湖南 衡阳 421000)
尿酸是嘌呤核苷酸分解代谢的终产物[1],人体血清中尿酸水平的正常范围为130~460 μmol/L[2]。尿酸异常是嘌呤代谢相关疾病的反映[3]。目前,人血尿酸的检测方法主要有高效液相色谱法、电化学法和荧光法等,这些方法虽然都较灵敏,但仪器昂贵、操作复杂[4]。当前,仍需进一步开发灵敏简便、成本低廉的尿酸检测新技术。
本研究利用尿酸氧化酶选择性催化尿酸氧化产生H2O2后,用金属硫蛋白铜纳米簇(MT-CuNCs)的类过氧化物酶活性催化H2O2与色源底物3,3-二氨基联苯胺(DAB)进行显色反应,实现比色/光度法准确检测人血清尿酸。该方法简便灵敏、选择性好、成本低廉,能够满足实际应用需要。
1 实验部分
1.1 材料与仪器
金属硫蛋白铜纳米簇,自制;尿酸、尿酸酶、3,3-二氨基联苯胺(DAB)、双氧水、三羟甲基氨基甲烷(Tris)、乙酸钠均为分析纯;超纯水(电阻率18.25 MΩ·cm)。
UV-2550紫外-可见分光光度计,狭缝1 nm(用于获取体系的吸收光谱)。
1.2 MT-CuNCs的制备
取600 μL 2.25 mg/mL金属硫蛋白溶液,置于100 μL 3 mol/L氯化铜溶液中,55 ℃恒温,振荡混匀15 min后,加入1.0 mol/L NaOH溶液200 μL,持续恒温混匀12 h。溶液颜色从浅蓝色变为浅紫色。制备所得的MT-CuNCs经0.2 μm滤膜过滤后,在4 ℃冰箱内避光保存。
1.3 实验原理
尿酸氧化酶特异性催化尿酸氧化产生H2O2[5],MT-CuNCs具有类过氧化物酶活性,可催化其表面的H2O2生成·OH[6]。强氧化性的·OH氧化DAB形成棕色的DBTD聚集体[7]。在一定浓度范围内,可通过测定体系颜色深浅或465 nm处的吸光度值的变化定量检测尿酸浓度。
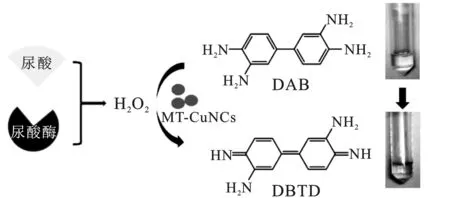
图1 比色/光度法测定尿酸的原理示意图Fig.1 Schematic diagram of the principle of colorimetric/photometric determination of uric acid
1.4 尿酸的检测
在一系列2 mL的EP管中,依次加入80 μL 10 mmol/L pH=7.0 Tris-HCl缓冲液,再分别加入不同量的尿酸溶液,70 μL 200 μg/mL尿酸酶溶液,混合均匀后孵育30 min使其充分反应,产生H2O2。随后,依次加入100 μL 200 mmol/L pH=5.0 NaAc-HAc,40 μL MT-CuNCs,40 μL 5 mmol/L DAB,混匀,在37 ℃下恒温孵育30 min后,在λe=465 nm处分别测定加入了尿酸各溶液的吸收光谱(A),测定未加入尿酸溶液的吸收光谱(A0),计算吸收光谱的变化值ΔA=A-A0。
2 结果与讨论
2.1 光谱特征
由图2可知,DAB溶液对400 ~ 650 nm的光无吸收;在UOx+MT-CuNCs+DAB测定体系中不存在尿酸,MT-CuNCs通过其氧化酶活性,催化溶液中的溶解氧氧化DAB,但催化氧化能力弱,产生的DBTD少,棕色聚集体量少,吸光度值增加,但变化小。在UA+UOx+MT-CuNCs+DAB测定体系中,由于存在尿酸,尿酸氧化酶特异性催化尿酸氧化产生H2O2,MT-CuNCs的类过氧化物酶活性,催化其表面的H2O2生成强氧化性的·OH,对DAB的氧化能力强,将DAB氧化产生棕色聚集体,吸光度值增加,变化大。H2O2+MT-CuNCs+DAB测定体系A-λ曲线与UA+UOx+MT-CuNCs+DAB测定体系的A-λ曲线具有相同的轮廓和吸收峰,验证了MT-CuNCs对DAB-H2O2氧化反应的催化行为,证明MT-CuNCs具有过氧化物酶活性,能够催化DAB显色。据文献报道,通过465 nm处的吸光度值变化可判断DAB的氧化程度[8]。据此,本文制备金属硫蛋白铜纳米簇后,研究建立了比色/光度法检测尿酸的新方法。

图2 不同体系的紫外可见吸收光谱图Fig.2 UV-visible absorption spectrum of the difference system
2.2 实验条件的优化
2.2.1 尿酸氧化体系的优化 考察了Tris-HCl缓冲溶液的pH和用量对尿酸氧化体系A值的影响,结果见图3。
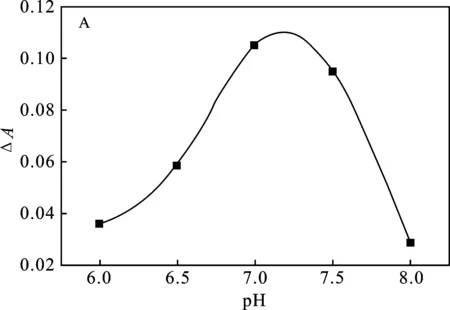

图3 Tris-HCl缓冲液的pH值和用量对 测定体系ΔA值的影响Fig.3 Effect of pH value and volume of Tris-HCl buffer solution on ΔA value of determination system
由图3可知,pH=7.0时,体系的ΔA值最大;当缓冲液用量为100 μL时,体系的ΔA值最大。因此,选择加入100 μL pH=7.0的Tris-HCl缓冲液进行后续实验。
尿酸氧化酶的浓度影响H2O2的释放,从而影响DAB的氧化速率。由图4可知,当尿酸酶用量为70 μL时,H2O2的释放量达到最大,故加入70 μL 200 μg/mL尿酸酶催化尿酸氧化。

图4 尿酸酶用量的影响Fig.4 Effect of the concentration of uricase
进一步考察尿酸氧化的反应温度和反应时间的影响,结果见图5。
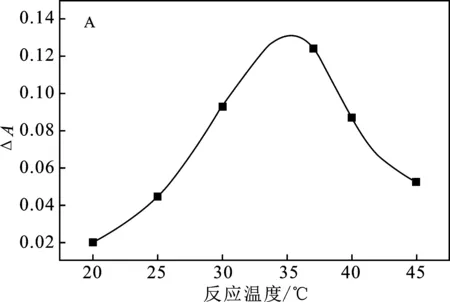
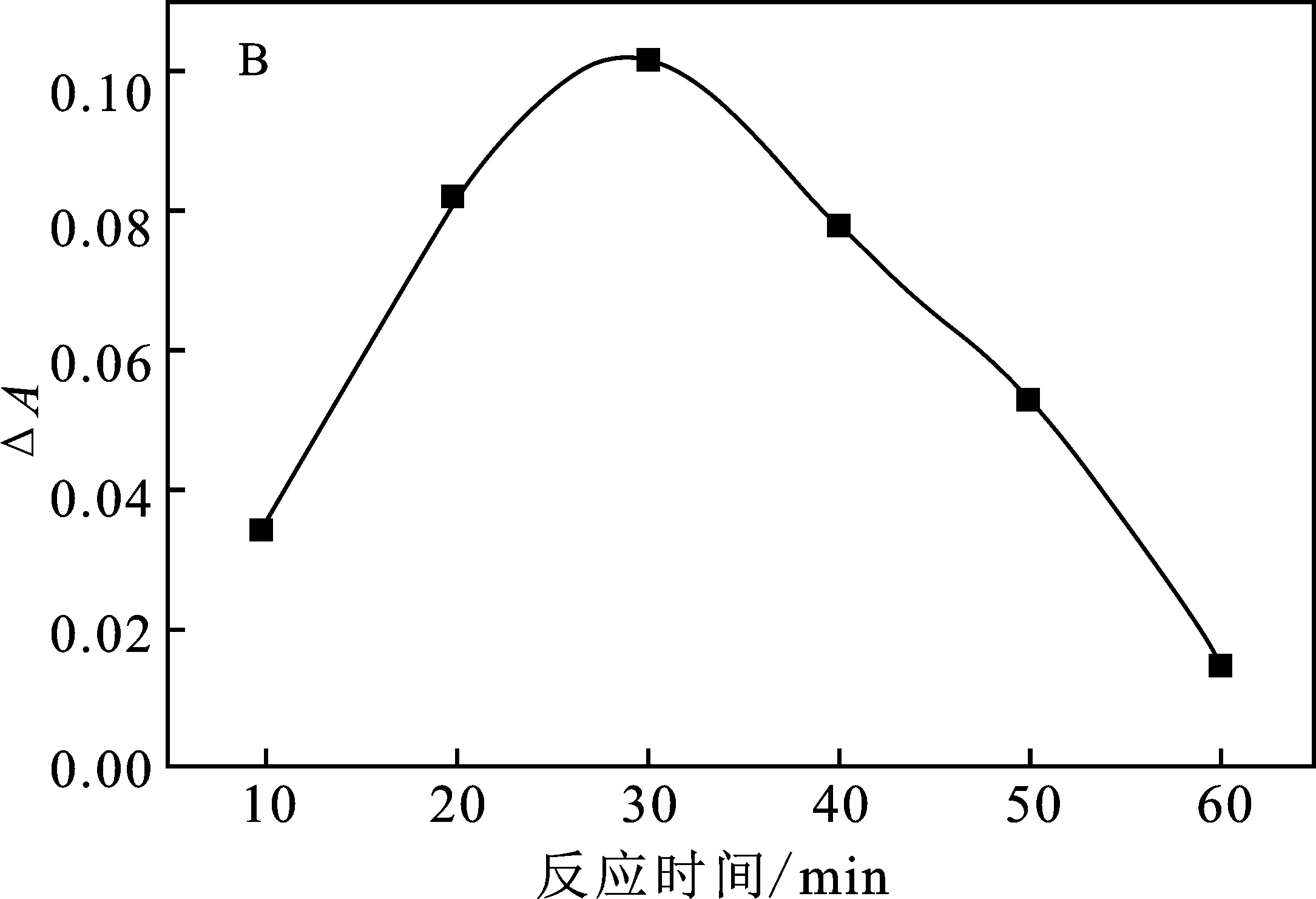
图5 尿酸氧化反应温度(A)及反应时间(B)的影响Fig.5 Effect of reaction temperature (A) and reaction time (B)on uric acid oxidation reaction
由图5A可知,反应温度在20~37 ℃时,随着温度的升高,体系吸光度变化值也随之增大;当反应温度达到37 ℃后,温度过高,尿酸氧化酶的催化活性被破坏,体系的ΔA值逐渐降低,选取37 ℃作为尿酸氧化的反应温度。尿酸酶催化尿酸氧化生成H2O2需要一定的反应时间,由图5B可知,尿酸孵育30 min时ΔA最大,这说明尿酸酶催化尿酸氧化生成产生H2O2在30 min时基本反应完全。
2.2.2 MT-CuNCs催化DAB显色体系的优化 考察了PBS、Tris-HAc、NaAc-HAc等缓冲溶液对 MT-CuNCs催化DAB显色体系的影响,结果见图6。

图6 缓冲体系类型的影响Fig.6 Effect of buffer system type
由图6可知,在NaAc-HAc缓冲溶液中,体系的ΔA值最大,故选择NaAc-HAc缓冲液进行实验。
对缓冲溶液的pH值和用量进行了优化,结果见图7。

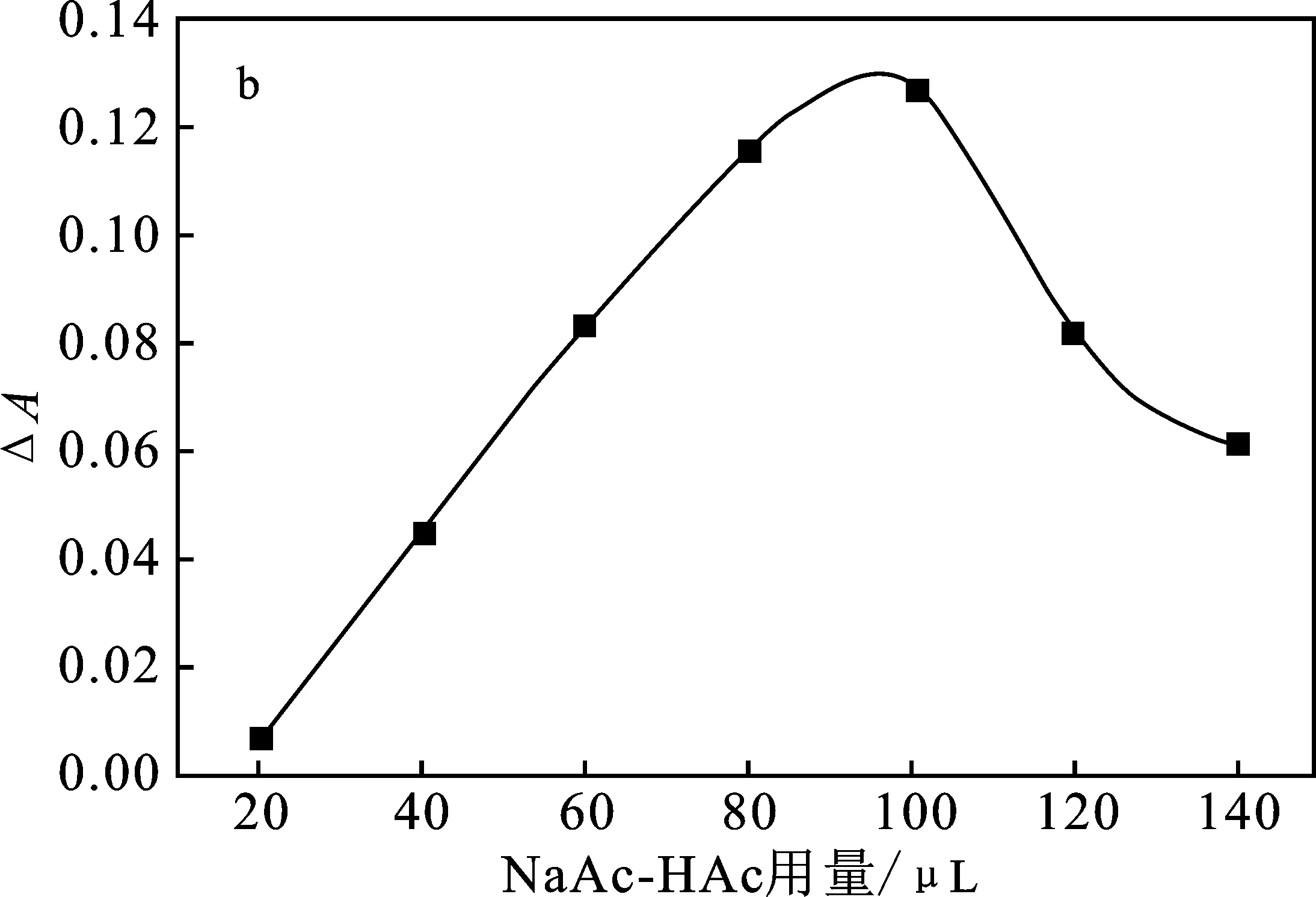
图7 NaAc-HAc缓冲液的pH和用量的影响Fig.7 Effect of the pH and volume of NaAc-HAc buffer solution
由图7A可知,pH=5.0时,体系的ΔA值最大;在pH值过高下,H2O2不稳定,会分解成H2O和O2,导致氧化DAB的能力下降;pH值过低时,DAB的显色反应可能被抑制。由图7B可知,当缓冲液的用量为100 μL时,体系的ΔA值最大。因此,选取100 μL pH 5.0 NaAc-HAc缓冲液作为最佳实验条件。
在MT-CuNCs催化DAB显色反应体系中,铜纳米簇是发挥HRP催化功能的物质,其用量对反应体系吸光能力的影响至关重要。由图8可知,当纳米簇的用量在10 ~ 40 μL时,体系ΔA值随纳米簇的用量增加而升高;当纳米簇的用量超过40 μL后,体系吸光度ΔA值随其用量增加反而降低,因此,选择40 μL作为本实验中纳米簇的用量。

图8 MT-CuNCs用量的影响Fig.8 Effect of the concentration of MT-CuNCs
对DAB的用量进行了优化,结果见图9。

图9 DAB用量的影响Fig.9 Effect of the concentration of DAB
由图9可知,当DAB的用量在20~40 μL时,体系ΔA值随DAB的用量增加而升高,但超过40 μL后,体系ΔA值随DAB的用量增加反而降低。这可能是因为DAB氧化速率依赖于DAB浓度,即显示在低DAB浓度下随着DAB增加氧化速率增加,并且在DAB浓度较高时显著抑制速率。根据文献报道,DAB浓度较高时聚合物生成速率增加,将会捕获体系内的活性催化位点,这阻碍了空间内H2O2或DAB单体的输送[9]。不仅如此,当DAB浓度太高时,体系内形成不溶的浅棕色沉淀,影响测定。因此,选择40 μL作为本实验中DAB的用量。
在上述实验条件优化的基础上,对DAB显色体系的反应温度和反应时间进行优化,结果见图10。
由图10A可知,20~35 ℃时,随着反应温度的升高,体系ΔA值随之升高;但反应温度超过 37 ℃之后,随着温度的升高,体系的ΔA值反而下降。当温度过低时,DAB的显色反应缓慢进行,而温度过高时,H2O2自分解。由图10B可知,当反应时间达30 min时,体系的ΔA值达到最大,DAB氧化反应基本完成。因此,实验选择在37 ℃下反应30 min后测定。
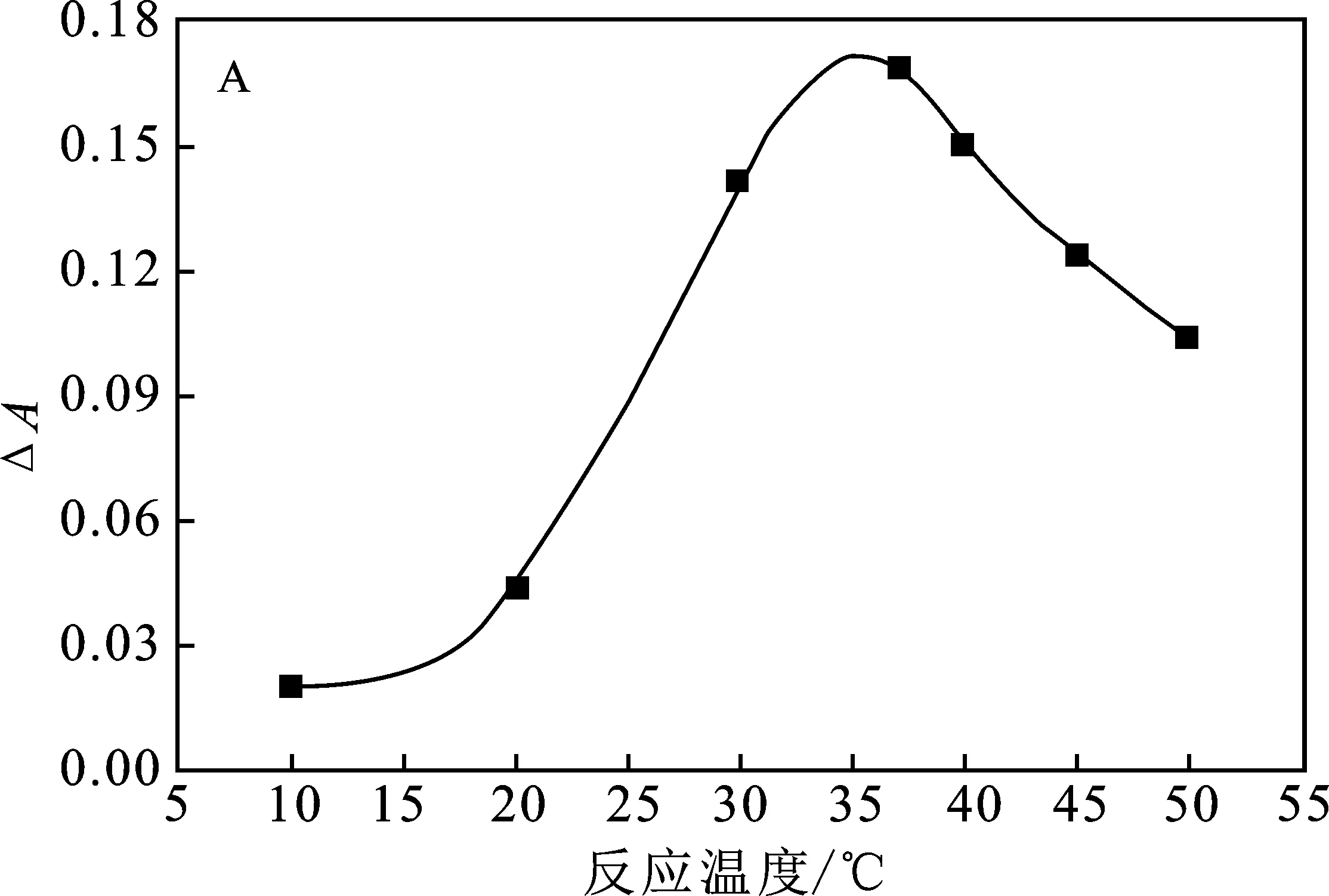

图10 DAB显色反应温度(A)和时间(B)的影响Fig.10 Effect of (A) temperature and (B) time of DAB color reaction
2.3 共存物质影响
选择性对传感器来说至关重要,在上述优化实验条件下,考察葡萄糖(Glu)、甘氨酸(Gly)、赖氨酸(Lys)、脯氨酸(Pro)以及血清中常见的离子(Na+、K+、Mg2+、Zn2+)对尿酸传感器的影响,结果见图11。

图11 干扰物质的影响Fig.11 Effect of interference substance
由图11可知,当相对误差控制在±10%时,50倍的Glu、Na+、K+,25倍的Mg2+、Gly、Lys、Zn2+、Pro不干扰测定,这表明建立的方法具有良好的抗干扰性。
2.4 标准曲线、检出限和相对标准偏差
在优化的条件下,考察了ΔA值与尿酸浓度之间的关系,结果见图12。
由图12可知,当尿酸的浓度在25~750 μmol/L时,ΔA值与尿酸浓度之间呈现良好的线性关系,线性回归方程为ΔA= 0.31CUA(mmol/L)+0.01,相关系数r=0.998。平行测定空白溶液11次,依据LOD=3sb/k(sb为空白溶液测定的标准偏差,k是标准曲线的斜率)计算,检出限为7.72 μmol/L。对75,375,625 μmol/L的尿酸溶液分别进行11次平行测定,其相对标准偏差分别为4.62%,3.02%,3.53%。

图12 ΔA值与尿酸浓度的关系Fig.12 Relationship between ΔA value and uric acid concentration and corresponding coloriogram
2.5 样品测定与加标回收率
通过静脉穿刺获得3份志愿者的血液样品。先将15%三氯乙酸与血液样品按3∶1的比例充分混合15 min后,将混合物以10 000 r/min离心10 min[10]。准确吸取40 μL上清液,按照所建立的方法进行测定,结果见表1。
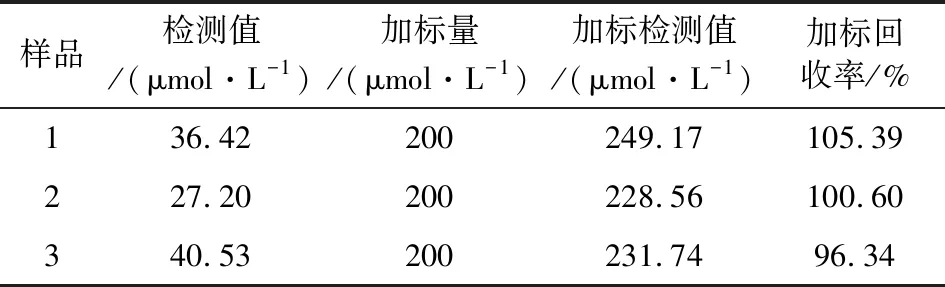
表1 人血清样本中尿酸的检测结果(n=6)Table 1 Detection of uric acid in human serum samples (n=6)
由表1可知,该方法简单易行,准确度良好。
3 结论
本研究成功建立了尿酸生物传感检测新方法。MT-CuNCs具有过氧化物酶活性,对DAB-H2O2氧化反应具有催化行为,能够催化DAB溶液显色。尿酸检测浓度范围为25~750 μmol/L,检出限7.72 μmol/L,可以满足实际血液样品中尿酸的测定分析。本方法既可以通过裸眼比色法半定量血样中尿酸浓度,也可以通过分光光度法准确测定其含量,简便易行,抗干扰性良好。
