极性光催化剂Na3VO2B6O11在不同因素影响下对2,4-二氯酚降解性能的研究
2019-09-04张杨范晓芸翟羽飞粟智殷娇
张杨,范晓芸,翟羽飞,粟智,殷娇
(1.新疆师范大学 化学化工学院,新疆 乌鲁木齐 830054;2.中国科学院新疆理化技术研究所,新疆 乌鲁木齐 830011)
2,4-二氯酚(2,4-DCP)是典型的难降解有机污染物[1-2]。传统的去除废水中2,4-DCP的方法[3-4]会导致有毒副产物的积累。半导体光催化作为绿色高效的化学氧化还原技术,被认为是降解水中酚类污染物的有效手段[5-6]。
近年来,极性光催化剂产生的内建电场促进光生载流子的分离已有报道[7-8],当光照射在极性材料上时,受屏蔽效应的影响,光生空穴和电子朝着内建电场相同和相反的方向移动。已有研究表明,通过阴阳离子或不同结构基元替换能显著影响极性材料的光催化能力[9-11],但对影响光催化活性的外部因素,如光强、污染物浓度、催化剂量等极少关注,基于此本文对其进行了更进一步的研究。
1 实验部分
1.1 试剂与仪器
碳酸钠(Na2CO3)、硼酸(H3BO3)、五氧化二钒(V2O5)、无水乙醇(C2H5OH)、丙酮(C3H6O)、2,4-二氯酚(C6H4Cl2O)均为分析纯;甲醇(CH3OH),色谱纯。
PLS-SXE300UV氙灯;Bruker D8 Advance X射线衍射仪;Shimadzu Solidspec-3700 DUV光谱仪;Ultimate 3000高效液相色谱仪。
1.2 光催化剂的制备
采用高温固相法合成Na3VO2B6O11粉末样品。制备过程如下:
3Na2CO3+V2O5+12H3BO3=2Na3VO2B6O11+3CO2↑+18H2O↑
按照上式的化学计量比将碳酸钠、五氧化二钒和硼酸混合,在研钵中充分研磨后置于瓷坩埚中,将原料加热至400 ℃,恒温2 h,然后在620 ℃下恒温4 h。在恒温期间取出样品进行研磨使其可以充分反应。自然冷却至室温后取出,研磨成均匀粉末状,洗涤,在80 ℃下烘干,即得样品。
1.3 2,4-DCP光催化降解实验
将一定量的光催化剂样品加入到100 mL不同浓度2,4-DCP的水溶液中,在避光条件下磁力搅拌20 min以确保溶液达到吸附平衡。然后将反应器(烧杯)置于300 W氙灯(λ>320 nm) 下进行光照。采用HPLC测量2,4-DCP溶液的浓度变化,其中C0,C分别是2,4-DCP溶液的初始浓度及不同时间下的浓度。
2 结果与讨论
2.1 Na3VO2B6O11极性光催化剂表征
图1a为催化剂的XRD射线衍射图,图1b为Na3VO2B6O11光催化剂的DRS图。


图1 Na3VO2B6O11极性光催化剂的 XRD图谱(a)和UV-vis 漫反射光谱图(b)Fig.1 XRD pattern(a) and UV-vis diffuse reflectance spectrum(b) of Na3VO2B6O11 polar photocatalyst
由图1a可知,Na3VO2B6O11样品的主要特征衍射峰强且尖锐,表明样品的结晶度良好;对比JCPDS卡(No.52-0421)标准衍射图谱,未出现其它杂峰,说明成功合成了Na3VO2B6O11光催化剂。由图1b可知,Na3VO2B6O11样品在紫外光区域具有较强的吸收,样品的吸收截止边界位于400 nm处。
2.2 不同因素对极性材料光催化活性的影响
2.2.1 溶剂对光催化降解的影响 在光照射并吸收相应能量后,光催化剂价带上的电子受到激发跃迁至导带,并在价带上产生空穴。光生电子和空穴与催化剂表面上的H2O、OH-和溶解氧等发生反应,形成具有高氧化性的羟基。通常认为表面羟基是活性位点,表面羟基数量越多,光催化效率越高[12]。因此,通过改变光催化反应体系中的溶剂,研究了不同溶剂对光催化活性的影响。分别以H2O、C2H5OH和C3H6O为溶剂,将0.05 g 的Na3VO2B6O11光催化剂分散在50 mg/L的2,4-DCP溶液中,反应30 min,光照强度为0.3 W/cm2,测试了其光催化活性并通过反应动力学拟合该降解过程,结果见图2。
由图2可知,光催化反应遵循准一级反应动力学。当H2O用作溶剂时,光催化降解效率最高,为90%,反应速率常数k最大,为0.076 8 min-1;而当以C3H6O为溶剂时,可以看出2,4-DCP几乎未被降解,反应速率也几乎为零。由于H2O和C2H5OH为质子型极性溶剂,C3H6O为非质子型极性溶剂;在相同条件下,H2O可以提供最多的质子,光生空穴可以与其反应生成更多的羟基自由基,而C3H6O几乎无法提供OH-参与光催化降解反应,故而降解效率几乎为零。


图2 溶剂对Na3VO2B6O11光催化剂 降解2,4-DCP的影响(a)及动力学拟合曲线(b)Fig.2 Effect of solvents on the degradation of 2,4-DCP by Na3VO2B6O11 photocatalyst (a) and kinetic fit curve of photocatalytic degradation reaction(b)
2.2.2 2,4-DCP初始浓度的影响 将0.05 g Na3VO2B6O11分散在100 mL初始浓度分别为25,50,75,100 mg/L的2,4-DCP水溶液中,光催化降解效率及动力学拟合曲线见图3。

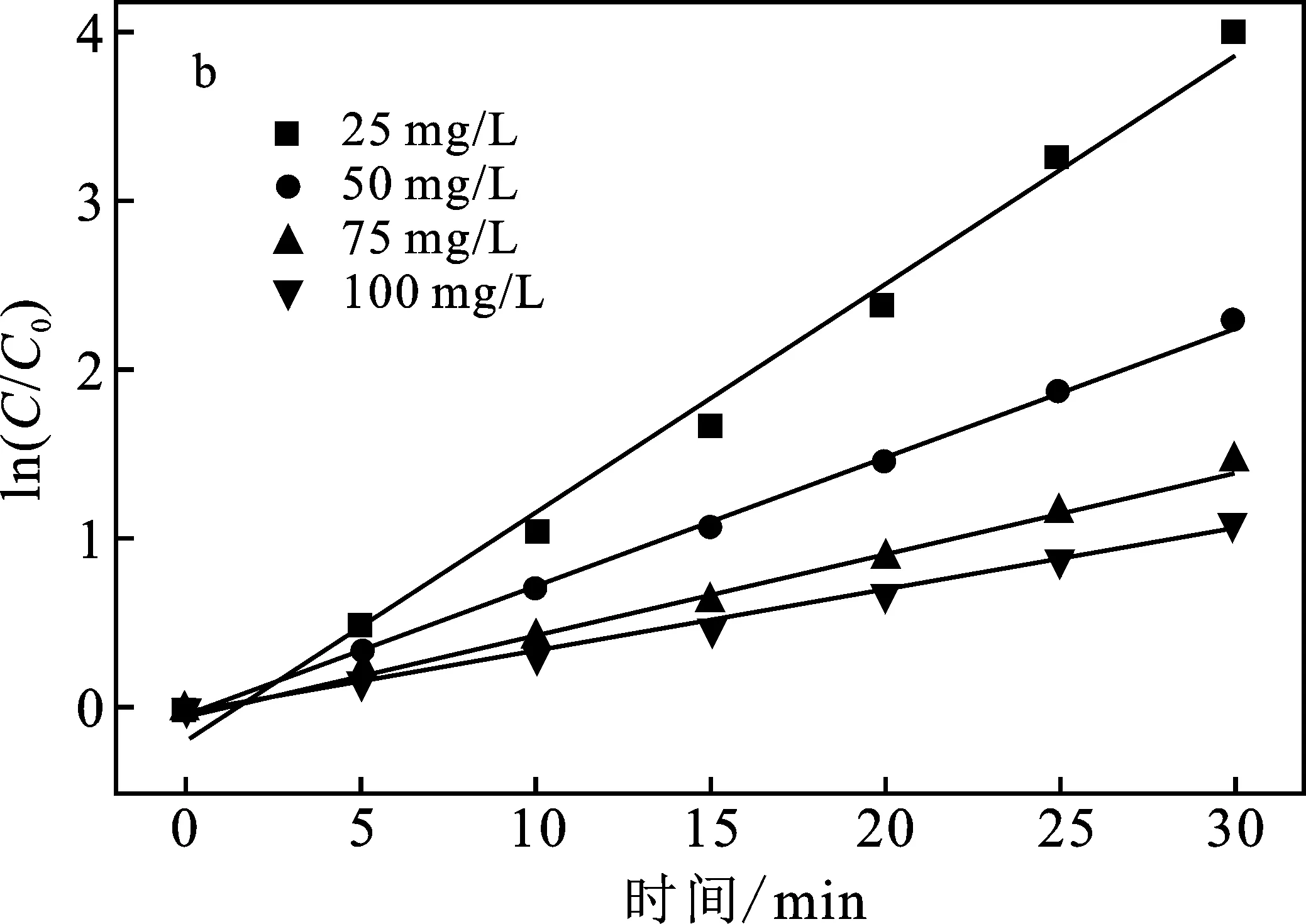
图3 初始浓度对Na3VO2B6O11光催化剂 降解2,4-DCP的影响(a)及动力学拟合曲线(b)Fig.3 Effect of initial concentration on the degradation of 2,4-DCP by Na3VO2B6O11 photocatalyst(a) and kinetic fit curve of photocatalytic degradation reaction(b)
由图3可知,光催化降解2,4-DCP的效率随着初始浓度增加而降低;当2,4-DCP水溶液浓度为25 mg/L时,光催化降解效率最高,为98%,反应速率常数最大,为0.135 06 min-1,继续增加溶液的浓度至100 mg/L,光催化降解效率降低至67%,反应速率常数为0.036 64 min-1。这是因为初始浓度较低时,溶液中有足够的活性物种与底物反应并将其氧化;当初始浓度增加时,底物占据了光催化剂表面的活性位点。此外,2,4-DCP水溶液对光的吸收和屏蔽作用增加,光生载流子的数量减少,导致光催化降解2,4-DCP的效率下降[13]。
2.2.3 光照强度的影响 将0.05 g Na3VO2B6O11分散在100 mL初始浓度为50 mg/L的2,4-DCP水溶液中,分别在光照强度为0.1,0.2,0.3 W/cm2时,光催化反应效率以及反应动力学拟合曲线见图4。


图4 光照强度对Na3VO2B6O11光催化剂 降解2,4-DCP的影响(a)及动力学拟合曲线(b)Fig.4 Effect of light intensity on the degradation of 2,4-DCP by Na3VO2B6O11 photocatalyst(a) and kinetic fit curve of photocatalytic degradation reaction(b)
由图4可知,光催化降解效率随着光照强度的增强而增加,反应速率常数k也随之增大。Olli等研究发现,低的发光强度下,降解速率与光照强度呈线性相关[14]。结果表明,在较低的发光强度下,光催化剂随着光照强度增加吸收更多的光子,产生的光生电荷量增加,加速了反应的进行,从而提高了光催化反应速率。
2.2.4 光催化剂用量的影响 在100 mL 50 mg/L的2,4-DCP 水溶液中,光照强度为0.3 W/cm2,Na3VO2B6O11的用量分别为0.02,0.05,0.10,0.20,0.50,1.00 g时,光催化降解实验结果见图5。


图5 催化剂用量对Na3VO2B6O11光催化剂 降解2,4-DCP的影响(a)及动力学拟合曲线(b)Fig.5 Effect of catalyst dosages on the degradation of 2,4-DCP by Na3VO2B6O11 photocatalyst(a) and kinetic fit curve of photocatalytic degradation reaction(b)
由图5可知,催化剂的用量从0.02 g增加到0.20 g 时,2,4-DCP的降解效率由68%升高到94%,反应速率常数增大;当光催化剂用量达到0.20 g时,速率常数k最大,为0.095 1 min-1;继续增加催化剂的量到1.00 g,光催化反应的降解效率下降至88%,光催化反应速率常数减小至0.070 16 min-1。催化剂的用量较少时,催化剂与反应底物2,4-DCP的接触面积小,单位时间内产生的光生电子和空穴较少,导致光催化活性降低以及反应速率常数减小;随着催化剂量的增加,参与光催化反应的催化剂粒子增多,可以产生更多的活性物种并加速光催化反应。光催化剂的用量过大时,反应体系过于浑浊,对光产生明显的散射,催化剂粒子对光的有效吸收减少,导致降解效率降低,k减小[15]。
2.2.5 无机阴离子对光催化降解的影响 在含有有机污染物的工业废水中,存在的一些无机阴离子可能会对光催化活性有一定的影响。有研究发现,水中的部分阴离子在光照下可能会产生羟基自由基增强光催化氧化效率[16];但也有研究发现,加入阴离子后,会抑制光催化活性[17]。 基于此,本实验主要考察了在3种不同阴离子存在下对材料光催化活性的影响。在100 mL 50 mg/L的2,4-DCP 水溶液中,光照强度为0.3 W/cm2,Na3VO2B6O11的用量为0.05 g,光照30 min,在光催化降解体系中分别加入NaCl、Na2CO3、Na3PO4,其中,Na+的浓度均为0.03 mmol/L,结果见图6。
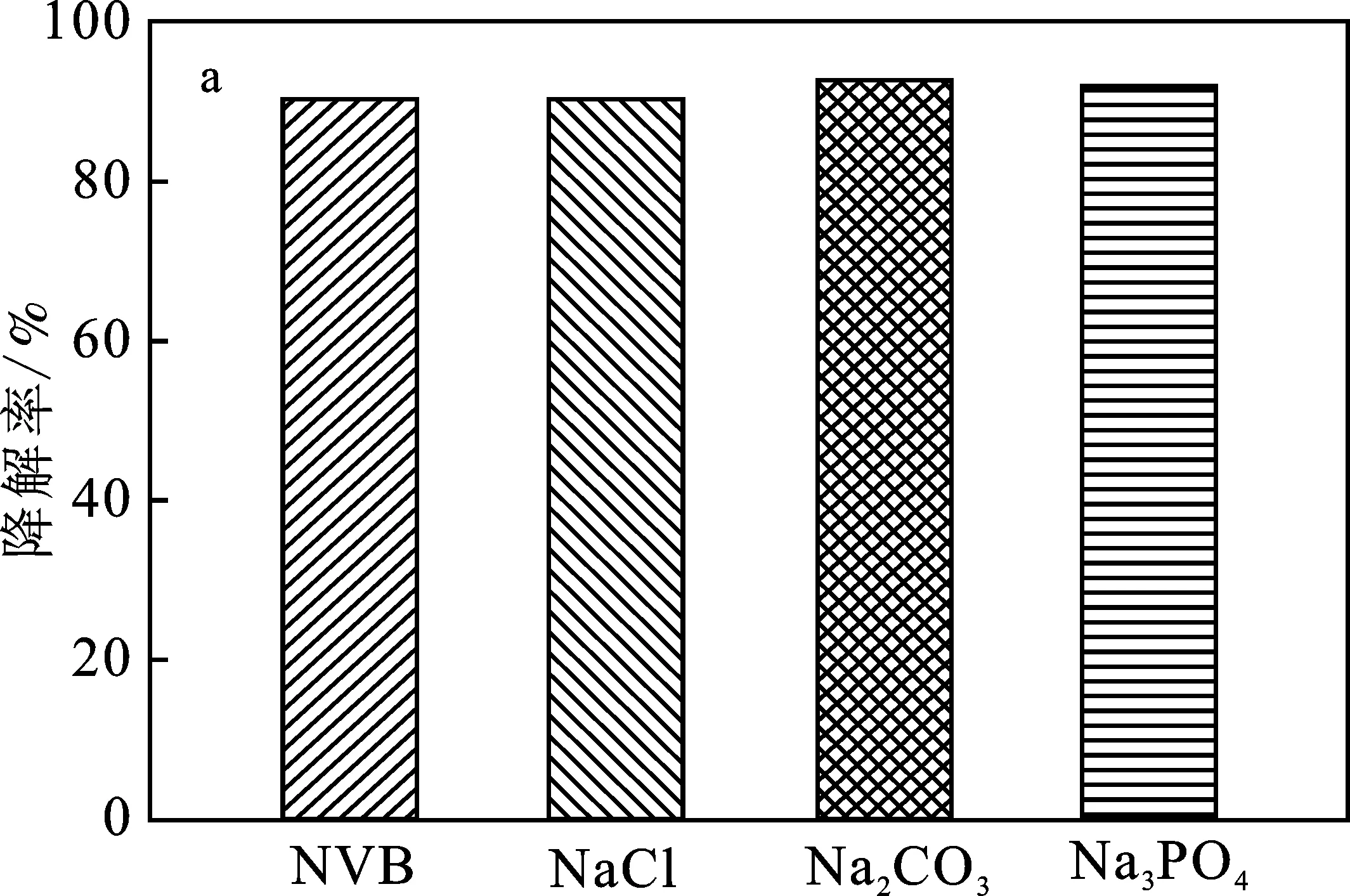

图6 无机阴离子对Na3VO2B6O11光催化剂 降解2,4-DCP的影响(a)及动力学拟合曲线(b)Fig.6 Effect of inorganic anions on the degradation of 2,4-DCP by Na3VO2B6O11 photocatalyst(a) and kinetic fit curve of photocatalytic degradation reaction(b)
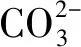
3 Na3VO2B6O11极性光催化剂降解2,4-DCP的反应机制
基于Na3VO2B6O11极性光催化剂的本征特点,对其降解2,4-DCP的反应机制提出了以下推测:如图7所示,Na3VO2B6O11光催化剂的非中心对称结构产生固有的极化效应,极化效应产生的内建电场将促使电子迁移到表面,并在表面发生还原反应。光生空穴则表现出来与电子相反的行为(图7a),因此,在该过程中,光生载流子得到了有效地分离。此外,受内部屏蔽效应的影响,在极化电场的作用下光生电子被吸引到C+表面上,而空穴被吸附到C-表面上;以加入Cl-为例,当阴离子Cl-加入到反应体系溶液中,由于受到外部屏蔽效应的作用,阴离子被吸附在与极化电场方向相同的表面(图7b),与表面上的·OH进行反应,生成具有氧化作用的Cl·[18-19],从而增强光催化活性。可能的反应过程如下:
(1)
(2)
(3)
h++OH-→·OH
(4)
Cl-+·OH→Cl·
(5)
h+,·OH,Cl·+2,4-DCP
→中间产物+小分子片段 (6)
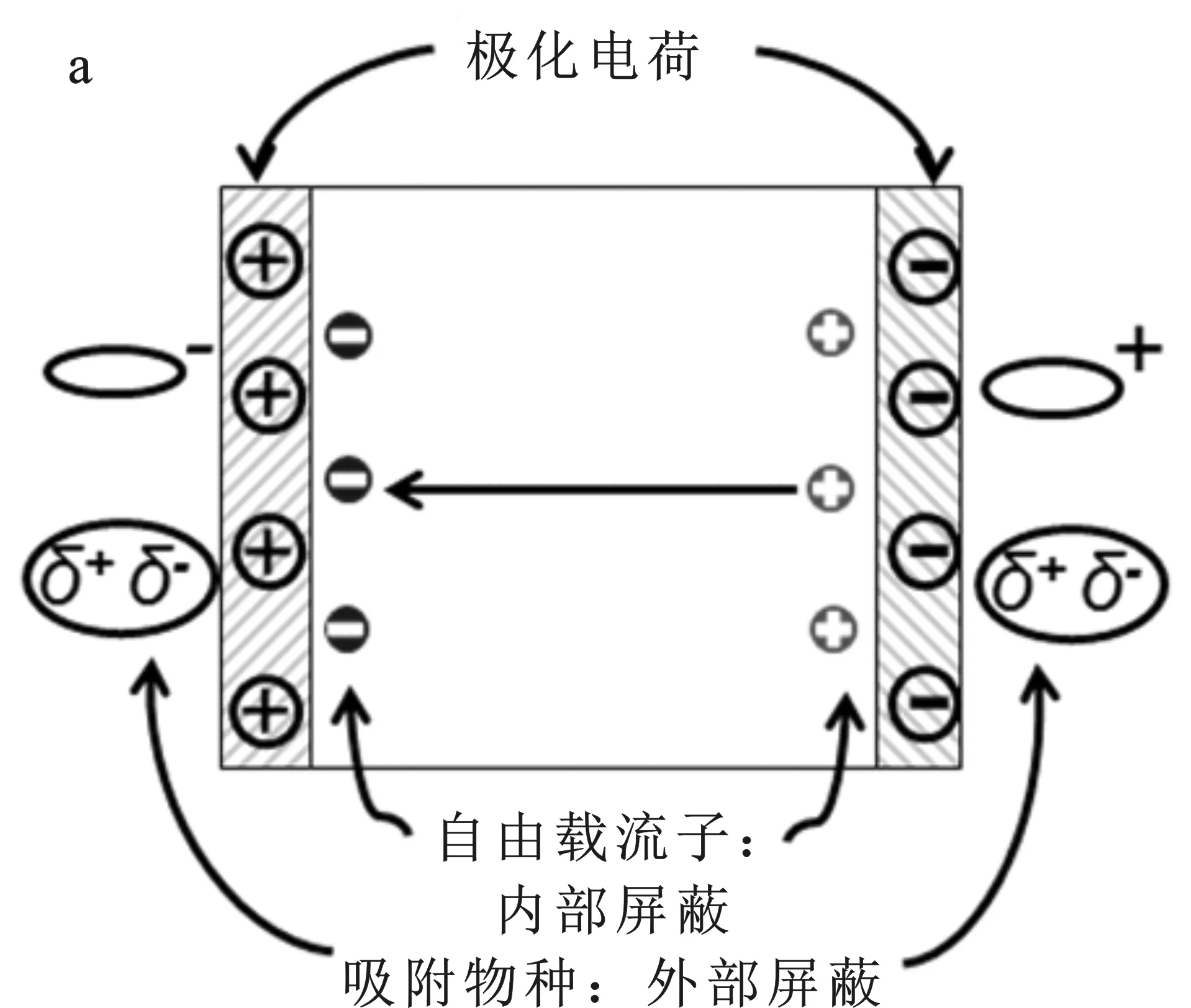
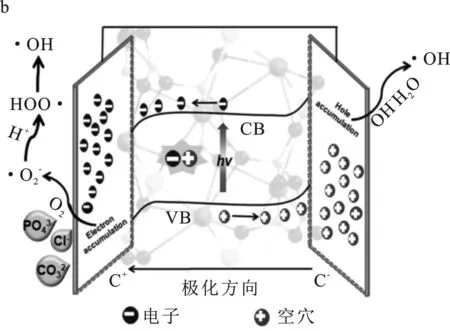
图7 Na3VO2B6O11光催化降解2,4-DCP的可能途径Fig.7 Proposed degradation pathways of 2,4-DCP over Na3VO2B6O11
4 结论

