解淀粉芽胞杆菌JNC2摇瓶发酵条件优化
2019-09-03梁艳琼吴伟怀习金根郑金龙贺春萍易克贤
梁艳琼,吴伟怀,习金根,李 锐,郑金龙,黄 兴,贺春萍,易克贤
(中国热带农业科学院环境与植物保护研究所 / 农业部热带农林有害生物入侵检测与控制重点开放实验室/海南省热带农业有害生物检测监控重点实验室,海南 海口 571101)
柱花草(Stylosanthes guianensis)是重要的豆科牧草和饲料植物资源,在全球热带、亚热带地区广泛种植,具有耐酸、耐旱、耐贫瘠等特性,发展潜力巨大[1]。由胶孢炭疽菌(Colletotrichum gloeosporioides)引起的柱花草炭疽病是影响柱花草产量的重要病害,该病主要为害叶片、叶柄、花序和茎杆的各个部位[2],造成柱花草叶片变黄、坏死脱落,茎杆和叶柄枯萎,花序败落不结籽,可致幼苗和成株死亡,牧草、种子产量暴减,甚至绝收,营养价值严重降低[3]。
防治该病主要的措施是化学防治和抗病品种的选育,然而抗病品种的培育不仅耗时长,且易因病原致病性的分化而丧失抗性,长期使用化学药剂,易导致病原菌产生抗药性,污染环境及造成农药残留等问题,因此亟待寻求一种更持久、更安全的防治措施。
利用有益微生物抑制其他有害生物的生物防治被认为是比较安全和有效的防控措施,近来已成为植物病害防治研究的焦点。胡进玲等[4]筛选获得对苜蓿茎点霉(Phoma medicaginis)等9种常见的紫花苜蓿主要病原真菌具有拮抗活性的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和卡那霉素链霉菌(Streptomyces kanamyceticus)两株菌株。张薇等[5]采用平皿对峙法从中筛选到3株对菌核病具有拮抗效果的生防菌,S1和S2菌株抑菌效果最好,抑菌带超过1.5 cm。温室测定发现S2菌株对苜蓿菌核病的生防效果最好,接种病原菌10 d后防效达67.5%,15 d后为61.7%。本研究从坚尼草(Panicum maximum)叶片上分离获得一株生防细菌解淀粉芽孢杆菌(Bacillus amyloliquefaciens) JNC2,对柱花草炭疽病菌具有较强的拮抗作用。代谢活性物质是菌株发挥拮抗作用的关键因素,而培养条件(培养基、发酵条件)对代谢活性物质产生具有较大的影响。鉴于此,对JNC2菌株发酵条件进行优化,以获得高产抑菌物质,从而提高菌株拮抗能力。
1 材料与方法
1.1 材料
解淀粉芽孢杆菌JNC2:筛选自坚尼草叶片上;指示菌:柱花草炭疽病菌(Colletorichum gloeos porioides),均由中国热带农业科学院环境与植物保护研究所提供。
1.2 培养基
PDA培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,pH 7.0。
LB培养基:蛋白胨10 g,酵母粉5 g,氯化钠10 g,蒸馏水1 000 mL。
初始发酵培养基候选配方:
1号培养基:葡糖糖10 g,蛋白胨5 g,酵母粉1 g,牛肉膏3 g,蒸馏水1 000 mL。
2号培养基:牛肉浸膏8 g,酵母浸膏5 g,葡萄糖10 g,蒸馏水1 000 mL。
3号培养基:蛋白胨10 g,酵母粉5 g,氯化钠10 g,蒸馏水1 000 mL。
4号培养基:蛋白胨5 g,牛肉膏5 g,氯化钠5 g,酵母浸膏5 g,葡萄糖5 g,蒸馏水1 000 mL。
5号培养基:牛肉膏3 g,蛋白胨5 g,葡萄糖10 g,蒸馏水1 000 mL。
6号培养基:葡糖糖10 g,蛋白胨10 g,KH2PO40.2 g,MgSO40.2 g,蒸馏水1 000 mL。
1.3 方法
1.3.1 JNC2菌株生长培养基的选择
在LB平板培养基上划线活化培养24 h,取1环,置于LB培养液中200 r·min-1振荡培养24 h,按照1%的接种量分别接入上述几种培养基中,37 ℃、200 r·min-1条件下振荡培养24 h,以菌体OD600值和发酵滤液抑菌活性为指标检测JNC2菌株的最适培养基。
1.3.2 优化培养基的确定
通过1.3.1筛选获得的最佳生长培养基为基础,通过单因子(碳源、氮源和无机盐)和正交试验筛选JNC2的优选培养基及培养条件。
碳源:在LB培养基中原有成分不变的前提下,以1%的蔗糖、木糖、果糖、可溶性淀粉、麦芽糖、甘露醇、淀粉、乳糖、山梨醇和葡萄糖为碳源,于37 ℃、200 r·min-1的摇床培养 24 h,测定其 OD600和发酵滤液抑菌活性。
氮源:共10种,原培养基中的蛋白胨,用1%酵母浸出粉、酵母粉∶胰蛋白胨为1∶1、酵母粉∶胰蛋白胨∶氯化铵为2∶2∶1 (质量比)、酵母粉∶胰蛋白胨∶硝酸铵为2∶2∶1 (质量比)、牛肉膏、麸皮、尿素、硝酸铵、氯化铵9种氮源替换培养基中的氮源,于37 ℃、200 r·min-1的摇床培养24 h,测定其OD600和发酵滤液抑菌活性。
无机盐:分别按0.1% (V/V)含量添加KH2PO4、FeSO4、 ZnSO4、 NaCl、 MnSO4、 MgSO4、 CaCl2以及不添加无机盐离子的空白对照,替代生长最佳培养基的无机盐,其他条件同上。
培养基成分优化:根据碳源、氮源和无机盐的筛选结果,选用5因素4水平L16(45)正交表进行正交试验设计,确定培养基各成分的最适配比,从而确定适宜JNC2菌株生长的最佳组合。
1.3.3 发酵条件的优化
在JNC2菌株培养基优化的基础上,对摇瓶发酵的培养温度、初始pH、培养转速、培养时间、最佳接种量、装液量等因素进行优化。每个试验组进行3次重复处理,在其他条件不变的情况下进行单个因素优化,测定菌体浓度和发酵滤液抑菌活性。
培养温度:按1%接种量将JNC2种子液接入装有100 mL液体发酵培养液的250 mL三角瓶中,分 别 在 10、 15、 20、 24、 26、 28、 30、 32、 34、37 和 40 ℃,200 r·min-1条件下培养 24 h,以接菌前培养基为空白对照,测定其OD600和发酵滤液抑菌活性。
初始pH:利用HCl和NaOH将优化培养基的pH调至 4.0、5.0、5.5、6.0、6.5、7.0、7.5、8.0、9.0、10.0,按1%接种量将JNC2种子液接入不同pH的培养液中,于37 ℃、200 r·min-1的摇床培养24 h,测定OD600值和发酵滤液抑菌活性。
培养转速:将JNC2种子液按1%接种量接入装有100 mL优化培养基的250 mL三角瓶中,将摇床转速分别设置120、140、160、180、200、220和240 r·min-1,在37 ℃培养24 h,以接种前培养基为空白对照,测定OD600和发酵滤液抑菌活性。
培养时间:将JNC2种子液按1%接种量接入装有100 mL优化培养基的250 mL三角瓶中,37 ℃、200 r·min-1培养 12、24、36、48、60、72、84、96、120 h,以接种前培养基为空白对照,测定OD600和发酵滤液抑菌活性。
最佳接种量:250 mL三角瓶中装优化培养基为100 mL,将JNC2种子液的接种量(V/V)分别调节为1%、3%、5%、7%、9%,于37 ℃、200 r·min-1条件下培养24 h,测定OD600和发酵滤液抑菌活性。
装液量:将JNC2菌株种子液分别接入装有20、40、60、80、100、120、140和 160 mL 发酵液的250 mL三角瓶中,于37 ℃、200 r·min-1条件下培养24 h,测定OD600和发酵滤液抑菌活性。
1.3.4 培养条件优化前后的抑菌活性对比
采用上述获得的最佳培养基组分及发酵条件对JNC2菌株进行发酵培养,以原始发酵条件为对照,测定其对柱花草炭疽病菌的抑菌活性,对比抑菌圈大小。
2 结果与分析
2.1 JNC2菌株生长培养基
JNC2菌株在6号培养基上生长最佳,OD600达到0.717,抑菌圈直径为26.20 mm (图1)。在2号培养基上生长最差,OD600仅为0.257,抑菌圈直径为18.90 mm,极显著低于6号培养基(P < 0.01)。因此,选用6号培养基为基础进行发酵条件优化。

图 1 JNC2菌株在6种不同培养基上生长情况Figure 1 Growth on 6 different media by the JNC2 strain1:1号培养基;2:2号培养基;3:3号培养基;4:4号培养基;5:5号培养基;6:6号培养基。不同小写字母表示同一指标不同处理间差异极显著(P < 0.01),图2、图3、图4、图5、图6、图7、图8、图9和图10同。1: Medium 1; 2: Medium 2; 3: Medium 3; 4: Medium 4; 5: Medium 5;6: Medium 6. Different lowercase letters indicate significant differences of the same parameter between different treatments at the 0.01 level, similarly for Figure 2, 3, 4, 5, 6, 7, 8, 9, 10.
2.2 优化培养基的确定
以6号培养基(葡萄糖10 g,蛋白胨10 g,KH2PO40.2 g,MgSO40.2 g,蒸馏水1 000 mL)为基础,通过单因子(碳源、氮源和金属离子)和正交试验筛选JNC2的优选适宜培养基及培养条件。

图 2 不同碳源对JNC2菌株发酵的影响Figure 2 Effects of different carbon sources on the fermentation of JNC2
2.2.1 碳源
不同碳源对JNC2菌株代谢抑菌活性物质和菌体量均有显著影响(图2),单从菌株的菌体量来看,当木糖为碳源时,OD值最大,为0.537,其次是淀粉,依次是麦芽糖、蔗糖、甘露醇、葡萄糖、果糖、山梨醇,可溶性淀粉的OD值最小,仅为0.246。发酵滤液活性大小依次为木糖 > 蔗糖 > 可溶性淀粉 > 淀粉 > 葡糖糖 > 果糖 > 麦芽糖 > 甘露醇、乳糖 > 山梨醇。碳源为木糖的发酵滤液活性及OD600值均达到最大值,抑菌圈直径可达33.30 mm。因此,选用木糖为优化培养基的碳源。
2.2.2 氮源
固定碳源为木糖,不同氮源的发酵滤液活性不同,且10种氮源间差异显著。当氮源为尿素、硝酸铵和氯化铵时,JNC2不能生长,其OD600和发酵滤液的抑菌活性均为0,以酵母粉:胰蛋白胨∶氯化铵 = 2∶2∶1作为氮源时,其JNC2的菌体浓度最高,OD600达到0.367,发酵滤液抑菌活性强,其抑菌圈直径为21.67 mm。因此,选用酵母粉∶胰蛋白胨∶氯化铵 = 2∶2∶1作为优化培养基的氮源(图3)。
2.2.3 无机盐
不同的无机盐对JNC2菌株的菌体量和发酵滤液的抑菌活性影响不同,MgSO4能显著提高JNC2菌株的菌体量和抑菌物质的产生。KH2PO4、MnSO4、NaCl、ZnSO4、FeSO4无机盐对菌株生长量有一定程度的抑制作用,KH2PO4、ZnSO4、FeSO4对菌株发酵滤液活性有抑制作用(P < 0.01)。因此,选择MgSO4作为培养液的无机盐(图4)。

图 3 不同氮源对JNC2菌株发酵的影响Figure 3 Effects of different nitrogen sources on the fermentation of JNC21,蛋白胨;2,酵母浸出粉;3,麸皮;4,牛肉浸膏;5,蛋白胨:酵母粉 = 1:1;6,酵母粉:胰蛋白胨:氯化铵 = 2:2:1;7,酵母粉:胰蛋白胨:硝酸铵 = 2:2:1;8,尿素;9,氯化铵;10,硝酸铵。1, Peptone; 2, Yeast extract powder; 3, Bran; 4, Beef extract; 5, Peptone:Yeast powder = 1:1; 6, Yeast powder: Peptone: Ammonium chloride =2:2:1; 7, Yeast powder: Peptone: Ammonium nitrate = 2:2:1; 8, Urea; 9,Ammonium chloride; 10, Ammonium nitrate.
2.2.4 正交设计
根据上述碳源、氮源和无机盐的筛选结果,确定了基础发酵培养基的最适碳源、氮源和无机盐的种类,为了优化培养基组分配方,利用正交表5因素4水平L16(45)进行正交试验设计,确定各组分的配比,以JNC2发酵滤液的抑菌活性为指标,以确定适宜JNC2菌株生长的最佳组合。结果表明,培养基不同组合配方对JNC2菌株抑菌活性具有不同的影响,JNC2产抑菌物质的最佳发酵优化培养基组分为木糖2%,蛋白胨0.4%,酵母粉0.8%,氯化铵0.6%,硫酸镁0.2% (表1)。
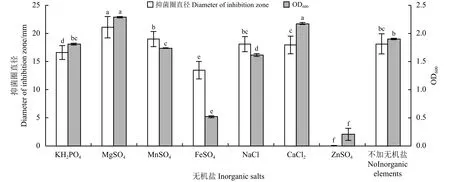
图 4 无机盐对JNC2菌株发酵的影响Figure 4 Effects of different inorganic elements on the fermentation of JNC2
2.3 发酵条件的优化
2.3.1 培养温度的选择
结果表明,JNC2菌株在10~40 ℃均能生长,差异显著。当温度为26~40 ℃时菌体生长量最高,其OD600范围为0.864~1.085。最适温度是34 ℃,其OD600为1.085。在发酵液活性方面,34 ℃时发酵液显示出较强的抑菌活性,其抑制圈直径可达20.23 mm,菌体生长代谢和酶活力受温度影响,温度过高,抑菌活性与菌株产量逐渐下降。因此,发酵温度为 34 ℃(图 5)。
2.3.2 初始pH
JNC2菌株在pH在4.0~9.0时均可生长,其中在pH 5.5~9.0时菌体生长较佳,当pH为6.0时菌体量最大,OD600值为0.620,说明菌株生长更适于弱酸条件;在抑菌活性方面,pH 6.0时活性明显高于pH 7.5~9.0时的发酵液活性。当pH为6.0时,JNC2菌株的菌体生长量和抑菌活性均达到最大值。因此,选择最佳初始pH为6.0作为后续试验(图6)。
2.3.3 培养转速
在转速为120~200 r·min1时,随着转速的升高,JNC2的菌体生长量和抑菌活性均呈上升的趋势,在转速为200 r·min-1时达到最大值,JNC2菌株在转速超过200 r·min-1时,JNC2菌株的菌体生长量和抑菌活性呈下降的趋势,转速过高可能引起菌体自溶从而降低发酵液抑菌活性(图7)。因此,选用转速为200 r·min-1作为JNC2菌株发酵转速。
2.3.4 培养时间
在培养12~72 h时,JNC2菌株随着发酵时间的增加,菌体量和发酵滤液活性逐渐升高,并在72 h时到达最大值。在72~120 h,随着培养时间的延长,菌体生长量呈下降趋势,发酵滤液活性维持在一个稳定并且较高的水平上。因此,菌株最佳发酵时间为72 h(图8)。
2.3.5 接种量
JNC2菌株的菌体量和发酵滤液抑菌活性随着接种量的增加呈现先增加后减少的趋势,当接种量为7%时,JNC2菌株菌体量和发酵滤液的抑菌活性达到最高峰,此时抑菌圈直径为19.90 mm,OD600为0.694 (图9)。当接种量超过7%时,菌体量减少,可能是由于接种量过大,过度消耗培养基的营养成分导致的。因此,最佳接种量为7%。
2.3.6 装液量
当装液量为20~60 mL,JNC2菌株菌体量和发酵滤液抑菌活性呈上升的趋势,当装液量为60 mL时菌株菌体量和发酵滤液抑菌活性最高;当装液量超过60 mL,随着装液量的增加,菌株菌体量和抑菌活性逐渐下降(图10),表明装液量过少或过多都不利于菌株的发酵。因此,250 mL三角瓶中装液量为60 mL是JNC2菌株最佳发酵装液量。
2.4 优化前后的活性比较
利用最佳培养条件(木糖2%,蛋白胨0.4%,酵母粉0.8%,氯化铵0.6%,硫酸镁0.2%,初始pH 6.0,250 mL三角瓶装液60 mL,接种量体积分数7%,34 ℃,200 r·min-1振荡培养 72 h)培养 JNC2 菌株,发酵滤液的抑菌圈直径为30.24 mm,比原始条件增加了32.61%。

表 1 培养基的正交试验结果Table 1 The orthogonal results of the medium

图 5 不同发酵温度对JNC2菌株发酵的影响Figure 5 Effects of different temperatures on the fermentation of the JNC2 strain

图 6 不同初始pH对JNC2菌株发酵的影响Figure 6 Effects of different initial pH on the fermentation of the JNC2 strain
3 讨论

图 7 不同转速对JNC2菌株发酵的影响Figure 7 Effects of different rotator speeds on the fermentation of the JNC2 strain

图 8 不同培养时间对JNC2发酵的影响Figure 8 Effects of different incubation times on the fermentation of the JNC2 strain
解淀粉芽孢杆菌(B. amyloliquefaciens)与枯草芽孢杆菌(B. subtilis)同属于芽孢杆菌,二者亲缘性较高,其活性代谢产物高、种类多样及功能丰富,繁殖能力强、易于工业化生产、对人畜无害、环境友好等特点,成为近年来继枯草芽胞杆菌之后的又一研究和应用热点[6]。生防菌能够发挥作用的重要物质基础是抑菌活性代谢产物,其产量的高低直接影响菌株的实际生防效果,发酵是获得大量微生物活性代谢产物的基础,发酵过程不仅仅是复杂的生物化学反应,且与微生物细胞的生命息息相关,如培养基成分、原料的品质、菌种菌量、培养条件等。在微生物的发酵试验中单因素和正交试验法可以最直接、有效地反映各个因素对菌株发酵的影响[7-9]。有研究表明,优化解淀粉芽孢杆菌发酵培养基组分及发酵条件可使菌体的生长速度加快[10-11]、提高抑菌活性物质的产量及增加防效。近些年来,关于生防菌株发酵条件优化的研究报道较多[12-13],其中报道解淀粉芽孢杆菌发酵培养基组分以及发酵条件优化的也不少,卢彩鸽等[14]以番茄灰霉病原菌为靶标病原菌,采用单因素试验筛选解淀粉芽胞杆菌MH71菌株的最佳产抗菌物质培养基及最佳碳源、氮源和无机盐,用Box-Benhnken试验及响应面分析相结合的方法对其发酵条件进行了优化,优化后菌株抑菌能力较优化前提高了37.4%。陈敏等[15]以香蕉枯萎病菌4号生理小种为指示菌,优化解淀粉芽孢杆菌SC1150菌株的液体发酵条件,优化后SC1150菌株对香蕉枯萎病菌4号生理小种的抑菌圈直径由原先23.31 mm提高至28.33 mm。

图 9 不同接种量对JNC2发酵的影响Figure 9 Effects of different inoculum on the fermentation of the JNC2 strain

图 10 不同装液量对JNC2发酵的影响Figure 10 Effects of different medium volume on the fermentation of the JNC2 strain
由于菌株的来源不同,菌株本身的生物学特性存在差异,其发酵培养条件不能一概而论。杨冬静等[16]报道解淀粉芽孢杆菌XZ-1培养基最佳组分为蔗糖5%,糊精10%,氯化钠7%,蛋白胨10%;XZ-1的最佳发酵条件为培养温度27 ℃,培养基初始pH为6.0,培养时间36 h,接种量3%,转速150 r·min-1,250 mL三角瓶装液量100 mL。陈哲等[17]研究发现,解淀粉芽孢杆菌CM3培养基最佳组分为豆粕0.5%,玉米粉2%,鱼粉0.5%,NaCl 0.1%;最佳发酵条件为培养基初始pH为7.0,发酵时间48 h,接种量5%,发酵温度31 ℃。上述研究结果表明了不同菌株的最佳发酵条件不同,每个菌株都有其独特的营养需求[18-20]。因此,选择适应菌株自身生长的培养基组分和最佳发酵条件,有利于提高菌体产量,使菌株的生防潜力获得充分的发挥。
有研究表明,碳氮源、无机盐以及培养基组分之间的配比、培养条件,都会对生防菌的抑菌活性有较大影响[21-23]。本研究通过单因素和正交试验法对JNC2菌株的发酵条件进行了优化,确定了菌株发酵条件为木糖2%,蛋白胨0.4%,酵母粉0.8%,氯化铵0.6%,硫酸镁0.2%,初始pH 6.0,250 mL三角瓶装液量为60 mL,接种量体积分数7%,发酵温度34 ℃,转速200 r·min-1,发酵时间72 h,优化后发酵滤液的抑菌活性显著提高,为其大面积推广应用提供科学依据。
