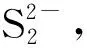双核磺化酞菁钴与硫化钠反应的伏安法研究
2019-09-03崔晓霞刘刚盛清涛申峻王玉高牛艳霞
崔晓霞 刘刚 盛清涛 申峻 王玉高 牛艳霞
太原理工大学化学化工学院
PDS脱硫法是东北师范大学开发的一种湿法催化氧化脱除H2S的方法,因有效解决了HCN中毒问题,得到众多脱硫企业的青睐,且该法脱硫效率高、适用范围广,目前全国已有几百家企业在运营[1]。PDS脱硫工艺的本质是采用催化剂在碱性溶液中将气态的H2S转化为单质硫,同时催化剂经氧气氧化再生,目前常用的催化剂为双核磺化酞菁钴[2]。理论上,该法具有绿色环保、可循环再生使用的特点。然而,同其他湿式催化氧化脱硫法一样,气相中的H2S在溶液中转化为单质硫的同时,也会转化为Na2S2O3、Na2SO3和Na2SO4等副产物,这些副产物的不断累积会影响脱硫系统的正常运行,如增加碱耗、降低脱硫效率、阻止催化剂再生、堵塞设备管道等[3]。
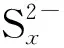
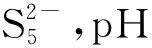
1 实验部分
1.1 试剂、材料与仪器
Na2S·9H2O、Na2CO3、NaHCO3、K3[Fe(CN)6]、KCl、CH3COCH3、C2H6O,均为分析纯;单质硫,99.5%(w);蒸馏水。
双核磺化酞菁钴(bi-CoPc,山东安泉化工科技有限公司)
CHI电化学工作站(上海辰华仪器有限公司)、PHSJ-4A型pH计(上海雷磁仪器厂)、DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)。
1.2 溶液配制
1.2.1 硫化钠溶液的配制
称取一定量的Na2S·9H2O晶体于表面皿,用蒸馏水冲洗除去表面氧化层后溶解定容,碘量法标定,现配现用。
1.2.2 双核磺化酞菁钴溶液的配制
称取一定量的bi-CoPc粉末,用蒸馏水溶解定容。
1.2.3 碳酸盐缓冲溶液的配制
用蒸馏水溶解1 g Na2CO3和30 g NaHCO3晶体转移至1 L容量瓶中,定容,用PHSJ-4A型pH计测定溶液的pH值为8.62。
1.2.4 多硫化钠溶液的配制
移取一定体积0.1 mol/L的硫化钠溶液,按照S0与S2-物质的量比为1∶1加入单质硫,恒温60 ℃ 水浴条件下采用氮气保护磁力搅拌反应6 h,快速过滤除去未反应的单质硫,采用碘量法进行标定。
1.3 实验方法
1.3.1 玻碳电极的预处理
将直径为3 mm的玻碳电极先用金相砂纸抛光;把粒径为0.05 μm的氧化铝抛光粉在鹿皮上用蒸馏水调成糊状,将玻碳电极在上面按“8”字型进行打磨。抛光完毕后,先用大量蒸馏水冲洗电极表面,再移入超声水浴中清洗,每次约2~3 min,重复3次。依次用蒸馏水、丙酮、无水乙醇进行超声洗涤,直至清洗干净为止。最后,扫描K3[Fe(CN)6]溶液的循环伏安曲线以测试电极性能,所得循环伏安图中的氧化还原峰电势差在90 mV左右,电极方可使用。否则,需重新打磨电极,直到符合要求为止。
1.3.2 电化学测量
测试仪器为上海辰华仪器有限公司CHI660E电化学工作站。采用三电极体系,工作电极为CHI104型玻碳电极(GCE),参比电极为CHI150型饱和甘汞电极(SCE),辅助电极为铂丝电极。使用圆形玻璃电解池,三电极孔位置为等边三角形,每次测量时保证电极放置位置一致,以保证电极表面电流分布的均匀性。本研究所使用的电位值均相对于饱和甘汞电极。
2 结果与讨论
2.1 Na2S溶液的循环伏安行为
该部分以反应物Na2S溶液为研究对象,考察了扫描速率对实验结果的影响。Na2S溶液浓度为1×10-3mol/L,溶液pH值为10.50,扫描速率分别为50 mV/s、100 mV/s、200 mV/s和500 mV/s,扫描电位范围为-1.6 ~1.6 V,起始扫描方向为负向扫描,开路电压为起始扫描电位值,结果见图1。
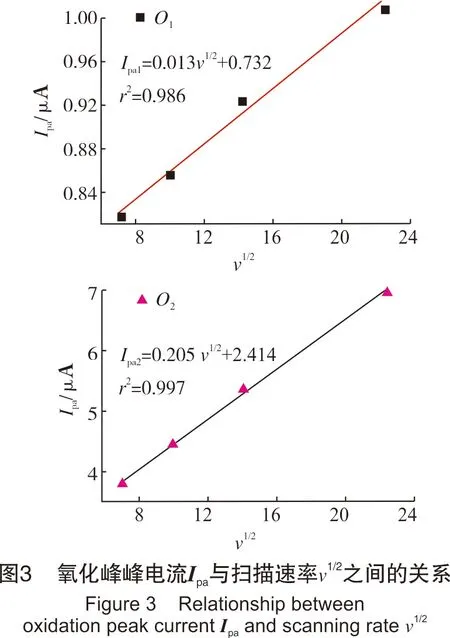
从图1中可看出,当扫描速率低于500 mV/s时,Na2S溶液在-0.27~-0.24 V范围有1个较弱的氧化峰,在0.61~0.94 V范围有1个明显的氧化峰,且在-0.72~-0.81 V和-1.14~-1.23 V范围分别有1个弱的还原峰。随着扫描速率的增加,峰形与峰数基本不发生变化,但峰位置有所移动。具体而言,氧化峰对应的峰电位值都向正电位方向移动,还原峰对应的峰电位值向负电位方向移动,且氧化峰O2所对应的峰电位值移动较明显,当扫描速率从50 mV/s增加到500 mV/s时,峰电位值从0.61 V移动到0.94 V,说明随着扫描速率的增加,O1处形成的产物更难被进一步氧化[11]。此外,随着扫描速率的增大,氧化峰和还原峰所对应的峰电流响应值也逐渐增加。
图2描述了氧化峰O1、氧化峰O2对应的峰电位值Epa与扫描速率lgυ的关系。从图2中可看出,Epa与lgυ呈线性关系。同时,从图1也可以看出,氧化还原峰并不对称,因此得出,Na2S在玻碳电极上的氧化过程为不可逆行为。根据不可逆体系存在如下关系[12-13],见式(1)。
dEpa/dlgυ=30/nα
(1)
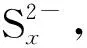
(Ⅰ)
(Ⅱ)
(Ⅲ)
(Ⅳ)
(Ⅴ)
以物料守恒和电荷守恒为基础,氧化峰O2的总反应可描述如式(Ⅵ):
(Ⅵ)
从图3可以看出,氧化峰峰电流Ipa与扫描速率υ1/2线性关系良好,说明Na2S氧化过程受浓度扩散控制[15]。此外,实验中也发现,在玻碳和铂丝电极表面有微小的气泡生成,推测有气体产生,这可能是由于阳极过程有氧气析出造成的,反应方程式见式(Ⅶ):

(Ⅶ)
阴极过程可能发生H+还原产生氢气的过程,反应方程式见式(Ⅷ):
2H++2e-H2Eθ=0 V
(Ⅷ)
又因pH值会影响其电位,关系为:
EH=-0.059 pH
(2)
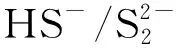
2.2 bi-CoPc溶液的循环伏安行为
2.2.1 bi-CoPc在水溶液中的循环伏安行为
该部分以反应物bi-CoPc为研究对象,考察了扫描速率对实验结果的影响。溶液浓度为9.82 μmol/L,pH值为8.00,扫描速率分别为50 mV/s、60 mV/s、80 mV/s、100 mV/s,结果见图4。
从图4可看出,当扫描速率在50 ~100 mV/s时,bi-CoPc溶液在电极上有2个氧化峰和1个还原峰,其中,氧化峰的峰电位值分别为-0.15~-0.12 V和0.99~1.01 V,还原峰的峰电位值为-0.52~-0.54 V。随着扫描速率的增加,氧化峰和还原峰的峰形和峰数均不发生改变;氧化峰所对应的峰电位值向正电位方向有少许的移动,还原峰所对应的峰电位值向负方向移动。氧化还原峰对应的峰电流响应值随扫描速率的增加而增大。此外,O1和R1的电位差值ΔEp约为0.40 V,Ipa/Ipc的比值小于1,且该对峰明显不对称。由此说明,O1过程为不可逆过程。氧化峰O2并没有出现相对应的还原峰,说明该过程同样也为不可逆过程。
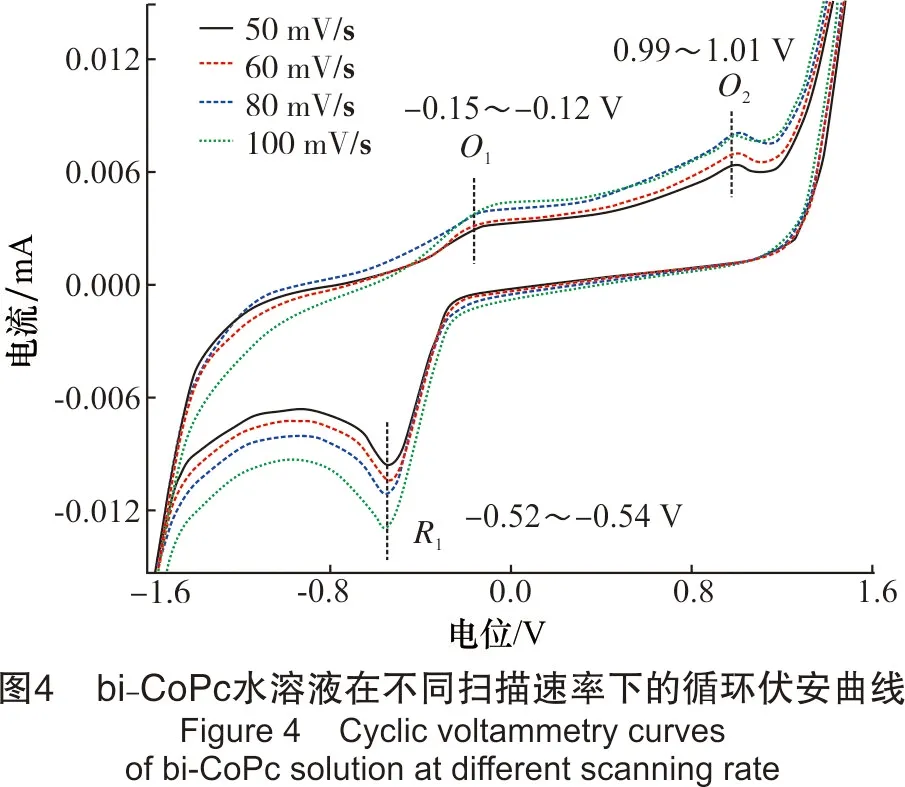
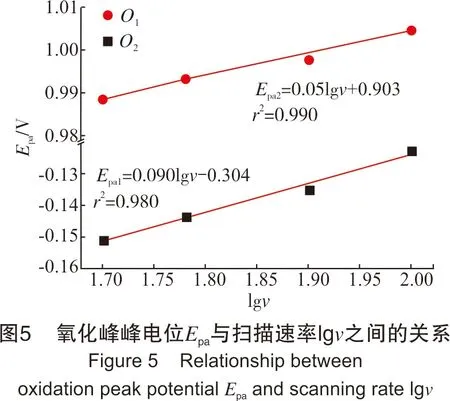
图5中氧化峰对应的峰电位值Epa与扫描速率lgυ线性关系良好,进一步说明bi-CoPc的氧化过程为不可逆过程。根据式(1)计算出氧化峰O1和氧化峰O2转移的电子数分别为0.6和1.2,取近似值均约为转移1个电子。根据Shumba M[16]报道酞菁钴修饰电极在pH值为7的碳酸缓冲盐溶液体系中通过循环伏安法分析得-0.40 V处的峰归属于Co2+/Co+的氧化还原峰;Komorskylovric S[17]报道在0.1 mol/L的Na2CO3溶液中,酞菁钴石墨电极上电位值在-0.50 V(相对于SCE电极)处的峰也归属于Co2+/Co+的氧化还原峰。因此推测,氧化峰O1对应于Co+/Co2+的过程,还原峰R1对应于Co2+/Co+的过程。由于bi-CoPc在水溶液中极易与OH-结合形成二聚体配合物[18]。因此,氧化峰O2可能对应于bi-CoPc与OH-形成配位的过程,反应式如式(Ⅸ):

(Ⅸ)
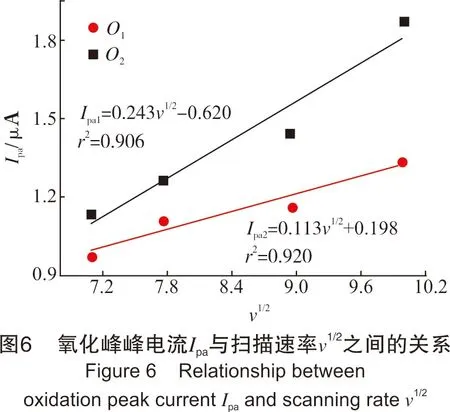
图6中氧化峰峰电流Ipa与扫描速率υ1/2呈线性关系,说明bi-CoPc的氧化过程受浓度扩散控制。
综合上述分析得出,氧化峰O1对应于Co+/Co2+的过程;还原峰R1可能对应于Co2+/Co+的过程;氧化峰O2对应于配合物bi-Co(II)Pc (OH)的形成过程。
2.2.2 bi-CoPc在碳酸盐缓冲溶液中的循环伏安行为实际脱硫体系是在碳酸盐缓冲溶液中进行的,故该部分考察了bi-CoPc在碳酸盐缓冲溶液中的循环伏安行为。浓度为9.82 μmol/L,pH值为8.80,扫描速率分别为50 mV/s、60 mV/s、80 mV/s、100 mV/s,结果见图7。
从图7可以看出,当扫描速率为50~100 mV/s时,bi-CoPc循环伏安图中在-0.16~-0.13 V处出现有1个微弱的氧化峰,在1.37~1.40 V处有1个明显的氧化峰,且在-0.41~-0.42 V处有1个明显的还原峰,在-1.54~-1.56 V处有1个微弱的还原峰。随着扫描速率的增加,氧化峰和还原峰的峰形和峰数都不发生改变,且各氧化还原峰相对应的峰电位值有少许移动;峰电流响应值随扫描速率的增加而增加,其中,氧化峰O2所对应的峰电流响应值随扫描速率的增加变化尤为明显。
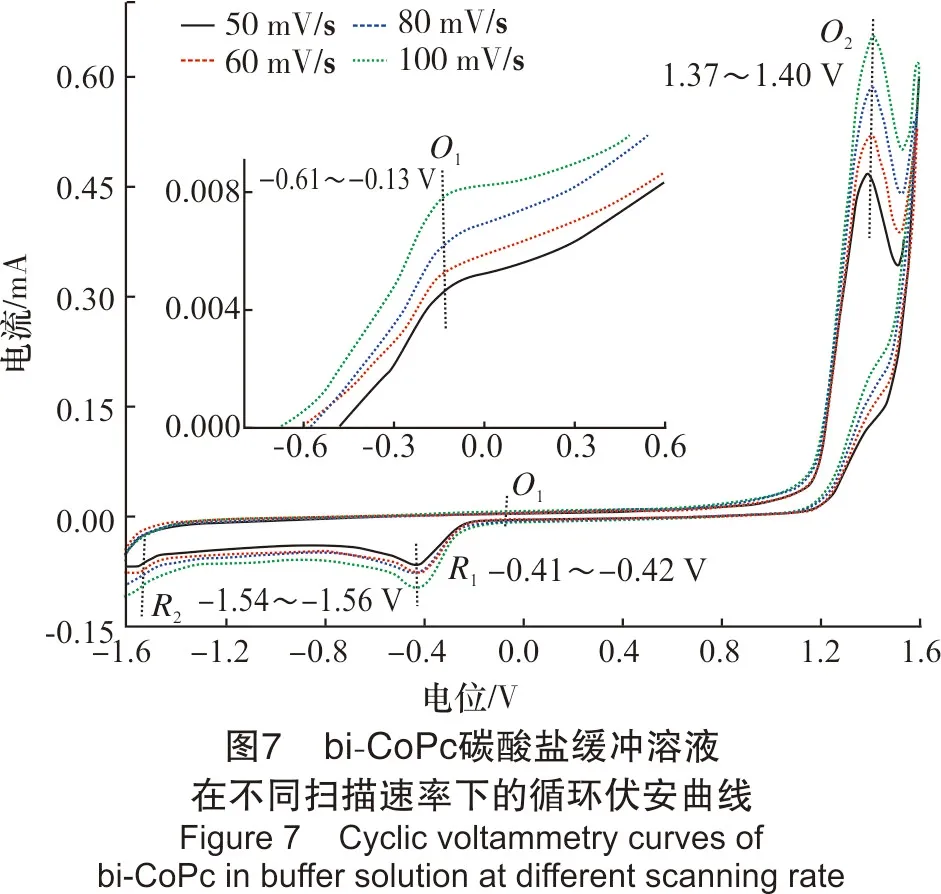
结合图4中峰的归属情况,将氧化峰O1归属为Co+/Co2+过程,还原峰R1对应于Co2+/Co+的过程,该对氧化还原峰的电位差约为0.29 V,远远大于90 mV,说明Co2+/Co+的反应过程为不可逆过程;氧化峰O2可能对应于bi-Co(II)Pc(OH)的形成过程,还原峰R2对应于bi-Co(II)Pc(OH)的解离过程。
将图7与图4进行对比发现,bi-CoPc缓冲体系相对于水体系,在同一扫速下,氧化峰O1的峰电位向更负电位方向移动,还原峰R1的峰电位向正方向移动,说明碳酸盐缓冲溶液的加入使得Co+/Co2+的氧化还原反应更易发生。同时,氧化峰O2的峰电位向更正的方向移动了约0.39 V,且出现了1个新的还原峰R2,说明碳酸盐缓冲溶液的加入,使得bi-CoPc与OH-形成配位的反应更难进行,同时,生成的配合物在该体系下可发生解聚。
2.3 Na2Sx溶液的循环伏安行为
该部分以浓度1.2×10-3mol/L、pH值10.80的Na2Sx溶液为研究对象,考察了不同扫描速率对循环伏安行为的影响。扫描速率分别为20 mV/s、50 mV/s、60 mV/s、80 mV/s和100 mV/s,结果见图8。
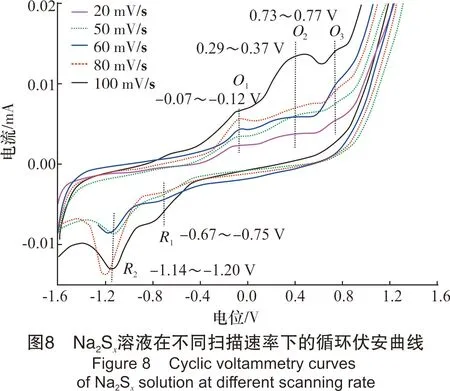
从图8可以看出,扫描速率为20~100 mV/s时,Na2Sx溶液在玻碳电极上有3个氧化峰和2个还原峰。其中氧化峰的位置分别为-0.07~-0.12 V、0.29~0.37 V和0.73~0.77 V;还原峰的位置分别为-0.67~-0.75 V 和-1.14~-1.20 V。随着扫描速率的增加,峰数不发生变化,但峰形变得更加突出,其中氧化峰O2和还原峰R2变得尤为明显。同时,氧化峰和还原峰所对应的峰电流响应值也随着扫描速率的增加而增加。此外,氧化峰所对应的峰电位值随扫描速率的增加向正电位方向移动,还原峰所对应的峰电位随着扫描速率的增加向负电位方向移动。
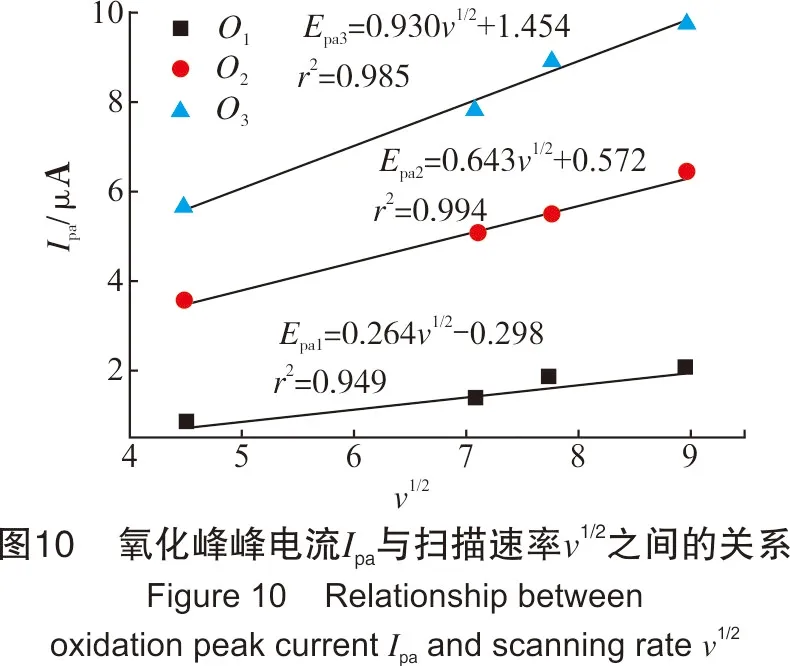
从图9中可看出,氧化峰O1、氧化峰O2与氧化峰O3的峰电位值与扫描速率lgυ呈线性关系。同时,从图8也可看出,Na2Sx溶液的氧化还原峰并不对称,因此得出Na2Sx溶液在玻碳电极上的氧化过程为不可逆过程。根据式(1),当取α值为0.5时,氧化峰O1、氧化峰O2和氧化峰O3对应的转移电子数分别为0.76、0.83、0.92,约为转移1个电子。同时,在实验过程中观察到玻碳电极表面有1层薄膜附着,进而说明有S8生成。故O1可能发生的反应如式(Ⅹ)。
(Ⅹ)
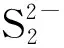
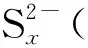
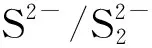
2.4 bi-CoPc与Na2S反应的循环伏安行为
上述实验说明,扫描速率的改变通常会引起峰电位的移动。同时,扫描速率增大,峰电流响应值增强,更有利于峰的辨别;因此,该实验研究了扫描速率为100 mV/s时,bi-CoPc与Na2S在缓冲盐体系中的反应过程,其中bi-CoPc的浓度为9.82 μmol/L,Na2S的浓度为0.02 mol/L,溶液pH值为10.24,实验时将溶液混合均匀后,立即开始扫描,结果见图11。
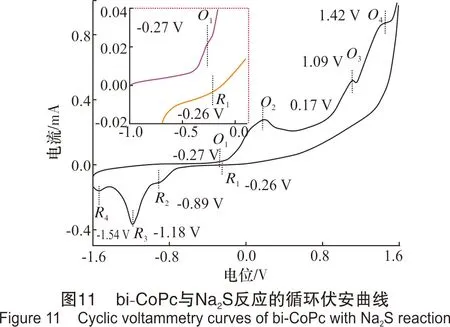
从图11可以看出,bi-CoPc与Na2S反应体系的循环伏安曲线中,在O1(-0.27 V)处出现1个微弱的氧化峰,在O2(0.17 V)、O3(1.09 V)和O4(1.42 V)处分别出现1个明显的氧化峰,且氧化峰O2的峰形较宽。在R1(-0.26 V)、R2(-0.89 V)、R3(-1.18 V)和R4(-1.54 V)处均有还原峰出现,且R3的峰尤为明显。
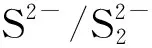
(1) Na2S溶液水解产生HS-,且在pH值为9~12时主要以HS-形式存在。
S2-+H2O=HS-
(Ⅺ)
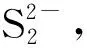
(Ⅻ)
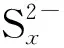
(4) 单质硫S8的形成。
(ⅩⅢ)
(5) bi-CoPc在碳酸盐缓冲溶液中与OH-结合发生聚合与解聚,见式(Ⅸ)。
3 结论
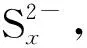
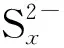
(3) bi-CoPc在水溶液中易与OH-结合形成配合物,但碳酸盐缓冲溶液的加入可抑制配合物的形成。此外,在缓冲盐溶液中,Co+/Co2+的氧化还原反应更容易发生,因PDS脱硫通常使用碳酸盐缓冲溶液作为介质,更能使bi-CoPc保持高的催化活性。