上调BRMS1基因抑制IL-6受体表达调控鼻咽癌细胞增殖和转移的机制研究
2019-09-03刘国红张国顺
邢 兵 刘国红 张国顺
(河南护理职业学院,安阳 455000)
鼻咽癌是一种来源于鼻咽部黏膜上皮的恶性肿瘤,是我国头颈部常见的恶性肿瘤之一,发病隐匿,易侵袭和转移,恶性程度较高[1]。鼻咽癌的发生发展是多种因素、多种途径、多种机制、多种基因等相互积累、综合作用的结果[2]。寻找鼻咽癌特异的分子靶标,对于其早期诊断及治疗具有重要意义。乳腺癌转移抑制基因1(Breast cancer metastasis suppr-essor 1,BRMS1)是研究者在乳腺癌研究中发现的一个癌转移抑制基因,近年来越来越多研究表明,BRMS1有抑制肿瘤转移的作用。有研究显示,胃癌、非小细胞肺癌、肝癌等多种肿瘤中BRMS1均有抑制癌细胞转移的功能[4-6]。鼻咽癌组织及细胞BRMS1呈现低表达,其低表达可促进癌细胞转移,且低表达患者预后不良[7];miR-346 可靶向BRMS1促进鼻咽癌细胞侵袭和迁移能力[8]。但BRMS1对鼻咽癌增殖和转移的机制研究尚未明确。IL-6是一个分子量为21~26 kD的糖蛋白,近年大量研究表明,IL-6在多种肿瘤中呈现异常表达,可通过与自身靶细胞的IL-6受体结合调节肿瘤发生发展[9]。BRMS1是否可调节IL-6受体影响鼻咽癌细胞增殖和转移尚未明确。因此,本研究旨在探讨上调BRMS1基因是否可通过抑制IL-6受体影响鼻咽癌细胞增殖和转移能力。以期为BRMS1在鼻咽癌诊疗及研究中提供理论基础。
1 材料与方法
1.1 材料 人鼻咽癌SUNE-1细胞购自美国ATCC。RPMI 1640培养基、胎牛血清(FBS)均购自美国Gibco;MTT、DMSO均购自美国Sigma;BCA蛋白浓度测定试剂盒、RIPA均购自上海碧云天生物技术研究所;Transwell小室购自美国BD;BRMS1、IL-6、IL-6R、增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)、钙黏附素-E(E-cadherin)、波形蛋白(Vimentin)、STAT3和p-STAT3抗体均购自美国CST;酶联免疫检测仪购自美国Biotek;质粒购自上海索宝生物科技有限公司;LipofectamineTM2000试剂盒购自北京宜科思源科技有限公司;BALB/c裸鼠购自浙江中医药大学动物实验研究中心。
1.2 方法
1.2.1 细胞培养 SUNE-1细胞常规复苏后,用含10% FBS的新生牛血清及青链霉素双抗的RPMI-1640培养基,在37℃、5%体积分数CO2培养箱中培养。细胞达80%生长融合时进行传代。
1.2.2 转染 实验分组:空白组(未转染的细胞)、pcDNA3.1组和pcDNA3.1-BRMS1。转染前1 d,将生长状态良好的SUNE-1细胞以5×105个/孔密度接种至6孔板中,每孔2 ml,在37℃、5%体积分数CO2培养箱中静置培养,使转染时的细胞长至80%~90%。转染使用LipofectamineTM2000试剂盒进行瞬时转染,方法参照试剂盒说明。制备脂质体与pcDNA3.1复合物,将复合物加入6孔板相应的孔内,轻摇混匀,培养箱内常规孵育5~6 h,换为含血清的完全培养基继续培养。48 h后,通过Western blot检测转染效率。
1.2.3 Western blot 收集转染48 h的SUNE-1细胞,加适量含蛋白酶抑制剂的RIPA细胞裂解液,于冰上裂解30 min,离心,吸取上清液,上清液即为提取的总蛋白。BCA法检测蛋白浓度。蛋白与上样缓冲液按照1∶3比例混匀,沸水煮沸变性5 min。取变性蛋白上样,每孔道40 μg,经SDS-PAGE、转PVDF膜及5%脱脂奶粉封闭,TBST液稀释一抗,将膜与一抗溶液一同封闭于塑料袋中,37℃水浴1 h后4℃冰箱过夜,次日,弃去一抗,TBST洗膜,加TBST液稀释的HRP标记的二抗,室温摇床孵育1~2 h,TBST洗膜,加ECL发光液,暗盒中用X光胶片曝光,拍照。Quantity one软件分析扫描蛋白条带的光密度数据。目的蛋白与内参GAPDH光密度比值即为蛋白的相对表达量。实验重复3次。
1.2.4 MTT法检测细胞活力 胰酶消化生长至对数期的SUNE-1细胞,完全培养基重悬细胞,制备成细胞悬液,以5×103个/孔密度接种细胞于96孔板,细胞达70%~80%生长融合度时,按照1.2.2方法转染,每组设置5个重复孔,转染24、48和72 h时,每孔加10 μl 5 mg/ml的MTT溶液,常规培养4 h,吸弃培养液,在每孔中加入150 μl的DMSO溶液终止反应,摇床低速振荡10 min,使结晶能够溶解充分。酶联免疫检测仪测定各孔在490 nm波长的吸光度值(A)。取均值,绘制细胞生长曲线。实验重复3次。
1.2.5 Transwell法检测细胞迁移能力 预先将实验组及对照组的SUNE-1细胞在37℃、5%体积分数CO2培养箱中培养24 h,以备次日实验使用。Transwell小室套入24孔板,上室中加不含血清的培养液200 μl,37℃放置1 h。无血清培养基洗涤、胰酶消化及重悬细胞后,将细胞浓度调整为2.5×105ml-1。Transwell小室上室加入200 μl的细胞悬液,Transwell小室下室中加入500 μl含10% FBS的培养基。培养箱内继续培养18~24 h,取出小室,PBS溶液洗涤,4%多聚甲醛固定20 min,1%结晶紫染色30 min。光学显微镜(×200)随机选择5个视野(上、中、下、左和右),进行细胞计数,取每个视野均值。实验重复3次。
1.2.6 裸鼠成瘤实验 将18只6周、体重20~24 g 的雄性无胸腺BALB/c裸鼠随机分为3组进行成瘤实验。将空白组、NC组和pcDNA3.1-BRMS1组细胞分别培养于6孔板中,PBS清洗,最终1 ml PBS含有悬浮细胞1×108个。每只鼠皮下注射悬浮细胞 100 μl,接种后定期观察肿瘤生长情况,每周测定1次,并记录肿瘤体积。4周后将鼠处死取材,测量肿瘤体积及肿瘤组织PCNA、E-cadenin、Vimentin、STAT3和p-STAT3的蛋白表达。实验过程严格按照动物保护机构的使用准则执行,每项结果均使动物伤害降至最低。

2 结果
2.1 转染pcDNA3.1-BRMS1的鼻咽癌细胞BRMS1、IL-6和IL-6R表达 如图1和表1所示,pcDNA3.1-BRMS1转染鼻咽癌细胞48 h,BRMS1蛋白表达明显升高,IL-6和IL-6R蛋白表达均明显降低,与空白组比较差异有统计学意义(P<0.05),而pcDNA3.1组BRMS1、IL-6和IL-6R表达与空白组差异无统计学意义(P>0.05)。

图1 Western blot检测转染pcDNA3.1-BRMS1的鼻咽癌细胞BRMS1、IL-6和IL-6R蛋白表达Fig.1 Expression of BRMS1,IL-6 and IL-6R were detec-ted in nasopharyngeal carcinoma cells transfected with pcDNA3.1-BRMS1 by Western blot
表1 BRMS1、IL-6和IL-6R的蛋白相对表达量
Tab.1 Relative protein expression of BRMS1,IL-6 and IL-6R

GroupsBRMS1IL-6IL-6RBlank0.032±0.0050.091±0.0100.172±0.018NC0.026±0.0040.085±0.0080.203±0.020pcDNA3.1-BRMS10.322±0.0281)0.042±0.0051)0.066±0.0071)F312.27634.01660.089P0.0000.0010.000
Note:1)P<0.05 vs blank group.

图2 上调BRMS1表达对鼻咽癌细胞活力的影响Fig.2 Effect of up-regulation of BRMS1 expression on nasopharyngeal carcinoma cell viabilityNote: *.P<0.05 vs blank group.
2.2 上调BRMS1表达可抑制鼻咽癌细胞活力 如图2所示,pcDNA3.1-BRMS1转染鼻咽癌细胞24、48和72 h,细胞活力均明显降低,与空白组比较差异有统计学意义(P<0.05 )。
2.3 上调BRMS1表达可抑制鼻咽癌细胞迁移能力 如表2所示,pcDNA3.1-BRMS1转染鼻咽癌细胞48 h,细胞侵袭能力明显降低,与空白组比较差异有统计学意义(P<0.05 )。
2.4 上调BRMS1表达对鼻咽癌细胞增殖及上皮间质转化(Epithelial-mesenchymal transition,EMT)相关蛋白表达的影响 如图3和表3所示,与空白组比较,pcDNA3.1-BRMS1组PCNA和Vimentin表达明显降低,E-cadenin表达明显升高(P<0.05)。
2.5 上调BRMS1表达可抑制鼻咽癌细胞STAT3信号通路 如图4和表4所示,与空白组比较,pcDNA3.1-BRMS1组中p-STAT3蛋白表达明显降低(P<0.05),3组间STAT3蛋白表达差异无统计学意义(P>0.05)。
2.6 上调BRMS1表达可抑制鼻咽癌小鼠模型肿瘤生长 如图5A所示,从第3周起,pcDNA3.1-BRMS1组小鼠肿瘤体积与空白组肿瘤体积有较大差异,差异有统计学意义(P<0.05)。Western blot检测第4周小鼠肿瘤组织PCNA、E-cadenin、Vimen-tin、STAT3和p-STAT3的蛋白表达,结果图5B和表5所示,与空白组比较,pcDNA3.1-BRMS1组PCNA、Vimentin和p-STAT3表达均明显降低,E-cadenin表达明显升高(P<0.05),3组间STAT3蛋白表达差异无统计学意义(P>0.05)。
表2 上调BRMS1表达对鼻咽癌细胞迁移能力的影响
Tab.2 Effect of up-regulation of BRMS1 expression on migration of nasopharyngeal carcinoma cells

GroupsCell invasionBlank222.3±11.4NC219.7±10.6pcDNA3.1-BRMS1152.8±8.11)F45.364P0.000
Note:1)P<0.05 vs blank group.

图3 Western blot检测pcDNA3.1-BRMS1转染后鼻咽癌细胞增殖及EMT相关蛋白表达Fig.3 Proliferation- and EMT-related protein expression of nasopharyngeal carcinoma cells transfected with pcDNA3.1-BRMS1 were detected by Western blot
表3 PCNA、E-cadenin和Vimentin的蛋白相对表达量
Tab.3 Relative expression of PCNA,E-cadenin and Vim-entin protein

GroupsPCNAE-cadeninVimentinBlank0.613±0.0560.078±0.0090.333±0.036NC0.522±0.0580.084±0.0100.352±0.031pcDNA3.1-BRMS10.341±0.0391)0.257±0.0241)0.106±0.0121)F21.511122.86570.225P0.0020.0000.000
Note:1)P<0.05 vs blank group.
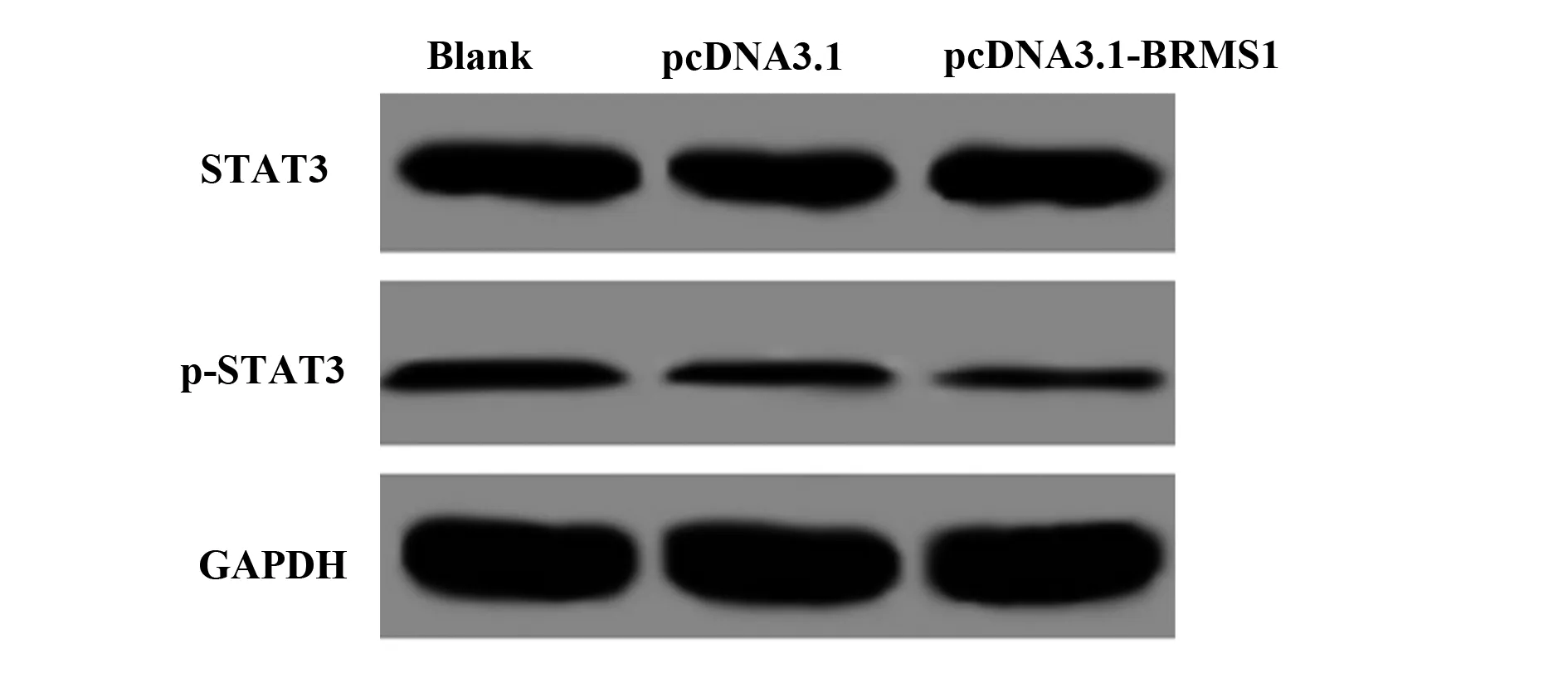
图4 pcDNA3.1-BRMS1对鼻咽癌细胞STAT3信号通路的影响Fig.4 Effects of pcDNA3.1-BRMS1 on STAT3 signaling pathway in nasopharyngeal carcinoma cells
表4 STAT3和p-STAT3的蛋白相对表达量
Tab.4 Relative protein expression of STAT3 and p-STAT3

GroupsSTAT3p-STAT3Blank0.472±0.0510.089±0.012NC0.452±0.0460.063±0.010pcDNA3.1-BRMS10.485±0.0530.021±0.0041)F0.33140.754P0.7310.000
Note:1)P<0.05 vs blank group.

图5 pcDNA3.1-BRMS1对鼻咽癌小鼠肿瘤生长及肿瘤组织STAT3信号通路蛋白表达影响Fig.5 Effects of pcDNA3.1-BRMS1 on tumor growth and expression of STAT3 signaling pathway protein in nasopharyngeal carcinoma mice
表5 PCNA、E-cadenin、Vimentin、STAT3和p-STAT3的蛋白相对表达量
Tab.5 Relative protein expression levels of PCNA,E-cadenin,Vimentin,STAT3 and p-STAT3

GroupsSTAT3p-STAT3PCNAE-cadeninVimentinBlank0.543±0.0470.066±0.0080.412±0.0380.073±0.0100.302±0.026NC0.531±0.0420.071±0.0080.405±0.0340.068±0.0080.294±0.023pcDNA3.1-BRMS10.556±0.0480.023±0.0051)0.162±0.0201)0.339±0.0381)0.183±0.0211)F0.22440.96160.799134.53524.191P0.8060.0000.0000.0000.001
Note:1)P<0.05 vs blank group.
3 讨论
恶性肿瘤的发病率越来越高,给人类的生命健康造成严重威胁。转移是恶性肿瘤独有生物学特性,也是肿瘤致死的一个主要原因[10]。转移发生是一个多基因、多阶段、多因素参与调控的复杂过程,目前发现的单独负责肿瘤转移的基因较少。鼻咽癌是常见的恶性肿瘤之一,局部复发和转移是其治疗失败的主要原因[11]。因此,从因子方向寻找治疗肿瘤转移的途径具有重要意义。BRMS1是一个肿瘤转移抑制基因,定位于人11q13.1~13.2染色体,与多种肿瘤的侵袭、转移及预后密切相关[12]。临床研究分析表明,BRMS1基因低表达患者预后及生存率明显低于高表达患者[13]。黑色素瘤、乳腺癌等肿瘤细胞转染BRMS1可明显抑制癌细胞的转移能力[14,15];干扰BRMS1表达可促进卵巢癌等肿瘤细胞的侵袭和转移能力[16]。以上研究提示BRMS1在肿瘤转移中具有重要作用。
IL-6是一种多功能的调控分子,参与多种肿瘤细胞生长和分化过程[17]。已有研究显示,IL-6及其受体在鼻咽癌、肝癌、肺癌等多种肿瘤中均存在上调表达,血清IL-6表达与肿瘤预后相关[18-20]。因此,有很多研究推测,恶性肿瘤可通过影响生物体微环境变化,诱导炎症反应,进而激活相关信号通路,从而影响肿瘤进展。有研究显示,IL-6上调可激活结肠癌细胞STAT3磷酸化过程,增加内皮细胞增殖和分化[21];人鼻咽癌基因可通过抑制NF-κB和STAT3信号通路抵抗IL-6对鼻咽癌发生发展的促进作用[22];IL-6R的靶向抗体和JAK1/STAT3信号通路可抑制多种肿瘤的进展[23]。以上研究提示,抑制IL-6、IL-6R及STAT3信号通路可减缓肿瘤进展。BRMS1是否可影响IL-6、IL-6R及STAT3信号通路尚未清楚。本研究结果显示,上调BRMS1表达可抑制鼻咽癌细胞IL-6、IL-6R及p-STAT3表达,抑制细胞的活力和迁移能力。提示上调BRMS1表达可通过抑制IL-6、IL-6R及STAT3信号通路降低鼻咽癌细胞生长。
STAT3是JAK/STAT家族重要成员,在人类正常组织活性中受严格控制,在多种肿瘤中被激活,其激活可进一步促进增殖、侵袭、迁移等下游相关功能基因表达,从而引起肿瘤的发生发展[24]。PCNA是反映细胞增殖的一个重要指标,在多种恶性肿瘤中均呈现阳性表达,其表达可促进肿瘤进展[25]。EMT参与肿瘤的生长和转移,EMT产生时,E-cadherin等上皮细胞标志蛋白减少,Vimentin、N-cadherin等间质细胞标志蛋白呈现过表达[26]。已有研究表明,抑制EMT可降低鼻咽癌细胞的侵袭和迁移能力[27];滞蛋白(CulLIN)可通过靶向BRMS1促进乳腺癌细胞转移和EMT[28]。本研究结果显示,上调BRMS1表达可下调PCNA和Vimentin表达,上调E-cadherin表达。裸鼠成瘤实验也表明上调BRMS1表达可下调PCNA和Vimentin表达,上调E-cadherin表达,这一结果提示BRMS1对鼻咽癌增殖转移的影响机制可能与抑制IL-6、IL-6R及STAT3信号通路、进而抑制PCNA表达及EMT有关。
综上所述,上调BRMS1表达可抑制IL-6受体,下调STAT3信号,进而抑制鼻咽癌细胞的增殖和转移能力。本研究为BRMS1在鼻咽癌机制研究中提供了一定的理论基础。
