永生化肝脏前体样细胞可用于生物人工肝治疗的研究
2019-09-02李伟建王振宇袁天杰景宏舒代孟君彭媛鄢和新翟博
李伟建 王振宇 袁天杰 景宏舒 代孟君 彭媛 鄢和新 翟博
生物人工肝(bioartificial liver,BAL)可以暂时替代肝脏发挥相应的功能。种子细胞是BAL的核心,目前用于BAL的细胞有人原代细胞、C3A、猪肝细胞、诱导分化肝细胞等。但是由于种种原因,BAL临床推进缓慢,因此急需寻找到用于生物人工肝的新种子细胞。2018年,在前期的小鼠肝前体样细胞(HepLPC)可逆转化的基础上通过小分子组合将人原代细胞转化为前体样细胞,实现人原代肝细胞体外快速增殖[1]。本实验对前体样细胞进行永生化并进行功能验证,寻找新的用于生物人工肝治疗的细胞,为临床生物人工肝治疗提供参考。
资料与方法
一、材料与试剂
肝脏组织标本来自上海交通大学医学院附属仁济医院肿瘤介入科患者血管瘤旁组织。DMEM/F12购自美国Invitrogen公司;N-2 无血清添加剂、100X和B-27 无血清添加剂、50X以及双抗购自上海源培生物科技股份有限公司;Trizol和Sybgreen购自上海碧云天生物科技公司;FBS购自于BI公司;相关引物合成自上海华津生物。HGF、EGF、Y27632、CHIR99021、A83-01购自于美国TargetMol公司;0.25% T/E购自上海源培生物科技股份有限公司;Large T抗原慢病毒购自吉凯基因。
二、实验方法
(一)人原代细胞的分离与纯化与培养 血管瘤旁切除(1~5 g)正常肝组织,通过改良的两步胶原酶灌注法分离原代人肝细胞,荧光激活细胞分选术(FACS)纯化肝细胞以排除CD24 +或EpCAM +阳性祖细胞获得HepLPC[1-2]。将细胞以0.5~2×104cells/cm2接种在有Matrigel(约0.87 μL/cm2)包被的培养皿上,采用增殖与扩增培养基(TEM)培养,接种后6~12 d,用0.25%T/E消化重悬后以1∶3~6的比例传代,每隔24 h更换1次培养基。将1 000个细胞接种在6孔Matrigel包被的平板上,用0.25%T/E消化后在指定的天数进行细胞计数。
(二)永生化的建立 2~3×105cells/孔的浓度接种于用Matrigel铺板后的6孔板中, 24 h后待细胞汇合率到达80%时开始永生化的建立。MOI=20加入慢病毒Large T antigen(约50 μL/孔)转染细胞,加入8 μg Polybrene增强感染效果。感染8 h后更换培养基,转染病毒72 h后,以1∶1 000加入腺嘌呤素(puro)至TEM培养进一步筛选成功转染细胞。24~48 h后换TEM培养基,并重新传代至已用Matrigel铺板的6孔板。细胞以1∶3的密度稳当细胞传代超过20代的一般认为永生化建系成功。永生化建立过程中注意对细胞冻存与复苏进行保种,同时进行细胞计数。
(三)细胞分化 将3×105iHepLPC接种到Matrigel包被好的6孔板中,增殖1~2 d,直至达到90%以上的细胞覆率。然后更换为M7分化培养基分化7 d。
(四)实时PCR 使用Trizol试剂从培养的细胞中提取RNA,进行反转录,得到cDNA使用7 300实时PCR系统,Sybgreen并以GAPDH为内参进行内部控制计算相关基因的表达量。PCR系统设置参数为20 μL体系,95℃ 5 min,95℃ 15 s、60℃ 15 s、72℃ 35 s,共40个循环;循环后使用机器默认程序进行熔解曲线采样。后按照△△CT方式进行数据分析,每个样本重复3次。引物序列见表1。

表1 引物序列
(五)尿素生成 iHepLPC培养基中加入3 mmol NH4Cl,24 h后吸取细胞上清,3 000 rpm离心5 min去除沉淀,检测细胞上清中的NH4+的含量,从而判定iHepLPC细胞的氨清除速率。尿素含量检测方法按试剂盒说明书进行。
(六)白蛋白ELISA 细胞更换培养基后24 h收集上清,3 000 r/min离心5 min去除沉淀,培养液中的白蛋白和AAT分别用人白蛋白ELISA试剂盒和人AAT ELISA试剂盒进行检测,操作按照试剂盒内说明书进行。
(七)急性肝衰竭小猪血浆以及对细胞的功能反应 采用0.5 g/kg氨基半乳糖氨(D-gal)诱导小猪急性肝衰竭,24 h后小猪出现ALF的相关症状与体征,血氨、出凝血以及肝肾功能达到急性肝衰竭指标。取小猪血液,4 500 r/min离心15 min,收集上清作为急性肝衰竭血浆-80℃保存备用。将细胞分化培养基更换成急性肝衰竭血浆,反应6 h,计算细胞活率,同时验证细胞的功能基因以及合成与解毒功能。
三、统计学处理
使用软件GraphPad Prism 7。数值均以均值±标准差表示,两组数据比较使用Student′sttest。使用One-way analysis of variance (ANOVA)进行3组及以上的比较。P<0.05为差异有统计学意义。
结 果
一、HepLPC细胞永生化建立
选取Passage 0~20的细胞,每间隔10代观察细胞形态和细胞计数,增殖过程中细胞之间的形态保持一致,无任何改变,每间隔10代还具有相似的增殖速度,说明永生化细胞建立成功,见表2。在增殖过程中对细胞的反应合成,尿素生成,药物代谢Alb,AAT,CPS1,CYP3A4等主要肝功能基因做检测,每个代次之间表达量保持稳定。
尿素生成是反应器肝细胞解毒功能的主要指标,对每10代次的细胞进行尿素生成的检验。发现细胞每个代次之间的尿素生成保持稳定。白蛋白分泌是肝细胞特有的功能,不同代次之间白蛋白分泌稳定。说明Large T永生化保持细胞的合成与解毒功能也相对稳定。见表3。
二、采用分化培养基M7对iHepLPC进行分化
iHepLPC细胞建立好后进行分化,分化以后肝脏功能基因有了显著上调。同时检测了M7分化以后的iHepLPC细胞的尿素生成,Alb分泌水平,发现合成与解毒功能有了显著的提高。见表4。
三、小猪急性肝衰竭血浆对细胞毒性实验
分化后iHepLPC细胞的活率逐渐降低,6 h后细胞活率降到50%左右(图1A),但是反映细胞解毒功能的尿素生成不断增加(图1B),同时Alb分泌水平随着时间而不断增加(图1C),这说明分化后iHepLPC对于肝衰竭血浆不仅具有一定的耐受性还发挥解毒与合成功能。

表2 不同代次细胞的增殖能力比较(±s)

表3 不同代次间细胞功能基因和尿素生成、白蛋白比较(±s)

表4 分化前后功能基因、尿素,白蛋白比较(±s)
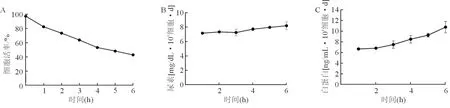
图1急性肝衰竭血浆对分化后iHepLPC的影响 A:急性肝衰竭血浆对分化后iHepLPC活率的影响;B:急性肝衰竭血浆对分化后iHepLPC尿素合成;C:急性肝衰竭血浆对分化后iHepLPC白蛋白合成分泌变化
讨 论
种子细胞是生物人工肝支持系统的灵魂,细胞功能的好坏直接关系到生物人工肝的治疗效果。人肝母细胞瘤细胞系C3A虽然具有蛋白分泌功能,然而它们缺乏尿素循环的相关基因,表现出尿素生成和氨清除能力下降[3]。体外肝脏辅助装置(ELAD)可测试C3A细胞的功能,然而,装载有C3A细胞的ELAD系统的临床疗效有限,不能显著延长患者的生存期[4]。将人原代肝细胞转化为永生化前体样细胞(iHepLPC)可使人原代肝细胞实现体外快速多代次的增殖。常见的人肝细胞永生化的方法有Large T antigen、hTERT、Cre-loxp等[5]。Large T antige抑制pp2A的磷酸酶活性,实现细胞的无限增殖。本研究采用Large T antige对HepLPC进行永生化,对不同代次的细胞进行检测,发现细胞的增殖速度、形态、功能基因以及合成解毒功能保持一致。Large T antige建立的永生化细胞成熟且稳定,获得尿素生成功能强的细胞,在后期的BAL应用中可以减轻患者肝性脑病的症状。
对于建系好的iHepLPC进行分化,发现细胞功能可以进一步提高,细胞分化是促进成熟,提高功能的又一有效办法。分化后的细胞具有更加规则的细胞形态,同时解毒与合成功能有了显著提高。值得提出的是,iHepLPC具有极强的尿素生成与氨清除能力,用于BAL可以显著减轻肝性脑病的症状和体征。
细胞在生物人工肝内发挥需要验证其对ALF血浆的耐受性以及在ALF血浆中的解毒与合成能力。结果显示虽然ALF血浆对iHepLPC有一定的损伤,但是随着时间的变化细胞在血浆中发挥一定的解毒与合成功能。
综上所述,永生化后的iHepLPC不仅可以快速无限增殖还可以在ALF血浆中发挥解毒与合成功能,其可以成为新的生物人工肝种子细胞。
iHepLPC在ALF血浆体现一定的治疗效果,对于慢加急性肝衰竭的治疗效果还需要进一步验证。慢加急性肝衰竭是比较常见的肝衰竭,扩大iHepLPCs的应用范围,造福广大肝衰竭患者[6, 7]。本实验采用单一的细胞治疗,可以与MSC以及HUVEC共培养提高细胞功能,验证共培养对ALF血浆的效果[8]。
iHepLPC在小猪ALF血浆实验上体现出良好的治疗效果,然而机体是一个复杂的系统,接下来需要验证其在急性肝衰竭ALF小猪的治疗效果。通过动物实验研究,验证其对ALF具有一定的治疗效果,为临床试验做准备。希望新的细胞源可以为广大ALF患者带来福音。
