雷尼铜制备的多孔氧化铜催化剂的结构与性能
2019-09-02吴佳佳鲁树亮刘海江马天石
吴佳佳,王 育,鲁树亮,刘海江,马天石
(中国石化 北京化工研究院,北京 100013)
雷尼催化剂最早由Raney 在20 世纪20 年代发现[1-2]。雷尼催化剂呈海绵状结构,含有大量的裂隙和孔隙,对于加氢反应而言,这种结构增加了活性氢的数目,降低了吸附氢的活性,可同时提高催化剂的加氢活性及选择性[3]。Ni,Co,Cu 等金属制成雷尼催化剂后,可以代替贵金属催化剂的使用。近十几年来,研究者在雷尼催化剂的制备、表征和改性等方面做了大量的工作,提高了它在反应中的活性和选择性[4-6]。此外,雷尼催化剂本身的海绵状结构即为优异的模板,氧化后可得到海绵状的多孔氧化物。多孔以及纳米组成是制备催化剂的两个前提,因此该方法可能是制备多孔氧化物催化剂的一种新方法。
目前,工业上通常采用共沉淀制备的铜氧化物脱除微量CO[7-20],而利用雷尼铜作为模板制备铜氧化物催化剂的方法还鲜有报道。这类铜氧化物的反应机理是物料中CO 与铜氧化物催化剂的晶格氧发生反应生成CO2,该反应为非催化气固相反应,不属于传统的催化反应[18]。随着高效聚合催化剂及聚合工艺的不断发展,对聚合级烯烃中CO 脱除深度的要求也越来越高[7-9]。20 世纪90 年代,中国石化北京化工研究院开发的CuO/ZnO 催化剂用于脱除气相乙烯中的微量CO,可将入口含量(质量分数,下同)小于等于5×10-6的CO 脱除至含量小于等于1×10-7。
本工作将雷尼铜在低温条件下氧化制备多孔CuO 催化剂,采用XRD,HRTEM,SEM,XPS,H2-TPR 等方法对催化剂进行了表征,选择深度脱除CO 作为探针反应来研究多孔CuO 催化剂脱除CO 的能力,并探讨了催化剂具有活性的原因。
1 实验部分
1.1 实验原料
NaOH,Cu(NO3)2,Zn(NO3)2,Na2CO3:分析纯,国药集团化学试剂有限公司;CuAl2合金:大连通用公司。
1.2 催化剂制备
多孔CuO 催化剂:将0.6 ~1.0 mm 的CuAl2合金50 mL 置于20%(w)的NaOH 溶液中,于90 ℃活化1 h 后,用去离子水洗涤至中性,然后置于烘箱中,于80 ~200 ℃氧化4 ~6 h 得到黑色多孔CuO 催化剂。
铜锌催化剂(CZ 催化剂):按照文献[21]的方法制备。将226 mL 1 mol/L 的Cu(NO3)2溶液和516 mL 1 mol/L 的Zn(NO3)2溶液混合均匀,将1 000 mL 1 mol/L 的Na2CO3溶液滴加到上述混合溶液中进行沉淀,沉淀温度为80 ℃,pH 控制在9.5±0.5。在搅拌情况下,于80 ℃下老化2 h,过滤后用去离子水洗涤,在110 ℃下干燥12 h,然后于400 ℃下焙烧6 h,压片成型。其中,CuO 含量约为30.2%(w)。
1.3 催化剂的表征
采用美国Quantachrome 仪器公司Nova 3000e 型物理吸附仪测定试样的比表面积。采用荷兰Philips公司X’Pert MPD 型X 射线衍射仪表征催化剂的物性结构,Cu Ka射线,2θ 为20°~80°。采用英国Thermo VG 公司Sigma Probe 型X 射线光电子能谱仪测定试样的结合能。采用美国Micromertiecs 公司Autochem 2900 型全自动化学吸附仪对试样进行程序升温还原,还原气采用10%(φ)H2+90%(φ)N2混合气,流量为50 mL/min。采用美国FEI 公司XL-30 型场发射环境扫描电子显微镜与Tecnai 20 型高分辨透射电子显微镜测试催化剂的微观形貌。
1.4 催化剂的活性评价
微反应评价实验在不锈钢反应器内进行,反应器内径为8 mm,催化剂的装填量为25 mL。反应段设3 个测温点,分别测量催化剂床层上、中、下3个点的温度。原料为乙烯与CO 混合物。反应前后物料的组成用美国瓦里安公司CP3800 型色谱仪测试,配有Poraplot 填充柱、甲烷化炉、FID 和反吹柱系统。色谱柱可分离物料中的CO,CO2,CH4,C2H4,C3H6等,其中,C2H4或C3H6保留时间较长。为了提高分析速度,可在CO,CO2,CH4等组分出峰后通过柱反系统将其他组分反吹出来。由于FID 无法检测CO 和CO2,因此,待测物料需先经过CH4转化炉将其中的CO 和CO2转化成CH4,然后用FID 进行检测。该色谱仪CO 的最低检测限为1×10-7。当反应后物料中的CO 含量小于1×10-7时,可切换至美国Ametek 公司的TR3000A 型微量CO 分析仪进行分析,该仪器的CO 最小检测精度为1×10-10。催化剂的微反应评价装置见图1。经检测反应器入口物流中的CO 含量稳定在2.4×10-6左右开始反应,反应压力为2.0 MPa、反应温度为50 ~90 ℃、气态空速为3 000 ~10 000 h-1。
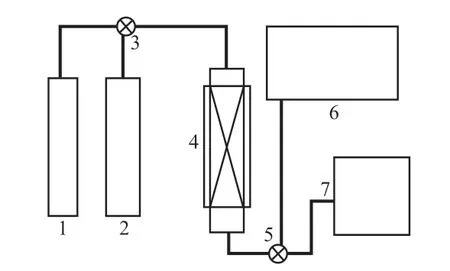
图1 微反应评价装置示意图Fig.1 Schematic diagram of micro-reactor for evaluation.1 Raw gas;2 N2;3,5 Three-way value;4 Reactor;6 Gas chromatograph;7 Trace CO analytic instrument

表1 催化剂的物性参数Table 1 Physicochemical parameters of catalyst
1.5 催化剂的物性参数
催化剂的物性参数见表1。
2 结果与讨论
2.1 表征结果
2.1.1 XRD 与HRTEM 表征结果
在雷尼铜的制备过程中,大部分Al 会在活化过程中生成铝酸盐,在后续的水洗过程中洗掉而得到疏松的铜骨架结构。Cu-Al 合金及其经过不同活化时间得到的产物的XRD谱图见图2。由图2可知,Cu-Al 合金的主要组成相为CuAl2相,2θ=20°,38°,42°,47°,61°,67°处均为CuAl2的衍射峰(JCPDS 卡片号为3-1079)。将Cu-Al 合金置于NaOH 溶液中,合金中的部分Al 会被抽提出来而形成具有多孔结构的雷尼铜,这一过程被称为活化。活化1 h 后可出现金属Cu 的衍射峰,即2θ=43°,51°,74°(JCPDS 卡片号为1-1241),且随着活化时间的延长,Cu 的衍射峰逐渐增强,CuAl2的峰逐渐减弱,活化时间为8 h,得到的产物主相为面心立方结构的Cu。
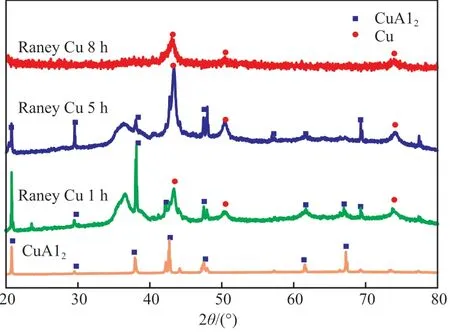
图2 Cu-Al 合金及其活化后产物的XRD 谱图Fig.2 XRD patterns of Cu-Al alloys and Raney Cu.
将活化1 h 后的雷尼铜在空气中低温氧化即可得到多孔氧化铜,不同氧化温度条件下得到的多孔CuO 的XRD 谱图见图3。由图3 可知,多孔CuO 催化剂主要以CuO 和Cu2O 组成。其中,2θ=35°,38°,48°,62°,66°,68°处均为CuO 的特征衍射峰(JCPDS 卡片号为5-661),而2θ=36°,48°,62°处则为Cu2O 的特征衍射峰(JCPDS 卡片号为5-667)。催化剂中的CuAl2衍射峰并不明显,是由于催化剂中CuO 的峰较强而掩盖了位于催化剂内核的CuAl2相的衍射峰。有研究认为,纳米Cu 的氧化过程是Cu—Cu2O—CuO,纳米Cu 的氧化反应不仅在热力学上是逐级反应,在动力学上也是逐级反应[22]。这是氧化后的催化剂中有Cu2O 峰出现的原因。随着反应温度的升高,Cu2O 继续反应生成CuO,多孔CuO 催化剂中的Cu2O 峰呈逐渐减弱的趋势,CuO 的峰逐渐增强。多孔CuO 催化剂的所有衍射峰都存在着一定程度的宽化,说明催化剂主要由纳米粒子组成,通过Scherrer公式计算得到晶粒大小分别为8.5,8.3,8.8,8.7 nm。这说明氧化温度为80 ~200 ℃时,得到的催化剂晶粒尺寸并没有发生明显变化。

图3 不同氧化温度条件下得到的多孔CuO 催化剂的XRD 谱图Fig.3 XRD patterns of multiparous CuO catalysts obtained at different oxidation temperature.
透射电子显微镜也能够证明催化剂纳米颗粒的存在。多孔CuO 催化剂的TEM 照片和HRTEM照片见图4。

图4 多孔CuO 催化剂的TEM 照片(a)和HTREM 照片(b)Fig.4 TEM image(a) and HTREM image(b) of the multiparous CuO catalyst.
由图4 可知,CuO 粒子为规则或不规则的立方状纳米结构,平均粒径在10 nm 左右,晶面间距为2.3 nm,对应CuO 的(111)晶面。
2.1.2 SEM 表征结果
多孔CuO 催化剂的SEM 照片见图5。由图5a和图5b 可知,多孔CuO 催化剂由枝状或疏松板状结构的微晶组成。由图5c 和图5d 可知,多孔CuO催化剂由粒径较大的颗粒组成,这些颗粒是由纳米CuO 聚集起来的,纳米CuO 的粒径为20 ~100 nm,催化剂表面存在着微小的不规则的裂缝,这些裂缝是在Cu-Al 合金的活化过程以及雷尼铜的氧化过程中形成的,它们的形状相当不规则,说明在雷尼铜和多孔CuO 形成的过程中,颗粒发生了收缩,这些空缺收缩成了裂缝,宽度为0.05 ~2 μm,但小裂缝更多。
将催化剂横断面剖开,通过面分布扫描法研究了催化剂的元素组成,多孔CuO 催化剂的SEM 照片及Cu,Al,O 元素的面分布见图6。由图6 可知,Cu 元素分散于整个横断面上,中间部分颜色衬度较低,表明中间部分的Cu 含量略低于催化剂横断面两侧的分布;由于衬度的原因,可以清楚地观察到Al 元素分布于催化剂横断面的中间,可以推断中间部分的Al 为CuAl2合金中的Al;O 元素主要分布于催化剂横断面的两侧,可以推断出催化剂横断面两侧均为CuO。根据Al 元素和O 元素的面分布扫描图可大体分出CuO 和CuAl2的分界线,如图6a 红色虚线所示,中间部分为未抽提的CuAl2合金,厚度为200 ~300 μm,两侧为CuO,厚度超过100 μm。这与XRD 结果一致,由于CuO 的厚度超过100 μm,很难观察到CuAl2的衍射峰。

图5 多孔CuO 催化剂的SEM 照片Fig.5 SEM images of multiparous CuO catalyst.a,c Dendritic structure;b,d Plate like structure of multiporous CuO catalysts
2.1.3 XPS 表征结果
XPS 能够给出铜系催化剂中Cu 的价态,多孔CuO 催化剂的XPS 谱图见图7。由图7 可知,催化剂的Cu 2p3/2结合能的主峰在933.7 eV 处,且存在肩峰,表明催化剂中存在Cu2+。为了区分催化剂中不同价态的Cu,对它进行拟合分峰[23-24],发现催化剂由3 种组分组成,主要组成相为CuO,即结合能为933.7 eV 处的峰,此外,还在催化剂中发现了Cu+,即结合能为932.3 eV 处的峰。由于雷尼铜是在水相体系中制备的,氧化过程不可避免地在催化剂表面出现了少量羟基化的铜,即Cu(OH)2,结合能的主峰位于935.4 eV。催化剂位于941.0 ~943.0 eV 的肩峰有着明显宽化的趋势。Zhou 等[25]认为,肩峰的宽化是由于存在CuO 微晶,这与多孔CuO 催化剂的其他表征结果一致。
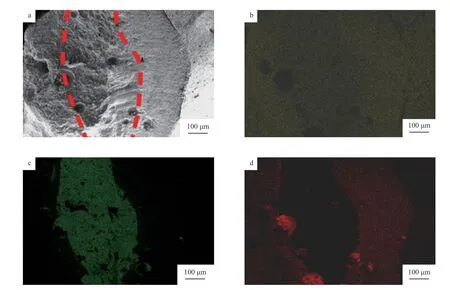
图6 多孔CuO 催化剂的面扫描分布图Fig.6 Distribution images of elements of the multiporous CuO catalyst.a SEM;b Cu;c Al;d O
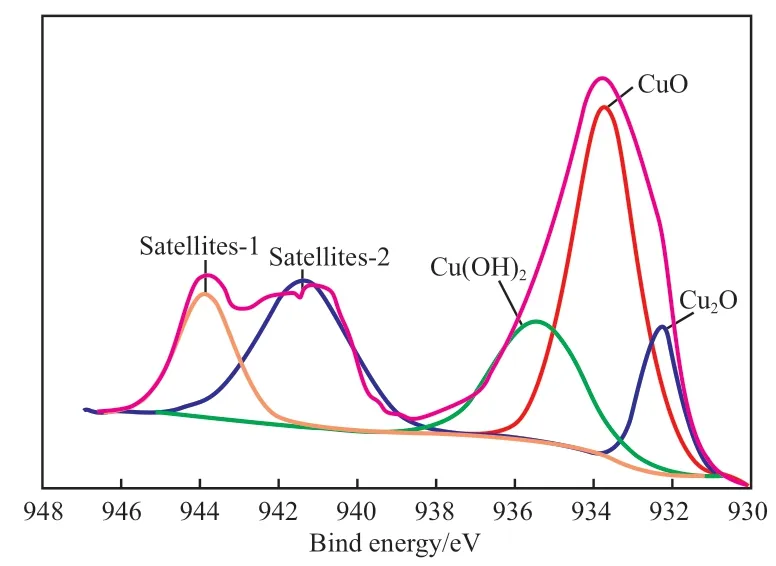
图7 多孔CuO 催化剂的XPS 谱图Fig.7 XPS patterns of the multiporous CuO catalyst.
2.1.4 H2-TPR 表征结果
多孔CuO 催化剂与CZ 催化剂的H2-TPR 曲线见图8。由图8 可知,多孔CuO 催化剂在139℃附近出现一个还原峰,对应CuO 微晶,CZ 催化剂在180,191 ℃处出现了两个还原峰。这两个还原峰分别为CuO 微晶和CuO-ZnO 固溶体的还原峰[25-26],说明CuO 微晶较CuO-ZnO 固溶体更易还原。多孔CuO 催化剂的还原峰较CZ 催化剂降低了近40 ℃。这是由于CuO 的晶粒效应导致的,多孔CuO 催化剂中的微晶CuO 颗粒更小,因此更容易被H2还原。虽然Cu+易化学吸附CO,但它对H2十分稳定,即使在500 ℃下用H2还原也能保持稳定[27-29],这也是多孔CuO 催化剂的H2-TPR数据中没有发现Cu+还原峰的原因。

图8 多孔CuO 催化剂与CZ 催化剂的H2-TPR 曲线Fig.8 H2-TPR curves of the multiporous CuO catalystand CZ catalyst.
2.2 催化剂活性评价
2.2.1 气态空速对CO 脱除效果的影响
气态空速对CO 脱除效果的影响见图9。由图9 可知,在不同的反应气态空速下,多孔CuO 催化剂的出口CO 含量均明显小于CZ 催化剂。在反应温度为90 ℃时,气态空速为3 000 h-1或5 000 h-1时,多孔CuO 催化剂可将原料中的CO 含量脱除至3×10-8以下,达到了聚合级深度脱除CO的指标,但当气态空速增至10 000 h-1时,出口处CO 含量则超过3×10-8。而CZ 催化剂在气态空速为10 000 h-1时,脱除能力明显变差,说明多孔CuO 催化剂具有更深的CO 脱除深度。之前的研究指出,高分散的CuO 是CO 催化氧化的活性组分[16],根据XRD,SEM,H2-TPR 表征结果显示,多孔CuO催化剂具有较小的CuO 颗粒以及更好的CuO 分散度,且多孔CuO 催化剂中Cu+的存在有助于提高催化剂脱除CO 的能力。在低温(<200 ℃)条件下,对于过渡金属氧化物催化剂,CO 氧化反应机理满足Mar-van Krevelen 机理(MVK 机理)[23]。根据MVK 机理可知,晶格氧参与CO 氧化反应,因此,铜系催化剂的CO 氧化脱除的两个活性位为CO 活性吸附位和活性晶格氧。Liu 等[30]通过密度泛函理论分析计算得出,Cu+是Cu2O 表面最强的吸附活性位。Choi 等[31]提出,Cu,Cu+,Cu2+粒子中,Cu+的CO 氧化反应活性最高。Huang 等[32]认为,不管贫氧还是富氧,含有Cu+的Cu2O 具有可变价态,能通过氧化或者还原过程获得和释放催化剂表面的晶格氧,比CuO 和Cu 具有更高的CO氧化活性。可以推断,多孔CuO 催化剂高活性来自于催化剂中CuO 微晶及Cu2O 的Cu+粒子的共同作用。

图9 气态空速对CO 脱除效果的影响Fig.9 Influence of GHSV on the removal results of CO in gas ethylene.Reaction conditions:2.0 MPa,90 ℃.■ CuO;■ CZ
2.2.2 反应温度对CO 脱除效果的影响
反应温度对CO 脱除效果的影响见图10。由图10 可知,在低温(50 ℃)条件下,多孔CuO催化剂脱除CO 的能力大幅下降,此时CZ 催化剂的活性高于多孔CuO 催化剂,说明多孔CuO 催化剂在低温条件下对CO 的脱除能力差于CZ 催化剂。Cu与其他过渡金属氧化物能够形成氧化还原电对,促进催化剂在低温条件下更容易被还原,从而具有更好的低温反应活性[22]。与多孔CuO 催化剂相比,尽管CZ 催化剂的晶粒较大,但由于CuO-ZnO 固溶体的存在,CZ 催化剂中的CuO-ZnO 的协同作用更有助于提高催化剂的低温脱除CO 的性能。而多孔CuO 催化剂无其他过渡金属氧化物,因此无氧化还原电对,也不存在固溶体,这对其低温脱除CO 都是不利的。
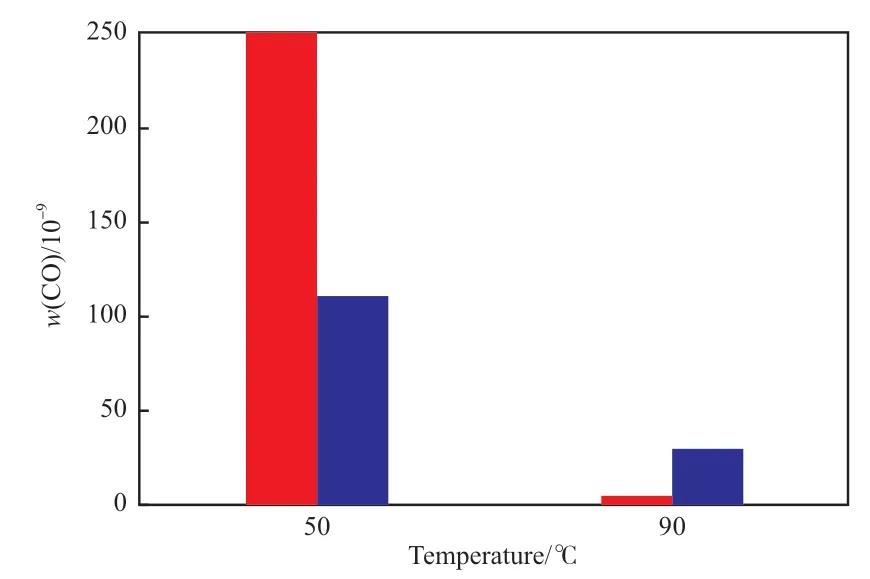
图10 反应温度对CO 脱除效果的影响Fig.10 Influence of temperature on the removal results of CO in gas ethylene.Reaction conditions:2.0 MPa,GHSV 3 000 h-1.■ CuO;■ CZ
3 结论
1)雷尼铜进行低温氧化制备了多孔CuO 催化剂。催化剂主要组成为CuO 纳米粒子,通过Scherrer 公式对催化剂的XRD 衍射峰进行拟合得出平均粒径为8.5 nm 左右,且催化剂中存在Cu2O。由于CuO 纳米颗粒较小,使得H2-TPR 的H2还原温度较CZ 催化剂低了近40 ℃。
2)微量CO 脱除实验结果表明,在反应温度为90 ℃、气态空速为3 000 h-1的条件下,多孔CuO 催化剂可以将出口CO 含量降至3×10-8。在高气态空速下,出口的CO 含量仍然可以降到1×10-7。CZ 催化剂虽表现出较好的脱除CO 的能力,但脱除深度较多孔CuO 催化剂差,多孔CuO催化剂的高活性主要来自于CuO 微晶和Cu+粒子的共同作用。

扫码了解更多相关
专题研究信息
