肝细胞核因子1A对人胰腺癌PANC1细胞的吉西他滨联合白蛋白紫杉醇耐药性的影响
2019-08-29郑上游胡崇辉陈汝福
郑上游 胡崇辉 陈汝福
中山大学孙逸仙纪念医院胆胰外科,广州 510120
多数胰腺癌化疗患者最终因对化疗产生多重耐药导致疾病进展而死亡[1]。多药耐药性的特征在于对具有靶位点的化学治疗药物的交叉抗性。化疗药物的化学抗性的主要机制与药物摄取、代谢和作用靶点有关[2],其常见原因之一是ATP结合盒(ATP-binding cassette,ABC)转运蛋白家族的上调[3]。Mohelnikova-Duchonova等[4]研究表明,显微切割的胰腺癌肿瘤细胞中ABC转运家族的ABCB4、11,ABCC1、3、5、10和ABCG2等 mRNA表达显著上调,说明ABC转运家族表达可抵抗胰腺癌化疗的效应。Passacantilli等[5]和Arumugam等[6]检测抗癌药物的半抑制浓度(50% inhibitory concentration, IC50)及行细胞增殖实验时发现,胰腺癌细胞株BxPC-3、 CFPAC-1和L3.6pl为敏感细胞株,而Hs766T、MIAPaCa-2、Mpanc96 和PANC1为耐药细胞株。肝细胞核因子1α(hepatocyte nuclear factor 1 homeobox A,HNF1A)作为抑癌因子在胰腺癌中发挥重要调控作用[7]。本研究检测胰腺癌组织和胰腺癌耐药株PANC1细胞 HNF1A表达,分析HNF1A通过调控ABC转运家族对PANC1细胞IC50和凋亡能力的影响及与临床化疗疗效的相关性。
材料与方法
一、胰腺癌细胞株及胰腺癌组织HNF1AmRNA表达检测
人胰腺癌细胞株BxPC-3、CFPAC-1、L3.6pl、PANC1、Hs766T、MIAPaCa-2和Mpanc96均购自ATCC,常规培养、传代。选取2012年3月至2017年5月间中山大学孙逸仙纪念医院胆胰外科78例行手术切除后接受吉西他滨联合白蛋白紫杉醇化疗方案的局部晚期或远处转移的胰腺癌患者。所有胰腺癌组织标本均由两名病理科医师重新评估并诊断为胰腺导管腺癌。出院后通过复诊及电话随访了解病情发展,随访截止日为2017年10月。患者的生存期定义为入组时间至死亡时间或随访终止时间。
使用Trizol法抽提7株胰腺癌细胞及78例胰腺癌组织的总RNA。应用PrimeScript1M RT reagent Kit(TaKaRa公司,Cat.RR037A)将RNA 逆转录成cDNA,再用GreenTMTB Premix Ex TaqTMⅡ(Tli RNaseH Plus,TaKaRa公司,Cat. RR820A)行荧光定量PCR反应。HNF1A上游引物序列5′-GACCTGACCGAGTTGCCTAAT-3′,下游引物序列5′-CCGGCTCTTTCAGAATGGGT-3′;内参GAPDH上游引物序列5′-CGCTGAGTACGTCGTGGAGTC-3′,下游引物序列5′-GCTGATGATCTTGAGGCTGTTGTC -3′。按试剂盒说明书进行操作。采用公式2-△△CT计算mRNA表达量,每个样品设3个复管,取均值。
二、稳定过表达HNF1A细胞株的构建
将人HNF1A cDNA片段(GeneCopoeia,EX-A1385-M13-10,cDNA克隆)插入pMk0.1-puro质粒,通过携带HNF1A cDNA质粒的慢病毒载体感染HNF1A表达量最低的胰腺癌细胞,用含2 μg/ml嘌呤霉素的培养皿培养、筛选阳性克隆,扩增获得过表达HNF1A的胰腺癌细胞(HNF1A组),以携带空质粒的慢病毒感染的胰腺癌细胞作为对照组。
三、HNF1A组和对照组细胞HNF1A、ABC转运家族的mRNA及蛋白表达检测
收集HNF1A组和对照组对数生长期胰腺癌细胞,用上述同样方法检测两组细胞HNFA及ABC转运家族中的ABCB1、ABCC1、ABCC3、ABCC5 mRNA表达。ABCB1上游引物序列5′-CCCATCATTGCAATAGCAGG-3′,下游引物序列5′-TGTTCAAACTTCTGCTCCTGA-3′;ABCC1上游引物序列5′-ATGGTGTCAGTGGTTTAGG-3′,下游引物序列5′-TGTGGGAAGAAGAGTTGC-3′;ABCC3上游引物序列5′-GTGGGGATCAGACAGAGAT-3′,下游引物序列5′-TAGTGGTGCAGGCAGAGTAGGA-3′;ABCC5上游引物序列5′-CAGCCAGTCCTCACATCA-3′,下游引物序列5′-GAAGCCCTCTTGTCTTTTTT-3′;内参GAPDH上游引物序列5′-CGCTGAGTACGTCGTGGAGTC-3′,下游引物序列5′-GCTGATGATCTTGAGGCTGTTGTC-3′。
取两组细胞,用裂解液提取细胞总蛋白,BCA法定量后行蛋白质印迹法检测细胞HNF1A及ABCB1、ABCC1、ABCC3、ABCC5 蛋白表达,以GAPDH为内参。使用兔抗人HNF1A抗体(1∶1 000,#ab96777,Abcam),兔抗人ABCB1抗体(1∶1 000,#ab170904,Abcam),兔抗人ABCC1抗体(1∶1 000,#ab32574),Abcam),兔抗人ABCC3抗体(1∶1 000,#ab226804,Abcam),兔抗人ABCC5抗体(1∶1 000,#ab24107,Abcam)和兔抗人GAPDH抗体(1∶1 000,#ab18162,Abcam)。最后ECL发光,X片曝光、显影、定影。通过扫描获取条带的灰度值,以目的条带与内参条带的灰度值比作为蛋白相对表达量。
四、PANC1细胞对吉西他滨联合白蛋白紫杉醇的IC50检测
取HNF1A组及对照组对数生长期PANC1细胞,以每孔7×103个细胞接种于96孔板中,分别加入终浓度均为1、20、40、60、80、100 μmol/L的吉西他滨和白蛋白紫杉醇处理48 h, 然后加入20 μl的3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2溴化四唑(MTT)5 mg/ml,继续孵育4 h,弃上清液,加150 μl二甲基亚砜,30 min后上分光光度仪,采用荧光活化细胞分选法(FACS)检测细胞凋亡。 每个浓度设5个复孔,实验重复3次,取均值。
五、PANC1细胞凋亡率检测
用终浓度均为10 μmol/L的吉西他滨和白蛋白紫杉醇处理PANC1细胞72 h后,收集细胞,加入70%冷乙醇固定,加入500 μl ahypotonic混合溶液(0.1%柠檬酸钠,0.1% Triton x-100,20 μg/ml核糖核酸酶,50 μg/ml碘化丙啶)进行细胞染色,30 min后上流式细胞仪,采用FACS法检测细胞凋亡。
六、统计学处理
结 果
一、胰腺癌组织HNF1A表达及其与临床病理参数、患者生存期的相关性
78例胰腺癌的HNF1A mRNA表达量为0.049~0.001,中位数为0.017,将>0.017的归为高表达组,≤0.017归为低表达组,各39例。胰腺癌HNF1A表达水平与患者的性别、年龄、肿瘤分化程度均无关,而与肿瘤的TNM分期、神经浸润相关(P值均<0.05),TNM Ⅳ期及有神经浸润者的HNF1A mRNA表达水平显著下调(表1)。
78例患者的生存期为1.5~22.5个月,平均生存期为12.7个月,其中HNF1A高表达组患者的平均生存期为17.9个月,明显长于低表达组患者的12.4个月(P<0.001,图1)。单因素及多因素分析均显示,肿瘤TNM分期晚、有神经浸润、HNF1A低表达是影响患者生存期的危险因素(表2)。
二、胰腺癌细胞株HNF1A mRNA表达
胰腺癌敏感细胞株BxPC-3、 CFPAC-1、L3.6pl 的HNF1A mRNA表达水平分别为0.038±0.005、0.048±0.001和0.036±0.004,耐药细胞株Hs766T、MIA PaCa-2、Mpanc96、PANC1的HNF1A mRNA表达水平分别为0.020±0.003、0.017±0.002、0.009±0.001、0.006±0.001,其中PANC1的表达量最低,相比常用的BxPC-3细胞的表达量下降6.73倍,差异有统计学意义(t=11.97,P<0.001),故选择PANC1细胞构建过表达HNF1A细胞。
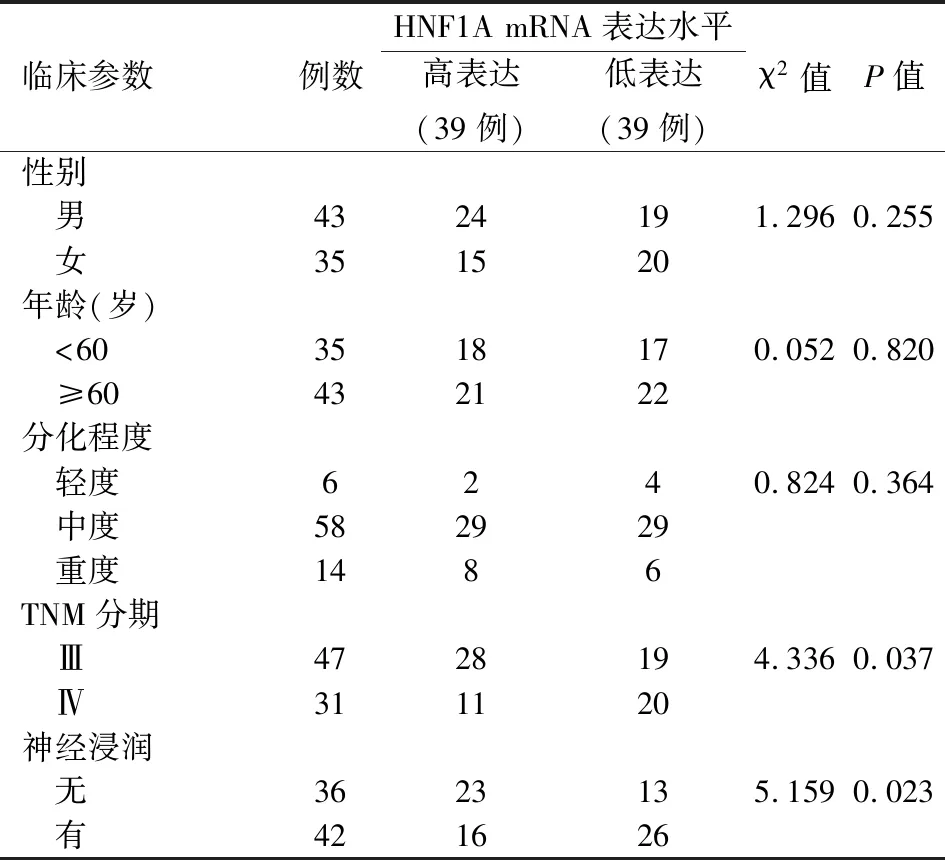
表1 HNFA1表达水平与胰腺癌临床病理参数的相关性(例)
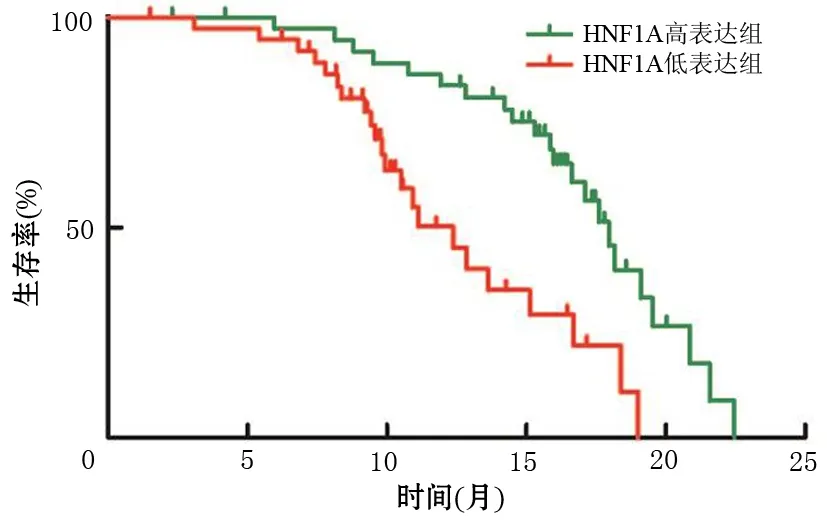
图1 HNF1A表达水平对总生存期的影响
表2单因素和多因素分析胰腺癌患者临床特征与总生存期的关系

变量单因素分析HR(95% CI)P值多因素分析HR(95% CI)P值年龄(岁) <60 ≥601.164(0.637~2.127)0.621性别 男性 女性1.163(0.630~2.144)0.629分化程度 高分化 中分化0.893(0.309~2.583)0.835 低分化1.022(0.158~3.359)0.971TNM分期 Ⅲ Ⅳ2.480(1.303~4.718)0.0062.521(1.283~4.955)0.007神经浸润 无 有2.414(1.249~4.665)0.0091.958(0.990~3.873)0.054HNF1A表达水平 高表达 低表达3.131(1.621~6.045)<0.0012.939(1.466~5.893)0.002
三、HNF1A组和对照组PANC1细胞HNF1A、ABC转运家族的mRNA及蛋白水平
对照组、HNF1A组PANC1细胞HNF1A mRNA 表达水平分别为0.006±0.001、0.018±0.003;蛋白表达水平分别为0.652±0.041、0.966±0.038。HNF1A组细胞HNF1A表达水平较对照组显著上调,差异有统计学意义(t=-6.57,P=0.003,t=-10.14,P<0.001)。
对照组、HNF1A组PANC1细胞ABCB1、ABCC1、ABCC3、ABCC5 mRNA表达水平分别为0.029±0.007和0.025±0.003、0.047±0.008和0.012±0.004、0.056±0.004和0.051±0.006、0.061±0.010和0.058±0.007;5蛋白表达水平分别为0.471±0.046和0.446±0.049、0.832±0.046和0.281±0.040、1.0535±0.075和1.047±0.057、0.965±0.097和0.840±0.051。仅HNF1A组的ABCC1 mRNA及蛋白表达水平较对照组显著下降,差异有统计学意义(t=6.63,P=0.003;t=15.56,P<0.001,图2)。
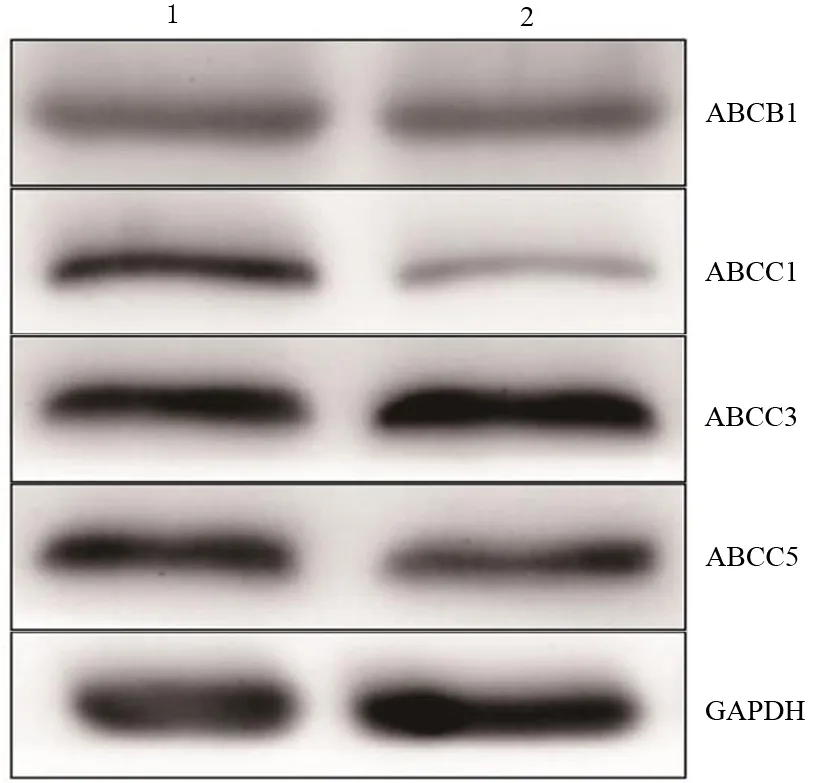
图2 对照组(1)和HNF1A组(2)PANC1细胞ABCB1、ABCC1、ABCC3、ABCC5蛋白表达
四、HNF1A组和对照组PANC1细胞的IC50及细胞凋亡率
吉西他滨联合白蛋白紫杉醇处理48h后,HNF1A组的IC50值较对照组显著下降[(26.31±2.91)μmol/L比(72.63±4.07)μmol/L),差异有统计学意义(t=9.26,P<0.001];HNF1A组凋亡率较对照组显著增加[(40.18±1.64)%比(21.31±1.98)%),差异也有统计学意义(t=-7.35,P=0.002)。
讨 论
HNF1A最初在肝脏中被发现,随后被证实在包括胰腺、肾和肠道中均有表达[8]。研究表明HNF1A突变是年轻人成熟性发病糖尿病(maturity onset diabetes of the young 3,MODY3)的原因,其占所有MODY3病例的21%~64%[9]。 通过全基因组关联研究也报道了HNF1A存在多个单核苷酸多态性位点,且与胰腺癌显著相关。Luo等和Pierce等前期系列报道了HNF1A作为抑癌因子在胰腺癌中发挥重要调控作用,而肝细胞核因子家族的另一成员HNF1B已报道可介导卵巢癌的化疗耐药[7,10]。本研究首先关注HNF1A的表达是否与胰腺癌细胞对吉西他滨联合白蛋白紫杉醇化疗的敏感性相关。结果显示,在7株胰腺癌细胞中,相比于化疗敏感细胞系,耐吉西他滨联合白蛋白紫杉醇的PANC1细胞 HNF1A表达水平明显低下,说明在吉西他滨联合白蛋白紫杉醇药物代谢过程中可能存在某些特定的信号通路调控HNF1A的表达。
本研究发现,HNF1A表达与胰腺癌细胞对吉西他滨联合白蛋白紫杉醇化疗的敏感性呈正相关性。过表达HNF1A的PANC1细胞对吉西他滨联合白蛋白紫杉醇两种药物的IC50显著降低,细胞凋亡率明显升高。既往研究表明,胰腺癌肿瘤细胞ABCB4、ABCB11、ABCC1、ABCC3、ABCC5、ABCC10和ABCG2 mRNA水平显著上调[4]。本研究构建的过表达HNF1A的PANC1细胞中ABCB1、ABCC1 mRNA和蛋白水平显著下调。ABCC1最早报道于1992年,在体外模型中发现ABCC1介导肿瘤细胞对阿霉素、依托泊苷长春新碱的多重耐药性[11]。因此,HNF1A可能通过调控ABCC1表达改变细胞内药物外排影响肿瘤细胞的多药耐药性。本研究结果还显示,HNF1A低表达与胰腺癌TNM分期晚、有神经浸润呈正相关,高表达HNF1A组患者的总生存期长于低表达组,提示HNF1A可能在胰腺癌细胞多药耐药生物学过程中起到关键调节作用。
利益冲突所有作者均声明不存在利益冲突
