鸡线粒体ND1基因变异/异质性及其与性状的关联分析
2019-08-27徐媛媛侯玲灵姬杰菲王焕杰李思露陈文康相涛黄艳群
徐媛媛,侯玲灵,姬杰菲,王焕杰,李思露,陈文,康相涛,黄艳群
鸡线粒体ND1基因变异/异质性及其与性状的关联分析
徐媛媛1,侯玲灵2,姬杰菲1,王焕杰1,李思露1,陈文1,康相涛1,黄艳群1
(1河南农业大学牧医工程学院,郑州 450002;2许昌市畜牧局(市动物卫生监督所),河南许昌 461099)
【】探究鸡线粒体ND1基因的异质性,并在此基础上进行线粒体异质性在不同品种间和固始鸡资源群中的分布研究及其对重要经济性状的效应分析。【】选用固始鸡、卢氏鸡、来航鸡、白洛克鸡、白羽丝毛乌骨鸡、藏鸡、肉鸡以及河南斗鸡8种各具特色鸡种的血样DNA,利用PCR-RFLP技术进行mt.A4589G变异/异质性在自然群体的分布研究。此外,利用实验室先前构建的固始鸡资源群的血样DNA,通过PCR-RFLP技术进行mt.A4589G变异/异质性在固始鸡资源群的分布研究及其与固始鸡资源群F2代性状的关联分析,包括腹脂、腿肌率、盲肠长度等屠体性状指标,胫长、胸深、体斜长等生长性状指标,肌纤维直径、肌肉pH、剪切力等肉质性状指标以及葡萄糖、淀粉酶、甘油三酯等血液生化指标,进而掌握鸡线粒体ND1基因异质性及其潜在效应。【】(1)在8个鸡品种中,从线粒体ND1基因全长检测到一个同义突变mt.A4589G,其分布具有明显的品种特性:外来品种如肉鸡、白洛克和白来航鸡的优势等位基因为A,而国内地方品种如丝羽乌骨鸡、河南斗鸡、卢氏鸡、固始鸡和藏鸡均为G;(2)通过PCR-RFLP检测到mt.A4589G在不同品种以及固始鸡资源群中皆存在异质性。在8个不同品种中,仅从固始鸡、河南斗鸡和肉鸡中检测到5个AG异质性个体,异质性发生的频率为0.063,表明mt.A4589G异质性的分布具有一定的品种特性。而在固始鸡资源群中,mt.A4589G存在较不同品种间更为广泛的异质性,在F0、F1和F2代的异质性发生频率分别为0.81、0.41和0.70,表明mt.A4589G异质性具有普遍性;(3)mt.A4589G异质性与固始鸡资源群F2代性状的关联分析表明,mt.A4589G异质性对腹脂、皮脂厚度、8周胫长、腿肌纤维直径、葡萄糖和乳酸脱氢酶等的影响都达到差异显著水平(<0.05);(4)mt.A4589G不同的异质性等级与固始鸡资源群F2代性状的关联分析表明,mt.A4589G异质性等级除与腹脂、腹脂率和腿肌率等屠体性状显著相关(<0.05)外,还与生长性状(8周胫长等)、血清生化指标(葡萄糖等)均产生显著的关联(<0.05)。【】mt.A4589G是一个异质性变异,其异质性的分布具有明显的品种特性,在自然群体的异质性发生频率较低,而mt.A4589G在固始鸡资源群中存在广泛的异质性。通过mt.A4589G异质性及其不同异质性等级与固始鸡资源群F2代性状的关联分析发现,mt.A4589G变异/异质性与鸡的腹脂、血液中葡萄糖水平等性状均产生了显著的关联(<0.05)。
鸡;ND1基因;PCR-RFLP;异质性;关联分析
0 引言
【研究意义】近年来,有关线粒体异质性的研究成为一大热点,主要集中在人类线粒体疾病的研究上。而鸡作为一种重要的经济动物,关于其线粒体异质性的研究鲜有报道。本试验通过研究鸡线粒体ND1基因(mtND1)的异质性在品种的分布及其与固始鸡资源群重要经济性状的关联分析,探究线粒体ND1基因异质性的品种分布特性及其潜在的效应。【前人研究进展】线粒体是机体细胞必需的细胞器,在许多关键的细胞过程中发挥着重要作用,包括能量代谢、钙稳态和细胞凋亡等[1],是糖类、脂肪和氨基酸最终氧化代谢释放能量的场所[2]。NADH脱氢酶(NADH dehydrogenase)是呼吸链复合物Ⅰ的主要组成,在呼吸链中直接参与氢与电子传递并通过氧化磷酸化产生ATP,参与能量代谢。同时,NADH脱氢酶是三羧酸循环中较为重要的一种酶,对于线粒体对细胞凋亡的调节有一定的作用[3]。其中,NADH脱氢酶亚单位1(NADH dehydrogenase subunit 1,ND1)基因位于线粒体DNA(mtDNA)上,mtDNA为一环状分子[4],含有37个基因[5]。单个细胞可以包含数百至数千个mtDNA拷贝[5],由于遗传或体细胞突变,这些mtDNA可能彼此不同。这种单个细胞内或同一个体不同细胞间存在两种或两种以上mtDNA变异体的现象称为线粒体异质性[6-7]。一般情况下,mtDNA的突变能够改变电子传递组分,导致过氧化酶自由基以及氧化应激的增加[8]。许多研究表明,线粒体基因的突变是引起人类多种遗传性疾病、退行性疾病及衰老[9]的重要原因之一,其中,这些突变常以异质性状态存在,即突变型和野生型基因组同时存在于同一细胞中。当突变线粒体DNA(异质性水平)比例较高,即线粒体异质性达到一定阈值时,将会导致病理后果[10]。Schon等[11]认为,与氧化磷酸化活性下降相关的体细胞mtDNA异质性突变可能在衰老过程中起重要作用。YU等[12]表明,mtDNA异质性变异在老年人各种组织中的频率增加,将会导致呼吸能力的致病性丧失。目前,关于鸟类线粒体的报道主要集中在种系发生的研究上[13-16]。Komiyama等[17]通过对mtDNA的长PCR扩增产物进行Sanger测序以及单倍型分析来研究家禽的进化。GUAN等[18]从肉用鸡和蛋用鸡中鉴定了线粒体基因组的113个SNPs。鲁卫卫[19]进行了鸡线粒体ND2基因异质性变异的研究,通过PCR测序检测到ND2基因中的17个突变,通过CRS-PCR-RFLP方法进一步发现mt.A5703T和mt.T5727G变异位点具有异质性,并发现该异质性变异对固始鸡F2代的胸肌脂肪含量有显著影响。【本研究切入点】目前关于鸡线粒体ND1基因异质性的研究尚未见报道。本研究利用PCR-RFLP技术探究鸡线粒体ND1基因的异质性,进行线粒体ND1异质性变异在不同鸡品种间和固始鸡资源群中的分布研究,并在此基础上探讨该变异位点不同异质性程度与固始鸡F2代资源群屠体性状、生长性状、肉质性状和血清生化指标的相关性。【拟解决的关键问题】揭示线粒体ND1基因异质性的品种分布特性及其潜在的效应,为利用线粒体异质性在鸡育种中的应用打下基础。
1 材料与方法
1.1 试验动物及试验设计
本试验分别选用河南家禽种质资源创新工程中心存储的固始鸡(10只)、卢氏鸡(10只)、来航鸡(10只)、白洛克鸡(10只)、白羽丝毛乌骨鸡(10只)、藏鸡(10只)、肉鸡(12只)和河南斗鸡(8只)的血样,开展mtND1在不同品种的变异/异质性的分布研究。
固始鸡资源群的构建和性状测定方法,详见文献[19]。资源群是利用蛋肉兼用型固始鸡和肉用型安卡鸡纯系按公、母鸡1﹕6比例进行正反杂交构建而成。群体包含7个家系,共806只鸡,其中正交系4个,反交系3个。并于84d屠宰806只F2代鸡,测定屠体重、全净膛重、半净膛重、腹脂重、胸肌重、腿肌重、脾重、肌胃重、肝脏重、胰腺重、皮脂厚度、十二指肠长度、回肠长度、盲肠长度等屠体性状指标;测定体重、胫长、胫围、胸骨长、胸深、胸宽、胸角、体斜长等生长性状指标;测定肌纤维直径、肌肉密度、肌肉脂肪含量、肌肉pH、剪切力、失水率等肉质性状指标以及测定葡萄糖、总胆固醇、甘油三酯、肌酐、淀粉酶、乳酸脱氢酶等血清生化指标。利用存储的固始鸡资源家系F0、F1和F2代的血样开展mtND1的变异/异质性在固始鸡资源群不同代次的分布及其与F2代性状的关联研究。
血样DNA的提取参照分子克隆实验指南的酚-氯仿抽提法进行[20]。
1.2 引物设计
根据鸡线粒体ND1基因序列(GenBank登录号:AP003317),利用引物设计软件Oligo7.0,避开相应的线粒体假基因序列进行引物设计,设计完成后在NCBI(https://www.ncbi.nlm.nih.gov/)提供的Primer- BLAST以及DNAMAN软件对引物的特异性进行验证,将符合要求的引物交由上海生工生物工程股份有限公司合成(表 1)。

表1 本研究所用引物
序列来源GenBank(AP003317) The sequence (GenBank accession:AP003317)
1.3 PCR反应体系和扩增条件
PCR反应体系:1 μL dNTP Mix(10 mmol·L-1each),10 μL 10×LampTMBuffer,2 μL上游引物(10 pmol·μL-1),2μL下游引物(10 pmol·μL-1),2 μL基因组DNA模板(50 ng·μL-1),1 μL LampTMDNA Polymerase,加超纯水至50 μL。
PCR扩增条件:94℃预变性10 min;94℃变性30 s,55℃或57℃退火35 s,72℃延伸1 min,32个循环;最后72℃延伸10 min。
1.4 样品测序
先对由ND1-1引物扩增DNA混池(由来自于8个不同品种的个体等量DNA混合而成)获得的PCR产物进行双向测序。并采用引物ND1-2的PCR扩增产物对由PCR-RFLP法从8个品种中检测到的5个异质性样本(即AG型)进行测序验证。测序由上海生工生物工程股份有限公司采用Sanger法进行。
1.5 PCR-RFLP酶切反应
测序发现mtND1 基因内的mt.A4589G变异可引起自然酶切位点Bsp1286 I的改变。可采用PCR-RFLP进行该变异的检测。酶切所用引物及内切酶信息见表1。酶切反应体系(总体积20 μL):0.3 μL内切酶Bsp1286 I,1 μL 10×PCR Buffer,10 μL ND1-2 扩增的PCR产物,1 μL BSA,7.7 μL超纯水。于37℃恒温箱消化过夜(8—16 h)。酶切产物采用1.5%琼脂糖凝胶电泳进行检测。
1.6 基因型和异质性比例的判定
根据凝胶电泳图像中酶切产物的片段判断基因型。用Genetools软件分析其异质性程度。对mt.A4589G位点,其异质性程度采用mt.4589A的比例来表示。等位基因A的比例=碱基A的灰度值/(碱基A的灰度值+碱基G的灰度值)×100%,等位基因A的比例为0代表的是GG纯合基因型,100%代表的是AA纯合基因型。
1.7 数据统计与分析
利用SAS(V8版)软件中的一般线性模型进行异质性变异与固始鸡F2代资源群相关性状间的关联的统计分析。统计分析模型:y=μ+j+s+r+e,其中y为生产性能测定值,μ为生产性能的最小二乘均值,j为基因型对生产性能的效应值,s为性别对生产性能的效应值,r为家系对生产性能的效应值,e为随机残差效应。最小二乘均数的多重比较采用Bonferroni方法进行校正。
2 结果
2.1 线粒体ND1基因变异位点的发现
首先采用ND1-1引物和构建的DNA混合池(由8个不同鸡品种血液DNA构建)进行线粒体ND1基因的全长扩增,电泳结果显示(图1)扩增片段长度为995bp,与预期的目的片段长度相符。PCR产物直接测序显示ND1基因全长上存在一个变异位点mt.A4589G(根据AP003317序列命名,图2)。经DNAMAN软件分析发现,该变异是一个同义突变位点,但引起了Bsp1286I自然酶切位点的改变。
2.2 PCR-RFLP检测mt.A4589G变异/异质性在品种间的分布
由于mt.A4589G位点A→G的变异能够引起自然酶切位点Bsp1286I的改变,因此采用Bsp1286I(逢碱基G被切开)限制性酶切的方式(PCR-RFLP)对该位点在8个品种间的变异/异质性情况进行研究。利用ND1-2引物检测mt.A4589G变异在品种间的分布,得到了预期的PCR产物(图3)。

图1 引物ND1-1的PCR扩增产物凝胶电泳

图2 mt.ND1基因的测序(DNA混合池为模板)

图3 ND1-2 PCR扩增产物电泳图
ND1-2引物扩增片段长度为356 bp,被Bsp1286I 内切酶切开后片段分别为283 bp和73bp。经过酶切分型统计发现(表2),在8个群体中检测到3种基因型,显示mt.A4589G变异是一个异质性变异。根据其碱基变异,将出现两条带(283bp和73bp)的命名为GG型,单条带(356bp)的命名为AA型,3条带(356、283和73bp)的命名为AG型(图4)。分析发现mt.A4589G变异的分布具有明显的品种特性:固始鸡、河南斗鸡、卢氏鸡、丝羽乌骨鸡和藏鸡的优势等位基因为G,而肉鸡、来航鸡和白洛克的优势等位基因为A(表2)。此外,8个品种中共检测到5个异质性个体(AG型),而其它个体皆为纯合型。异质性的发生频率为0.063。异质性个体分别存在于固始鸡、肉鸡和河南斗鸡中。

图4 PCR-RFLP检测mt.A4589G位点变异

表2 线粒体mt.A4589G变异/异质性在8个鸡品种的分布
1)表格中的大写字母分别表示不同的鸡种:GS.固始鸡;BC.肉鸡;HC.河南斗鸡;LS.卢氏鸡;WL.白来航;WP.白洛克;SK.丝羽乌骨鸡;TB.藏鸡。2)AG代表异质性个体的基因型
1)The capital letters in the table indicate different breeds of chicken: GS.Gushi chicken;BC.Arbor Acres broiler chicken;HC.Henan Cockfighting chicken;LS.Lushi chicken;WL.White Leghorn chicken;WP.White Plymouth Rock chicken;SK.Silkie chicken;TB.Tibetan chicken.2)AG represents the genotype of a heteroplasmic individual
利用引物ND1-2对由PCR-RFLP法从8个品种中检测到的5个异质性个体(AG型)进一步进行Sanger测序验证,结果表明PCR产物直接测序与PCR-RFLP的检测呈现了相似的结果(图5)。PCR-RFLP方法检测到异质性为45%的个体(GS1),其测序峰图显示碱基A和碱基G峰值等高,几乎完全重合。而其它4个样品在峰值图上皆呈现的是主要碱基G,次要碱基A仅有一点点底峰,这可能与不同个体线粒体异质性程度的差异有关(图5)。
2.3 mt.A4589G变异/异质性在固始鸡资源群的分布
采用PCR-RFLP检测mt.A4589G变异/异质性在固始鸡资源群各代次的分布。结果显示:mt.A4589G在固始鸡资源群中存在广泛的多态,并且发现mt.A4589G在资源群中存在较品种间更为广泛的异质性,在F0、F1和F2代的异质性发生比率分别为0.81、0.41和0.70(表3)。
本研究在固始鸡F2代资源群中所涉及检测到的样本共有771个,其中66个为AA型,540个为AG型,165个为GG型,则AA型、AG型和GG型对应的频率分别为0.09、0.70和0.21(表3)。AA型在F2代资源群体中的比例低。
2.4 mt.A4589G异质性与固始鸡资源群F2代性状的关联分析
由于AA型在F2代资源群体中的比例低,mt.A4589G变异位点的不同基因型在F2代不同家系群体中的分布差异较大,大部分家系只有两种基因型。因此,为保证统计分析的准确性,本研究根据基因型在家系的分布特点,分别对包含AA 型和 AG 型以及AG 型和GG 型的家系进行mt.A4589G变异/异质性与固始鸡F2代资源群性状的关联分析。
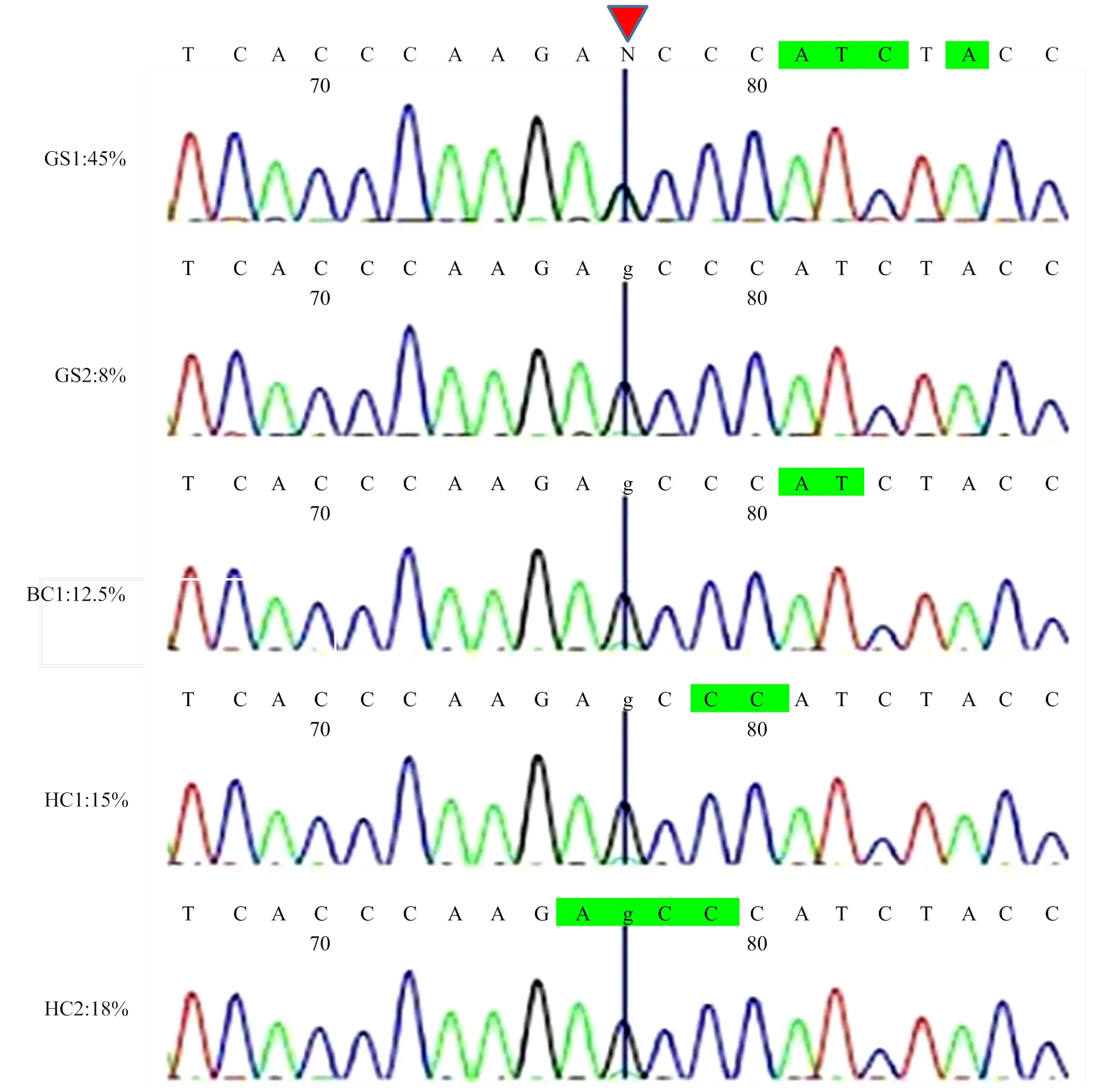
1)左侧是利用PCR-RFLP法检测到的5个异质性个体的品种及异质性程度,右侧是通过对其PCR产物进行Sanger测序验证得到的峰图(GS1、GS2—固始鸡,BC1—肉鸡,HC1、HC2—河南斗鸡)。2)红色箭头处为mt.A4589G位点

表3 mt.A4589G变异在固始鸡资源群的分布
AG代表异质性个体AG represents the heterogeneous individuals
采用包含AA和AG型的家系进行mt.A4589G变异/异质性与固始鸡F2代资源群的屠体性状、生长性状、肉质性状以及血液生化指标的关联分析,结果表明mt.A4589G变异/异质性与固始鸡出生重、8周胸深、8周胸骨长、8周胫长、腿肌纤维直径显著相关(<0.05)(表4),而与其它性状关联不显著。
采用包含GG和AG型的家系进行mt.A4589G变异/异质性与固始鸡F2代资源群的屠体性状、生长性状、肉质性状以及血液生化指标的关联分析,结果表明mt.A4589G变异/异质性与固始鸡盲肠长度、腹脂、腹脂率、皮下脂肪厚度、葡萄糖和乳酸脱氢酶显著相关(<0.05)(表5),而与其它性状关联不显著。

表4 mt.A4589G变异/异质性与固始鸡F2代资源群性状的关联分析(包含AA和AG型的家系)
AA型、AG型两列对应的数值以LSM±S.E表示
The values corresponding to the two columns AA and AG are indicated by LSM±S.E

表5 mt.A4589G变异/异质性与固始鸡F2代资源群性状的关联分析(包含GG和AG型的家系)
GG型、AG型两列对应的数值以LSM±S.E表示
The values corresponding to the two columns GG and AG are indicated by LSM±S.E
2.5 mt.A4589G不同异质性等级与固始鸡资源群F2代性状的关联分析
为进一步掌握异质性对性状的效应,本研究进一步根据mt.A4589G中mt.4589A的比例对固始鸡资源群F2代个体人为地进行异质性等级划分,并进行不同异质性等级与固始鸡资源群F2代性状的关联分析。
在固始鸡F2代资源群中,mt.A4589G不同异质性等级与屠体性状的关联分析表明(表6),该变异不同异质性等级对腹脂、腹脂率的影响达到差异极显著水平(<0.01,异质性等级高的个体腹脂重/腹脂率较高),对腿肌率、盲肠长度的影响达到差异显著水平(<0.05),但对胸肌率、皮脂厚等其它屠体性状指标的效应均未达到显著水平,此外,对肌胃率、脾率和屠宰率(<0.1)等呈现出相关的趋势;mt.A4589G不同异质性等级与生长性状的关联分析表明(表6),该变异不同异质性等级对8周龄胫长的影响达到差异显著水平(<0.05,异质性等级高的个体胫长较长),但对胫围、体斜长等其它生长发育指标的效应均未达到显著水平,此外,对12周胸深和12周胸角(<0.1)呈现出相关的趋势;mt.A4589G不同异质性等级与肉质性状的关联分析表明(表6):该变异不同异质性等级对肌纤维直径、肌肉脂肪含量、肌肉的pH值、剪切力、失水率等肉质性状指标的效应均未达到显著水平(>0.05);mt.A4589G不同异质性等级与血液生化指标的关联分析表明(表6):该变异不同异质性等级对葡萄糖、淀粉酶的影响达到差异显著水平(<0.05,异质性等级高的个体葡萄糖含量较低),但对总胆固醇、甘油三酯等其它血液生化指标的效应均未达到显著水平,此外,对乳酸脱氢酶(<0.1)呈现出相关的趋势。

表6 mt.A4589G中mt.4589A的比例等级与固始鸡资源群F2代性状的关联分析
1)同一行不同的小写字母表示差异显著(<0.05),不同的大写字母表示差异极显著(<0.01)。2)表中异质性比值为0代表的是GG基因型,100%代表的是AA基因型,异质性比值=碱基A/(碱基A+碱基G)×100%
1) In the same line, different small letters means significantly (<0.05), different capital letters means highly significantly (<0.01). 2) In the table, the heteroplasmic ratio of 0 represents GG genotype, 100% represents AA genotype, and the heteroplasmic ratio= Base A / (Base A + Base G)×100%
3 讨论
3.1 鸡线粒体ND1基因A4589G异质性在品种间的分布
对于mt.A4589G异质性在不同品种间的分布研究,试验所选用的8个不同品种的鸡,其样本数介于8—12。PRUETT等[21]采用微卫星分析表明,5—10个个体的小样本即能够无偏估计北美歌雀的杂合性。同样,TRASK等[22]在猴子上的研究表明,检测常见SNP和稀有SNP至少需要10个个体。这些报道皆显示了小样本估计群体遗传多样性的准确性和可行性。
本研究中从8个品种间线粒体ND1基因上仅检测出一个变异位点A4589G,显示了ND1基因的保守性。ND1基因较为保守的原因,可能是由ND1的功能所决定的。在由线粒体DNA编码的呼吸链复合物I中,ND1是核心亚基,在从细菌到哺乳动物的进化中都较为保守[23-24]。ND1的缺陷极有可能导致NADH脱氢酶全酶的缺乏[25],同时ND1是泛醌的结合位点[26],能够促进呼吸链中的电子传递。最近研究发现,ND1是维持亲水性和疏水性呼吸链复合物I臂之间结构和功能相互作用的关键亚基[23],因而在自然选择的情况下各物种ND1基因较为保守。
本研究发现mt.A4589G变异的分布具有明显的品种特性。所检测的地方品种鸡(固始鸡、河南斗鸡、卢氏鸡、丝羽乌骨鸡和藏鸡)的优势等位基因为G,而国外品种鸡(肉鸡、白洛克和来航鸡)的优势等位基因为A。其中,肉鸡、白洛克具有生长速度快的特点,来航鸡具有产蛋量高的特点,而本研究所涉及的相关地方鸡种则生长速度慢、产蛋量低,但耐粗饲、抗病性强,线粒体ND1基因mt.A4589G变异分布的地域/品种分布特性提示了该变异对相关生产性状的重要效应,可进一步深入研究线粒体mt.A4589G不同的异质性水平与不同鸡品种相关性状的关联分析,探究地方品种鸡和国外品种鸡该位点优势等位基因不同的深层次原因。
本研究仅从固始鸡、河南斗鸡和肉鸡3个品种中检测到5个AG异质性个体,显示mt.A4589G异质性在自然群体里并不是一个常见现象,其分布也具有一定的品种特性。比较有意思的是本研究发现mt.A4589G在固始鸡资源群中存在较品种间更为广泛的异质性,提示mt.A4589G或其它位点异质性在特定群体里富集的可能性。近年来随着测序技术的发展,发现人类线粒体异质性并不是稀有的,而是一种常见现象[27-28]。本课题组[19]从不同品种线粒体ND2基因上也检测到2个异质性位点。
3.2 鸡线粒体ND1基因异质性对表型性状的影响
RAMOS[29]等研究发现,人类线粒体基因组的异质性在群体水平上具有较高频率。目前,关于线粒体ND1基因异质性的研究主要集中在人类疾病上。人类mtDNA中大多数的致病性突变都是异质性的,它们的表型与异质性水平密切相关[30]。通常,当病理性的异质性突变水平超过一定阈值(一般包含60%—95%的突变mtDNA)时,将会引起细胞的功能障碍,出现生化缺陷和相关症状[31]。现已证明,人类ND1基因上的异质性突变与帕金森病[32]、Leber遗传性视神经病变[33-35]和癌症[36]有关。
目前,关于家禽线粒体ND1基因异质性与性状之间关联性的研究鲜有报道。王佳伟[37]研究发现,30%的能量限制能够导致鸡的肝组织中线粒体ND1基因的表达下调。MERLO等[38]发现衰老期间血小板中ND1基因的表达量显著增加(<0.05),推断其转录的上调似乎能够补偿衰老过程中人血小板中的氧化磷酸化紊乱,表明ND1基因可能与能量代谢有关。鲁卫卫等[39]通过研究发现,mt.A5703T和mt.T5727G的异质性与固始鸡资源群F2代中的胸肌脂肪含量显著相关。本研究通过mt.A4589G异质性与固始鸡F2代资源群性状的关联分析,发现mt.A4589G异质性与腹脂、血液中葡萄糖水平(GLU)等性状显著相关(<0.05),显示该变异/异质性可能影响鸡的腹脂的形成、腿肌的生长发育以及机体的糖代谢,提示mt.A4589G异质性可能通过影响葡萄糖代谢通径从而影响机体的代谢水平和相关性状的发育。然而对于线粒体ND1基因异质性对鸡能量代谢通径影响的深层次机制以及基因调控网络等问题,仍有待于进一步深入研究。
4 结论
本研究检测到mtND1基因上存在一个A4589G异质性变异。利用PCR-RFLP法对mt.A4589G变异/异质性在8个特色鸡种间的分布进行研究,发现mt.A4589G变异/异质性的分布具有明显的品种特性,且mt.A4589G异质性在自然群体的发生比例较低,而mt.A4589G在固始鸡资源群中存在广泛的异质性,表明了异质性在特定群体里富集的可能性。此外,进行mt.A4589G异质性与性状的关联分析发现mt.A4589G变异/异质性与腹脂、血液中葡萄糖水平(GLU)等性状显著相关(<0.05)。
[1] GORMAN G S, SCHAEFER A M, NG Y, GOMEZ N, BLAKELY E L, ALSTON C L, FEENEY C, HORVATH R, YU-WAI-MAN P, CHINNERY P F, TAYLOR R W, TURNBULL D M, mcfarland R. Prevalence of nuclear and mitochondrial DNA mutations related to adult mitochondrial disease., 2015, 77(5): 753-759.
[2] BLACKSTONE N W. Book Review: Essential Cell Biology: An introduction to the molecular biology of the cell., 1998, 73(4).
[3] CROW M T, MANI K, NAM Y J, KITSIS R N. The mitochondrial death pathway and cardiac myocyte apoptosis., 2004, 95(10):957-970.
[4] TAANMAN J W. The mitochondrial genome: structure, transcription, translation and replication., 1999, 1410(2):103-123.
[5] KUKAT C, WURM C A, SPAHR H, FALKENBERG M, LARSSON N G, JAKOBS S. Super-resolution microscopy reveals that mammalian mitochondrial nucleoids have a uniform size and frequently contain a single copy of mtdna.2011, 108(33):13534-13539.
[6] YE K, LU J, MA F, KEINAN A, GU Z. Extensive pathogenicity of mitochondrial heteroplasmy in healthy human individuals., 2014, 111(29): 10654-10659.
[7] STEWART J B, CHINNERY P F. The dynamics of mitochondrial DNA heteroplasmy: implications for human health and disease., 2015, 16(9):530-542.
[8] YUSNITA Y, NORSIAH M D, RAHMAN A J. Mutations in mitochondrial NADH dehydrogenase subunit 1 (mtnd1) gene in colorectal carcinoma., 2010, 32(2):103-110.
[9] GIULIANI C, BARBIERI C, LI M, BUCCI L, MONTI D, PASSARINO G, LUISELLI D, FRANCESCHI C, STONEKING M, GARAGNANI P. Transmission from centenarians to their offspring of mtdna heteroplasmy revealed by ultra-deep sequencing., 2014, 6(6):454-467.
[10] LOUTRE R, HECKEL A M, JEANDARD D, TARASSOV I, ENTELIS N. Anti-replicative recombinant 5S rrna molecules can modulate the mtdna heteroplasmy in a glucose-dependent manner., 2018, 13(6): e0199258.
[11] SCHON E A, DIMAURO S, HIRANO M. Human mitochondrial DNA: roles of inherited and somatic mutations., 2012, 13(12): 878-890.
[12] YU E P, BENNETT M R. Mitochondrial DNA damage and atherosclerosis., 2014, 25(9):481-487.
[13] DANCAUSE K N, VILAR M G, STEFFY R, LUM J K. Characterizing genetic diversity of contemporary pacific chickens using mitochondrial DNA analyses., 2011, 6(2): e16843.
[14] LIU Y P, WU G S, YAO Y G, MIAO Y W, LUIKART G, BAIG M, BEJA-PEREIRA A, DING Z L, PALANICHAMY M G, ZHANG Y P. Multiple maternal origins of chickens: out of the Asian jungles., 2006, 38(1):12-19.
[15] MWACHARO J M, BJORNSTAD G, MOBEGI V, NOMURA K, HANADA H, AMANO T, JIANLIN H, HANOTTE O. Mitochondrial DNA reveals multiple introductions of domestic chicken in East Africa., 2011, 58(2):374-382.
[16] REVAY T, BODZSAR N, MOBEGI V E, HANOTTE O, HIDAS A. Origin of Hungarian indigenous chicken breeds inferred from mitochondrial DNA D-loop sequences., 2010, 41(5): 548-550.
[17] KOMIYAMA T, IKEO K, GOJOBORI T. The evolutionary origin of long-crowing chicken: its evolutionary relationship with fighting cocks disclosed by the mtdna sequence analysis., 2004, 333:91-99.
[18] GUAN X, GENG T, SILVA P, SMITH E J. Mitochondrial DNA sequence and haplotype variation analysis in the chicken (Gallus gallus)., 2007, 98(7): 723-726.
[19] LU W W, HOU L L, ZHANG W W, ZHANG P F, CHEN W, KANG X, HUANG Y. Study on heteroplasmic variation and the effect of chicken mitochondrial ND2., 2016, 27(4):2303-2309.
[20] SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular Cloning. A laboratory Manual., 2001, 186(1):182-183.
[21] PRUETT C L, WINKER K. The effects of sample size on population genetic diversity estimates in song sparrows Melospiza melodia., 2008, 39(2):252-256.
[22] TRASK J A, MALHI R S, KANTHASWAMY S, JOHNSON J, GARNICA W T, MALLADI V S, SMITH D G. The effect of SNP discovery method and sample size on estimation of population genetic data for Chinese and Indian rhesus macaques (Macaca mulatta)., 2011, 52(2):129-138.
[23] IOMMARINI L, GHELLI A, TROPEANO C V, KURELAC I, LEONE G, VIDONI S, LOMBES A, ZEVIANI M, GASPARRE G, PORCELLI A M. Unravelling the effects of the mutation m.3571insc/MT-ND1 on respiratory complexes structural organization., 2018,19(3): 764-780.
[24] BARADARAN R, BERRISFORD J M, MINHAS G S, SAZANOV L A. Crystal structure of the entire respiratory complex I., 2013, 494(7438):443-448.
[25] ANTONICKA H, OGILVIE I, TAIVASSALO T, ANITORI R P, HALLER R G, VISSING J, KENNAWAY N G, SHOUBRIDGE E A. Identification and characterization of a common set of complex I assembly intermediates in mitochondria from patients with complex I deficiency., 2003, 278(44): 43081-43088.
[26] Turrens J F. Mitochondrial formation of reactive oxygen species., 2003, 552(2): 335-344.
[27] MAGNACCA K N, BROWN M J. Mitochondrial heteroplasmy and DNA barcoding in Hawaiian Hylaeus (Nesoprosopis) bees (Hymenoptera: Colletidae)., 2010, 10(1):174.
[28] REINER J E, KISHORE R B, LEVIN B C, ALBANETTI T, BOIRE N, KNIPE A, HELMERSON K, DECKMAN K H. Detection of Heteroplasmic Mitochondrial DNA in Single Mitochondria., 2010, 5(12):e14359.
[29] RAMOS A, SANTOS C, MATEIU L, GONZALEZ MDEL M, ALVAREZ L, AZEVEDO L, AMORIM A, ALUJA M P. Frequency and pattern of heteroplasmy in the complete human mitochondrial genome., 2013, 8(10): e74636.
[30] WALLACE D C. Mitochondrial DNA mutations in disease and aging., 2010, 51(5):440-450.
[31] PATANANAN A N, WU T H, CHIOU P Y, TEITELL M A. Modifying the Mitochondrial Genome., 2016, 23(5):785-796.
[32] SIMON D K, MAYEUX R, MARDER K, KOWALL N W, BEAL M F, JOHNS D R. Mitochondrial DNA mutations in complex I and trna genes in Parkinson's disease., 2000, 54(3):703-709.
[33] BROWN M D, ZHADANOV S, ALLEN J C, HOSSEINI S, NEWMAN N J, ATAMONOV V V, MIKHAILOVSKAYA I E, SUKERNIK R I, WALLACE D C. Novel mtdna mutations and oxidative phosphorylation dysfunction in Russian LHON families., 2001, 109(1): 33-39.
[34] SUDOYO H, SURYADI H, LERTRIT P, PRAMOONJAGO P, LYRAWATI D, MARZUKI S. Asian-specific mtdna backgrounds associated with the primary G11778A mutation of Leber's hereditary optic neuropathy., 2002, 47(11):594-604.
[35] HOWELL N, BINDOFF L A, MCCULLOUGH D A, KUBACKA I, POULTON J, MACKEY D, TAYLOR L, TURNBULL D M. Leber hereditary optic neuropathy: Identification of the same mitochondrial NDI mutation in six pedigrees., 1991, 49(5):939-950.
[36] ABU-AMERO K K, ALZAHRANI A S, ZOU M, SHI Y. High frequency of somatic mitochondrial DNA mutations in human thyroid carcinomas and complex I respiratory defect in thyroid cancer cell lines., 2005, 24(8):1455-1460.
[37] WANG J W, CHEN W, KANG X T, HUANG Y Q, TIAN Y D, WANG Y B. Identification of differentially expressed genes induced by energy restriction using annealing control primer system from the liver and adipose tissues of broilers.2012, 91(4): 972-978.
[38] MERLO PICH M, RAULE N, CATANI L, FAGIOLI M E, FAENZA I, COCCO L, LENAZ G. Increased transcription of mitochondrial genes for Complex I in human platelets during ageing., 2004, 558(1-3):19-22.
[39] LU W W, HOU L L, ZHANG W W, ZHANG P F, CHEN W, KANG X, HUANG Y. Study on heteroplasmic variation and the effect of chicken mitochondrial ND2., 2016, 27(4):2303-2309.
The Variation/Heteroplasmy of Chicken Mitochondrial ND1 Gene and Its Association with Traits
XU Yuanyuan1, HOU LingLing2, JI JieFei1, WANG HuanJie1, LI SiLu1, CHEN Wen1, KANG XiangTao1, HUANG YanQun1
(1College of Livestock Husbandry and Veterinary Engineering, Henan Agricultural University, Zhengzhou 450002;2Xuchang Animal Husbandry Bureau (Municipal Animal Health Inspection Institute) , Xuchang 461099, Henan)
【】The purpose of this study was to investigate the heteroplasmy of mitochondrial ND1 gene in chickens and to study the distribution of mitochondrial heteroplasmy among different breeds and Gushi chicken resource population, and furthermore, to analysis the effects of mitochondrial heteroplasmy on valuable economic traits. 【】DNA extracted from blood samples of eight chicken breeds including Gushi chicken, Arbor Acres broiler chicken, Henan Cockfighting chicken, Lushi chicken, White Leghorn chicken, White Plymouth Rock chicken, Silkie chicken and Tibetan chicken, were used to study the distribution of mt.A4589G mutation/ heteroplasmy in natural populations by PCR-RFLP. In addition, DNA extracted from blood samples of Gushi chicken resource population constructed previously were used to study the distribution of mt.A4589G mutation/ heteroplasmy in Gushi chicken resource population by PCR-RFLP and to study the association analysis between mt.A4589G mutation/ heteroplasmy and F2traits of Gushi chicken resource population, including carcass traits, growth traits, meat quality indicators and blood biochemical indicators, thereby grasping the heteroplasmy of chicken mitochondrial ND1 gene and its potential effects; 【】1) Among eight breeds, one synonymous mutation mt.A4589G was detected from the full length of mitochondrial ND1 gene, and its distribution showed obvious variety characteristics. The dominant alleles of exotic breeds such as broiler chicken, White Plymouth Rock chicken and White Leghorn chicken were A, while domestic local breeds such as Silky chicken, Henan Cockfighting chicken and Lushi chicken were G. (2) The heteroplasmy of mt.A4589G in different breeds and Gushi chicken resource population was detected by PCR-RFLP. Among eight breeds, only five AG heterogeneous individuals were detected in Gushi chicken, Henan Cockfighting chicken and broiler chicken. In the Gushi chicken resource population, mt.A4589G had a wider heteroplasmy and the frequencies of heteroplasmy in F0, F1and F2generations were 0.81, 0.41 and 0.70, respectively. (3) The correlation analysis between mt.A4589G heteroplasmy and F2traits of Gushi chicken resource population showed that mt.A4589G heteroplasmy was significantly correlated with abdominal fat, sebum thickness eight-week-old shank length, diameter of leg muscle fiber and glucose levels in the blood (<0.05). (4) The correlation analysis between the levels of heteroplasmy of mt.A4589G and F2traits of Gushi chicken resource population indicated that the levels of heteroplasmy was significantly correlated with carcass traits, growth traits and serum biochemical indicators (<0.05). 【】mt.A4589G is a heteroplasmic variation, and its heteroplasmic distribution exhibits obvious variety characteristics. The mt.A4589G heteroplasmy of the natural population occurs less frequently, while mt.A4589G has a wider heteroplasmy in the Gushi chicken resource population. Furthermore, through the correlation analysis between the heteroplasmy of mt.A4589G and the F2traits of Gushi chicken resource population, it was found that the mt.A4589G mutation/heterogeneity was significantly correlated with the abdominal fat and the glucose level in the blood (<0.05).
chicken; ND1 gene; PCR-RFLP; heteroplasmy; association analysis
2018-09-18;
2019-07-03
国家自然科学基金(31272434)
徐媛媛,Tel:13598836740;E-mail:994431047@qq.com。
黄艳群,Tel:13838074456;E-mail:hyanqun@aliyun.com
(责任编辑 林鉴非)
