手足口病患儿25-羟维生素D3与外周血Th17/Treg及相关细胞因子的关系*
2019-08-21何媛何巍巍周小娟梁晓君王文娟江永清卢军
何媛, 何巍巍, 周小娟, 梁晓君, 王文娟, 江永清△, 卢军
九江学院附属医院 1检验科, 2皮肤科(江西九江 332000)
手足口病(hand-foot-mouth disease,HFMD)是一种主要发生于5岁内的婴幼儿病毒传染性疾病,主要由柯萨奇病毒A16型(CV-A16)和肠道病毒71 型(EV-A71) 引起。但近年来,HFMD的病原谱已发生变化,非EV-A71和非CV-A16的其他肠道病毒成为优势病原体[1]。HFMD主要的临床表现是发热,手、脚、臀部水疱疹,口腔黏膜溃疡,具有自愈性,但一些患儿可发生严重的并发症,如脑膜炎、脑炎、急性弛缓性麻痹和神经呼吸综合征[2]。HFMD的发生机制尚不十分明确。近年来研究表明,患儿免疫调节功能异常, Th17/Treg 细胞比例失衡对HFMD的发生具有重要作用[3-5]。关于维生素D(VitD),除了维持机体钙、磷水平稳定外,可与免疫细胞上特定维生素D受体(VDR)结合[6]后作用于淋巴细胞,尤其是通过抑制T淋巴细胞增殖和分化来调节机体免疫系统。那么,VitD对HFMD患儿中Th17/Treg 细胞失衡是否有影响,相关报道甚少。本课题就HFMD患儿不同血清VitD水平与外周血Th17/Treg 细胞及其相关细胞因子表达的关系,进行初步探讨。
1 资料与方法
1.1 一般资料 选自2016年1月至2018年10月九江学院附属医院收治的142例HFMD患儿。男73例,女69例,年龄(30.2±7.5)个月,均符合国家卫生健康委员会制定的《手足口病诊疗指南 (2018年版)》[7]诊断标准,且均无神经、免疫等系统基础疾病史。按照建议[8]标准,根据HFMD患儿血清 25(OH)D3水平,分为25(OH)D3正常组(>50 nmol/L)45例、25(OH)D3不足组(37.5~50 nmol/L)56例、25(OH)D3缺乏组(<37.5 nmol/L)41例。各组儿童的性别和年龄等一般临床资料差异无统计学意义(P>0.05),见表1。

表1 不同25(OH)D3水平各组患者一般资料比较
1.2 仪器 Cobas 601全自动电化学发光分析仪(罗氏公司);BD FACSCantoⅡ流式细胞仪(美国BD公司);ST-360洗板机和酶标仪(上海科华实验系统有限公司)。
1.3 方法
1.3.1 标本采集 所有患儿清晨空腹,抽静脉血3 mL,血液凝固后,在抽血当天于3 000 r/min离心3 min,测定25(OH)D3水平,取出一部分血清-80℃保存,用于检测白细胞介素(IL)-17、IL-6、IL-10、转化生长因子-β(TGF-β);另取EDTA-K2抗凝静脉血2 mL,检测辅助性T细胞17(Th17)和调节性T细胞(Treg)。
1.3.2 检测方法 (1)25(OH)D3检测:采用罗氏Cobas 601全自动电化学发光分析仪及配套试剂,严格按照仪器和试剂操作说明书进行操作,并记录结果。(2)Th17细胞和Treg细胞检测:采用BD FACSCantoⅡ流式细胞仪和美国库尔特公司提供的试剂,严格按照仪器和试剂操作说明书进行操作。并采用BD Cell Quest软件分析测定Th17/Treg的比值。(3)IL-17、IL-6、IL-10、TGF-β检测:采用ELISA法检测,试剂购自上海江莱生物科技有限公司,严格按照说明书进行操作并绘制标准曲线,计算出浓度。
1.4 统计学方法 使用SPSS 18.0统计软件,计数资料采用2检验,正态分布的计量资料采用均表示;对不符合正态分布的指标,经lg对数转换成正态分布后,多组间比较采用方差分析,多组间两两比较采用Bonferroni法,相关系数采用Spearman秩相关性检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同25(OH)D3水平中,各组Th17、Treg占CD4+T细胞比例结果比较 与25(OH)D3正常组相比,25(OH)D3不足组和缺乏组的HFMD患儿Th17占CD4+T细胞比例、Th17/Treg比值升高,而Treg占CD4+T细胞比例则下降(均P<0.05);25(OH)D3不足组和缺乏组相比,缺乏组Th17占CD4+T细胞比例、Th17/Treg比值更大,Treg占CD4+T细胞百分比更小,差异均有统计学意义 (均P<0.05)。见表2。
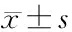

项目例数Th17(%)Treg(%)Th17/Treg25(OH)D3正常组452.33±0.436.49±1.650.31±0.1025(OH)D3不足组564.18±1.28*5.82±2.01*0.74±0.17*25(OH)D3缺乏组419.54±1.46*△2.21±1.84*△2.34±0.31*△F值4.7826.0319.737P值0.0300.0150.001
*与25(OH)D3正常组比较P<0.05;△与25(OH)D3不足组比较P<0.05
2.2 不同25(OH)D3水平各组细胞因子水平比较 3组细胞因子水平相比较,血清IL-17、IL-6水平结果为: 25(OH)D3正常组<25(OH)D3不足组<25(OH)D3缺乏组;IL-10、TGF-β水平结果为:25(OH)D3正常组>25(OH)D3不足组>25(OH)D3缺乏组。各组间两两相比较,差异有统计学意义(均P<0.05)。见表3。
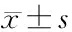
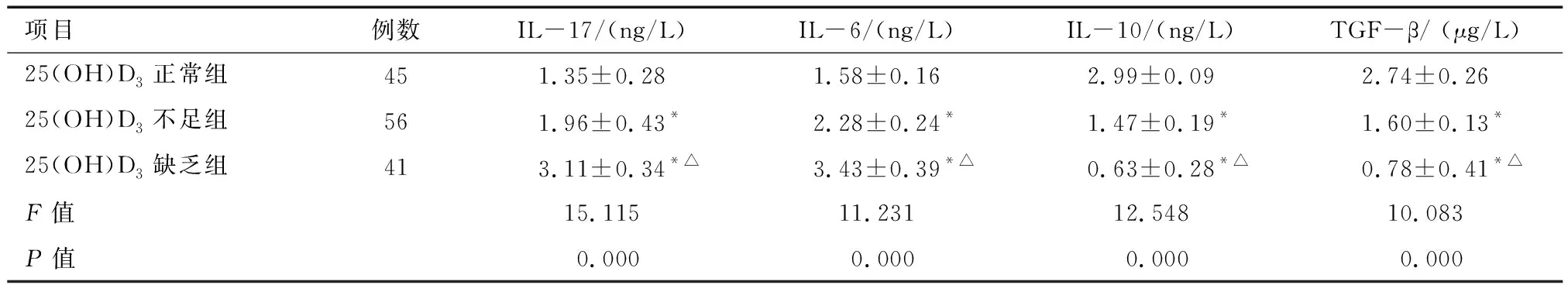
项目例数IL-17/(ng/L)IL-6/(ng/L)IL-10/(ng/L)TGF-β/ (μg/L)25(OH)D3正常组451.35±0.281.58±0.162.99±0.092.74±0.2625(OH)D3不足组561.96±0.43*2.28±0.24*1.47±0.19*1.60±0.13*25(OH)D3缺乏组413.11±0.34*△3.43±0.39*△0.63±0.28*△0.78±0.41*△F值15.11511.23112.54810.083P值0.0000.0000.0000.000
*与25(OH)D3正常组比较P<0.05;△与25(OH)D3不足组比较P<0.05
2.3 各指标与25(OH)D3相关性分析 Th17、IL-17、Th17/Treg、IL-6与25(OH)D3均呈负相关(r=-0.465、-0.531、-0.476、-0.649,均P<0.05),Treg、IL-10、TGF-β与25(OH)D3均呈正相关(r=0.379、0.501、0.449,均P<0.05)。
3 讨论
HFMD是一种常见的小儿传染性疾病,江西省2008年将其列为法定报告管理传染病,之后年报告发病人数始终居所有法定传染病的前列,以5岁以下为主,其中3岁及以下居多[1]。儿童HFMD的发病率和病情轻重程度与年龄呈负相关,主要原因为机体免疫力随着年龄增长而增强[9]。
Th17属于CD4+辅助型T细胞亚型,主要分泌IL-17、IL-6、TNF-α等促炎细胞因子,与炎症感染和自身免疫性疾病发生有关[10]。Treg细胞是一种T细胞亚群,具有免疫耐受作用[11],也可通过分泌IL-10和TGF-β等细胞因子对效应T细胞发挥免疫抑制作用[12],从而避免因为免疫炎症反应导致机体损伤。正常情况下,机体处于免疫稳态可由Th17和Treg两者相互拮抗,维持动态平衡来实现。关于HFMD的发病机制,有更多研究表明HFMD患儿体内免疫功能调节障碍,在HFMD中高表达Th17细胞,相应Th17/Treg比值升高,IL-17A水平也显著升高,存在Th17/Treg细胞失衡[4-5]。还有研究表明HFMD患儿外周血Th17、IL-17水平随病情严重而高,而CD4+CD25+Treg细胞、IL-10、TGF-β水平随病情严重而降低[3]。Li等[13]发现和健康对照组相比,HFMD患儿IL-6水平显著升高,并且IL-6和疾病严重程度正相关。
VitD属于脂溶性维生素,无生物活性,可通过皮肤合成维生素D3(VitD3)。在肝内,VitD3被25-羟化酶转变成25(OH)D3,后者在1α羟化酶作用下生成1,25-二羟维生素D3[1,25-dihydroergotamine D3;1,25(OH)2D3][14]。因1,25(OH)2D3可与VDR结合发挥免疫效应作用,从而使VitD和许多自身免疫性、感染性疾病相关,故是VitD的生物活性功能形式。但血清25(OH)D3因其生物活性稳定,可更好地反映机体免疫状态,是代表体内活性VitD水平的最佳检测指标[15],广泛用于临床检测。
VitD通过活性形式1,25(OH)2D3与VDR发生结合反应后,可使T淋巴细胞的增殖和分化功能受到抑制,进而抑制Th17细胞分泌促炎细胞因子IL-17[16]。有报道说VitD的免疫抑制功能可能是通过下调幼稚细胞和人类记忆CD4+T细胞的IL-17A、IL-6 和IL-22表达而发生[17]。在本研究中,发现不同25(OH)D3水平的HFMD患儿中,与25(OH)D3正常组相比,不足组和缺乏组HFMD患儿Th17百分比、Th17/Treg比值、IL-17、IL-6水平升高(P<0.05)。25(OH)D3水平缺乏组该4个观察指标则比不足组要高(P<0.05)。进一步相关性研究表明,25(OH)D3与Th17、IL-17、IL-6呈负相关,故在HFMD患儿中,25(OH)D3不足可促进Th17和其相关炎症因子IL-17、IL-6表达,当过度表达后,机体炎症反应增强,出现病理损伤。
本研究发现随着25(OH)D3含量上升,Treg百分数值、IL-10、TGF-β水平变化具体为:25(OH)D3缺乏组<25(OH)D3不足组<25(OH)D3正常组(P<0.05)。亦有很多研究表明,VitD对Treg具有促进作用,其机制可能为直接促进Treg细胞分化,另外通过对T细胞的刺激作用使其表达细胞毒性T淋巴细胞相关抗原-4 (CTLA-4)和特定转录因子叉头P3(FOXP3),进而诱导Treg细胞产生[18]。此外,VitD通过其活性形式刺激Treg细胞产生,抑制Th17细胞分化从而显著促进IL-10产生[19]。TGF-β由Treg细胞产生,可通过趋化募集单核细胞等炎症细胞,拮抗炎症和抑制免疫功能[20]。本研究中,当HFMD患儿体内25(OH)D3含量不足时,Treg细胞产生减少,其相关细胞因子IL-10、TGF-β水平也下降;另外,还发现25(OH)D3与Treg、IL-10、TGF-β具有相关性,均为正相关,这与孔繁勇等[21]的研究相符。推测VitD可因为影响Treg产生,进而影响Treg相关抗炎因子IL-10、TGF-β产生,在HFMD中起到免疫调节作用。
总之,25(OH)D3水平可能影响HFMD患儿的Th17/Treg及其相关细胞因子(IL-17、IL-6、IL-10、TGF-β)的表达,参与调节HFMD患儿外周血Th17/Treg免疫平衡系统,影响HFMD的发生。关于VitD是否会影响Th17和Treg其他相关细胞因子,这有待我们后期扩大样本量进行更深入研究,从而进一步探明HFMD的发病机制。
