叶酸代谢酶基因多态性与胚胎停止发育的相关性
2019-08-20孔梅戚宇红张晶支雪荣
孔梅,戚宇红,张晶,支雪荣
(1乌鲁木齐友爱医院,乌鲁木齐830017;2新疆维吾尔自治区妇幼保健院)
近年来,国内临床胚胎停止发育的发生率呈逐年上升趋势。该病发机制非常复杂[1],其中叶酸缺乏和叶酸代谢相关基因缺陷是胚胎发育异常的重要诱导因素[2]。叶酸又名维生素B9,是机体必不可少的营养物质,因自身无法合成,需通过肠道外途径吸收[3]。叶酸以5-甲基四氢叶酸的形式存在于血浆中,并通过合成嘌呤和胸腺嘧啶来参与核酸、蛋白质和磷脂的代谢,因为不能被直接利用,故必须通过一系列代谢酶的催化来实现其生理活性[4]。因此,参与体内叶酸代谢的酶如亚甲基四氢叶酸还原酶(MTHFR)、甲硫氨酸合成酶还原酶(MTRR)、还原叶酸载体(RFC-1)及蛋氨酸合酶(MTR)等基因的多态性与胎儿的生长发育紧密相关[5,6]。为此,本研究就叶酸代谢酶的基因多态性与胚胎停止发育的关系进行了探讨。
1 资料与方法
1.1 临床资料 收集2017年3月~2018年6月在本院就诊经B超确认有胚胎停止发育史的妇女(胚胎停育组)114例,年龄(31.256±3.918)岁,体质量(63.417±3.729)kg,产次(1.424±0.217)次,孕周(8.731±2.246)周。胚胎停止发育诊断标准:头臀长度≥7 mm,孕囊平均直径≥25 mm,无心跳。排除标准:宫腔畸形或宫腔内环境感染,夫妻双方有家族性遗传疾病,有化学或化工药物接触史,有心、肝、肾等重要脏器疾病等。随机抽取同期有一次正常生育史、无不良妊娠史的妇女125例(对照组),年龄(33.426±2.741)岁,体质量(62.389±2.915)kg,产次(1.265±0.108)次,孕周(8.425±1.537)周。两组临床资料比较均无统计学差异(P均>0,05)。本研究获医院伦理委员会批准实施,入组女性均自愿参加并签署知情同意书。
1.2 叶酸代谢酶基因多态性检测 抽取受试者外周血5 mL存于真空抗凝试管中,5 000 r/min 4 ℃离心20 min,收集中层白细胞,-20 ℃保存。采用基因组DNA提取试剂盒获取基因组DNA,经核酸蛋白分析仪鉴定纯度和浓度,OD260/OD280介于1.8~2.0,保存于-20 ℃。采用RCP-RFLP法检测MTHFR C677T、MTRR A66G、RFC-1 A80G及MTR A2756G等位点叶酸代谢相关酶等位基因和基因型分布频率,分析四个基因位点与胚胎停止发育的相关性。选择各位点相应PCR-RFLP扩增引物序列,提取获得的基因组DNA完成纯度鉴定后进行PCR扩增,PCR扩增所用体系共计10 μL,包括1 μL的基因组DNA模板(30 ng/μL),5 μL的2×Master Mix,0.5 μL的20×引物以及3.5 μL纯水。以95 ℃预变性5 min后,95 ℃变性30 s,然后59 ℃退火30 s,最后72 ℃延伸60 s,40个循环结束后,72 ℃延伸5 min。扩增后PCR产物用限制性内切酶酶切后进行琼脂糖凝胶电泳分析。
1.3 叶酸利用能力等级判定 参照Li等[7]研究,叶酸利用能力风险等级的判定是以MTHFR C677T TT、MTRR A66G、RFC-1 A80G、MTR A2756G等位点GG型的出现频率为指标,分为四个风险等级:突变纯合型分布频率<10.0%时可认为机体叶酸利用能力正常,划分为未发现风险等级;突变纯合型的分布频率为11.0%~35.0%时为低风险;突变纯合型分布频率在36.0%~65.0%时为中度风险;而≥66.0%可判定为高风险。
1.4 统计学方法 采用SPSS22.0统计软件处理数据。计数资料以百分比表示,采用χ2检验进行组间比较,Logistic回归分析用于判断各位点与胚胎停止发育的相关性。数据均通过Hardy-Weinberg遗传平衡定律检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组MTHFR、MTRR、RFC-1及MTR等位基因分布情况 RFC-1 A80G、 MTR A2756G、MTRR A66G基因中A和G等位基因频率在胚胎停育组和对照组间无统计学差异(P均>0.05)。而胚胎停育组中MTHFR基因C677T位点T等位基因的频率分布在胚胎停育组和对照组中有统计学差异(P<0.05)。见表1。
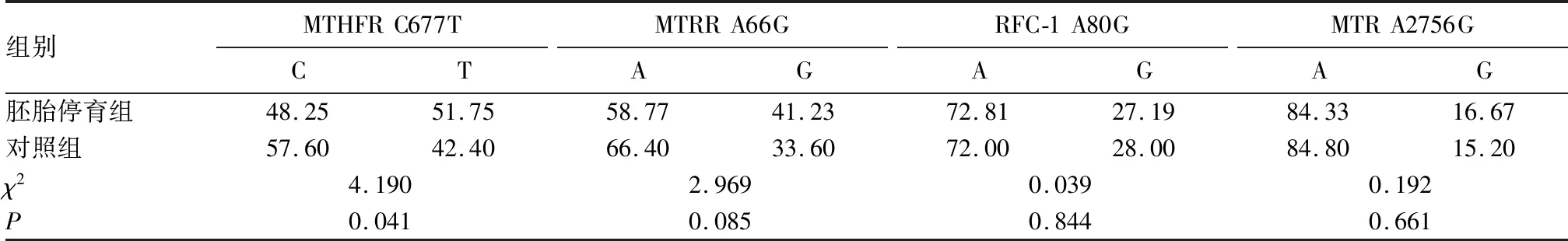
表1 两组等位基因频率分布比较(%)
2.2 两组 MTHFR、MTRR、RFC-1及MTR的基因型频率分布情况 胚胎停育组中MTHFR基因C677T位点TT突变纯合型、MTRR基因的A66G位点的GG突变纯合型频率均高于对照组(P均<0.05)。RFC-1基因A80G位点以及MTR基因A2756G位点AA、AG和GG型的频率在胚胎停育组和对照组间无统计学差异(P均>0.05)。见表2。
2.3 叶酸代谢酶基因多态性与胚胎停育的关系Logistic分析结果显示,MTHFR C677T位点的突变纯合型TT型与胚胎停止发育相关,其胚胎停育的风险高于CC型和CT型 (P均<0.05),MTHFR C677T TT基因型是发生胚胎停育的危险因素。MTRR A66G GG基因型与胚胎停止发育的风险同样高于AA、AG基因型(P均<0.05),携带GG基因型是发生胚胎停育的危险因素。RFC-1 A80G、MTR A2756G的位点突变与胚胎停育的风险无关。见表3。

表2 两组基因型频率分布比较[ 例(%)]

表3 叶酸代谢酶基因多态性与胚胎停育的Logistic分析结果
2.4 两组叶酸利用能力比较 胚胎停育组中叶酸利用能力在未发现风险、低度风险分布比例分别为3.51%和14.91%,低于对照组的31.20%和45.60%(P均<0.05)。而胚胎停育组在中度风险和高度风险的分布比例分别为49.12%和32.46%,高于对照组14.40%和8.80%(P均<0.05)。
3 讨论
由叶酸代谢酶基因突变引起酶活性降低,可能导致同型半胱氨酸向甲硫氨酸转化受阻,引起S-腺苷甲硫氨酸水平降低,抑制DNA甲基转移酶活性从而影响DNA甲基化,诱发胚胎停止发育、早产、妊娠期高血压等产科疾病[8,9],叶酸代谢酶基因突变可能与胚胎停止发育发生有关。MTHFR、MTRR、RFC-1和MTR是目前与临床产科诊断相关的叶酸代谢酶,本研究通过探究这4种基因多态性与胚胎停止发育的相关性,以希望对存在潜在胚胎停止发育患者的诊断有所帮助。
MTHFR基因突变类型有20余种,其中最具临床意义的突变位点是C677T突变。突变表现为三种基因型,即野生纯合型CC、突变杂合型CT和突变纯合型TT型;突变后MTHFR酶活性降低,降低程度与基因型有关,其中突变杂合型CT型活性降低30%左右,突变纯合型TT型的活性甚至降低60%以上[10, 11]。本研究等位基因频率分布结果显示,MTHFR C677T位点中T等位基因在胚胎停育组中的分布与对照组存在差异。而基因型频率分析结果显示,在胚胎停育组中MTHFR基因C677T位点TT突变纯合型频率高于对照组。这提示MTHFR C677T TT型频率增加与胚胎停止发育有关。MTRR是同型半胱氨酸再甲基化途径中的重要酶,在甲硫氨酸代谢途径中起重要作用,作为甲基供体帮助维持机体蛋氨酸、四氢叶酸水平,减少同型半胱氨酸的蓄积毒性[12]。MTRR主要突变类型有A66G、S175L等,其中A66G突变是目前最主要也是研究最多的突变。该位点突变后使得蛋氨酸被异亮氨酸代替,酶活性降低,进而影响同行半胱氨酸代谢。突变所表现的三种基因型中,MTRR 66AA酶活性最高,其次是66AG,66GG活性最低[13]。本研究结果显示,胚胎停育组MTRR A66G位点A、G等位基因所占比例与对照组相比无差异。但胚胎停育组MTRR基因A66G位点GG型的频率高于对照组。这提示MTRR A66G GG型频率的增加与胚胎停止发育有关。Logistic分析结果显示,携带MTHFR基因TT突变纯合型、MTRR A66G GG型是胚胎停止发育的危险因素。RFC-1酶通过协助5-甲基四氢叶酸进入胞内来帮助核酸、蛋白质和磷脂的合成,所以RFC-1基因突变的发生通过影响叶酸转运增加胎儿宫内发育缺陷的风险[14,15]。MTR是同型半胱氨酸蛋白酶的再甲基化的重要催化酶,该基因的突变通过阻碍再甲基化导致同型半胱氨酸蓄积,进一步引发胎盘血栓栓塞,而血栓栓塞的发生极易引发胎盘停止发育[16]。本研究发现RFC-1 A80G位点和MTR A2756G位点AA型、AG型和GG型频率在胚胎停育组和对照组分布无统计学差异。即RFC-1基因的A80G位点和MTR基因的A2756G位点的突变纯合型基因频率的增加与胚胎停止发育无关,这个结果也通过进一步的Logistic分析得到确证。
综上所述, MTHFR C677T位点和MTRR A66G位点与胚胎停止发育相关,对有MTHFR C677T位点和MTRR A66G位点基因突变孕产妇应积极进行干预,以预防和减少胚胎停止发育情况的发生。
