Rho激酶抑制剂在青光眼治疗中的应用进展
2019-08-15陈文诗张雨晴杨雪娇
陈文诗,宋 娜,张雨晴,杨雪娇,朱 玮,杨 先
0引言
青光眼作为第一大不可逆性致盲性眼病,是以特征性视神经萎缩和视野缺损为共同特征的疾病[1]。2010年全球青光眼患者约6000万人,预计2020年将达到8000万人,2040年全球将有1亿多青光眼患者,而中国2010年青光眼患者约有1600多万人,预计2020年将超过2000万人[2-3]。在各种类型的青光眼中最常见的是开角型青光眼[3]。高眼压是青光眼最主要的致病机制,导致眼压升高的主要原因是房水传统流出途径中小梁网(trabecular meshwork,TM)的病理学改变所致房水外流阻力增加[4]。研究表明TM细胞是房水传统流出途径的主要细胞,有调节眼压平衡的重要作用,通过这一途径房水正常流出几乎没有任何阻力,但是如果TM细胞发生功能障碍,这一无阻力的房水流出途径便产生了额外的“阻力”,导致房水外流阻力增加,这就是大部分青光眼眼压升高的原因[5]。
目前临床中延缓青光眼进展的最主要方式就是控制眼压,研究表明眼压降低20%~40%可使视野损失的进展延缓一半[6]。青光眼治疗首选降眼压药物,其次为激光和手术治疗[1]。目前最常用的降眼压药物包括拟交感神经药、β-肾上腺能阻滞剂、肾上腺能受体激动剂、前列腺素衍生物、碳酸酐酶抑制剂、高渗剂等,分别通过增加房水流出、抑制房水生成、减少眼内容积等途径降低眼压来治疗青光眼[7]。但是这些降眼压药物都没有作用于青光眼最根本的致病部位——TM细胞。此外,部分患者无法用药物控制眼压则需激光或手术治疗,然而通过这些有创的方式仍有部分青光眼患者病情进行性加重,最终导致失明。鉴于青光眼致盲的不可逆性、患病人群的庞大及目前治疗方式的局限性,寻找新的青光眼治疗方式迫在眉睫。
近期研究发现Rho激酶抑制剂(Rho-associated protein kinase inhibitor, ROCKi)主要通过改变TM细胞形态、细胞运动、胞质分裂和平滑肌收缩等影响细胞骨架,从而增加房水流出,降低眼压。ROCKi作为直接作用于TM细胞的降低眼压的新型药物,在青光眼原发病变部位进行治疗,已于2014年在日本被批准进入临床使用[8-10]。由于ROCKi具有增加血管灌注、促进视神经再生等作用,可能对视神经也有保护作用,此外,还具有减少滤过泡瘢痕化等作用[11]。综上,ROCKi作为新型降眼压药物有相当的应用前景。本文将针对Rho/Rho激酶信号通路、ROCKi的作用机制及其临床应用展开综述。
1 Rho/Rho激酶信号通路及其作用
1.1 Rho/Rho激酶信号通路Rho蛋白是由Rho基因编码的信号肽,由200~300个氨基酸组成,相对分子质量为20~30kDa。在细胞信号传导中,Rho蛋白起着开关作用,当Rho蛋白与GDP结合,使Rho蛋白激活。Rho激酶(Rho-associated protein kinase inhibitor, ROCK)为Ras超家族之一的Rho亚组,是一组分子量约为160kDa的丝氨酸/苏氨酸蛋白激酶,而激活的Rho蛋白与ROCK结合使之活化,活化的ROCK可使下游的细胞内底物磷酸化。最具代表性的底物包括肌球蛋白轻链(myosin light chain, MLC)、肌球蛋白磷酸酶底物1(myosin phosphatase substrate 1, MYPT1)、LIM激酶、CP1-17、钙调蛋白(calmodulin, CaM)和ERM蛋白质。肌球蛋白轻链激酶(myosin light chain kinase, MLCK)可以直接使MLC磷酸化,调节平滑肌的收缩,而激活的ROCK是MLCK活化的关键调控途径,并且近期研究表明RCOK可以独立调节Ca2+的血管平滑肌收缩和细胞与细胞外基质(extracellular matrix, ECM)的相互作用,来调节房水的外排[12]。同样,ROCK的激活可以使MYPT1磷酸化,抑制激动蛋白的收缩[13]。正是由于ROCK通过与这些底物相互作用,调节肌球/动蛋白收缩、细胞粘附、细胞僵硬度、细胞形态和ECM合成,从而调控房水的流出,维持眼压平衡[14]。
1.2 Rho/Rho激酶信号通路在青光眼发病机制中的作用Rho激酶的两种同工型ROCK1(ROKb/P160)和ROCK2(ROKa),具有近65%的同源性,并且由位于人体上的两种不同基因编码,分别位于18号和2号染色体。眼部组织中除晶状体外都同时有ROCK1和ROCK2的表达,以往研究表明ROCK1和ROCK2基因敲除的小鼠出现眼压降低的现象,进一步证实ROCK的缺失对眼压有降低作用[15]。在青光眼患者的房水中发现,转化生长因子β(transforming growth factor-beta,TGF-β)、溶血磷脂酸(lysophosphatidic acid,LPA)、结缔组织生长因子(connective tissue growth factor,CTGF)等细胞因子的高表达,而TGF-β能够显著增加交联肌动蛋白网络(cross-linked actin networks, CLANs)的形成,诱导ECM蛋白质的合成,并且可以促进CTGF的产出,使细胞粘附性增加,增加细胞硬度,增加房水流出阻力[16]。LPA可以诱导多种类型的细胞反应,包括ROCK调节的细胞粘附、收缩、细胞增殖、细胞迁移、细胞因子和趋化因子分泌、血小板聚集、平滑肌细胞转化和神经突回缩,可以影响TM细胞的收缩和粘附特性,并被认为参与青光眼的发病机制[17]。此外,通过比较正常眼与青光眼TM细胞骨架发现,青光眼的F-actin蛋白位于更中心的位置,并且呈无序的形态,细胞骨架的改变是青光眼的一大重要致病机制[18]。青光眼患者通过促进Rho/Rho激酶信号通路传导途径,使下游MYPT1、MLC、LIMK等细胞因子增多,肌球/动蛋白平衡改变,增加ECM蛋白质的合成,改变了细胞骨架,使细胞粘附性增加,最终导致房水流出减少,眼压升高[11]。基于ROCK在肌动蛋白管理的重要作用,所以ROCKi作为促进TM细胞房水流出的降眼压药物,也是直接作用于青光眼病变原发部位的药物而备受瞩目[19]。
2 ROCKi的降眼压作用
2.1不同ROCKi的降眼压作用机制目前研究发现不同种类的ROCKi,包括Y-27632、Y-39983、HA-1077、H-1152、K-115等均有改变TM细胞收缩的作用,一定程度增加房水流出,降低眼压。但是其作用浓度、降眼压的幅度、作用机制有一定的差异,如Y-39983局部给药降眼压作用比Y-27632明显,HA-1077对ROCK的特异性较Y-27632弱[20-22]。其中Y-27632为最近发现的一种Rho激酶抑制,也是最常用于研究改善房水流出功能机制的ROCKi,对ROCK1和ROCK2的选择性抑制几乎没有差异[14, 23]。其在不同物种有一定的降低眼压作用,下文将以Y-27632作为ROCKi代表详细讲述其降眼压的机制。
在体外实验中,通过Y-27632处理的人TM细胞在显微镜下观察出现了细胞收缩、变圆的形态学变化,并且在免疫荧光显微镜下观察到通过Y-27632处理的细胞大部分肌动蛋白束消失、粘着斑的减少等细胞骨架的改变,并且明显抑制了TGF-β诱导CLANs的形成, 定量PCR发现Y-27632处理过的细胞明显比地塞米松处理过的细胞纤维连接蛋白、ECM蛋白的表达低,Western免疫印记可以看出经过Y-27632使细胞纤维连接蛋白,胶原蛋白1A和波形蛋白的表达显着降低,并且Y-27632可以诱导肌球蛋白轻链的去磷酸化,而MLC磷酸化状态是Rho//Rho激酶信号通路调节细胞和松弛的重要因素[16, 24-25]。凝血酶增加细胞硬度高达200%,而同时加入Y-27632可使细胞硬度减低到40%~80%;凝血酶可使细胞电阻增加到160%,而Y-27632将细胞电阻降低至60%左右,并导致细胞与细胞的分离[26]。这些都表明Y-27632通过对细胞骨架和ECM的影响,从而改善房水流出功能,起到降眼压作用。另外,以往研究表明一氧化氮(nitric oxide,NO)对TM细胞有放松作用,增加房水流出量,并且青光病患者眼中NO和NOS的表达水平降低,ROCKi对eNOS mRNA和NO产生的促进作用,这也可能与其降眼压作用有关[27]。除了目前较常使用的ROCKi,最近又新发现了一种新型ROCKi—SB772077B,在和Y-27632相同浓度处理细胞显示出更明显的细胞收缩,肌蛋白束和黏着斑的减少。这种新型ROCKi对ROCK1的选择性比ROCK2更高[28]。
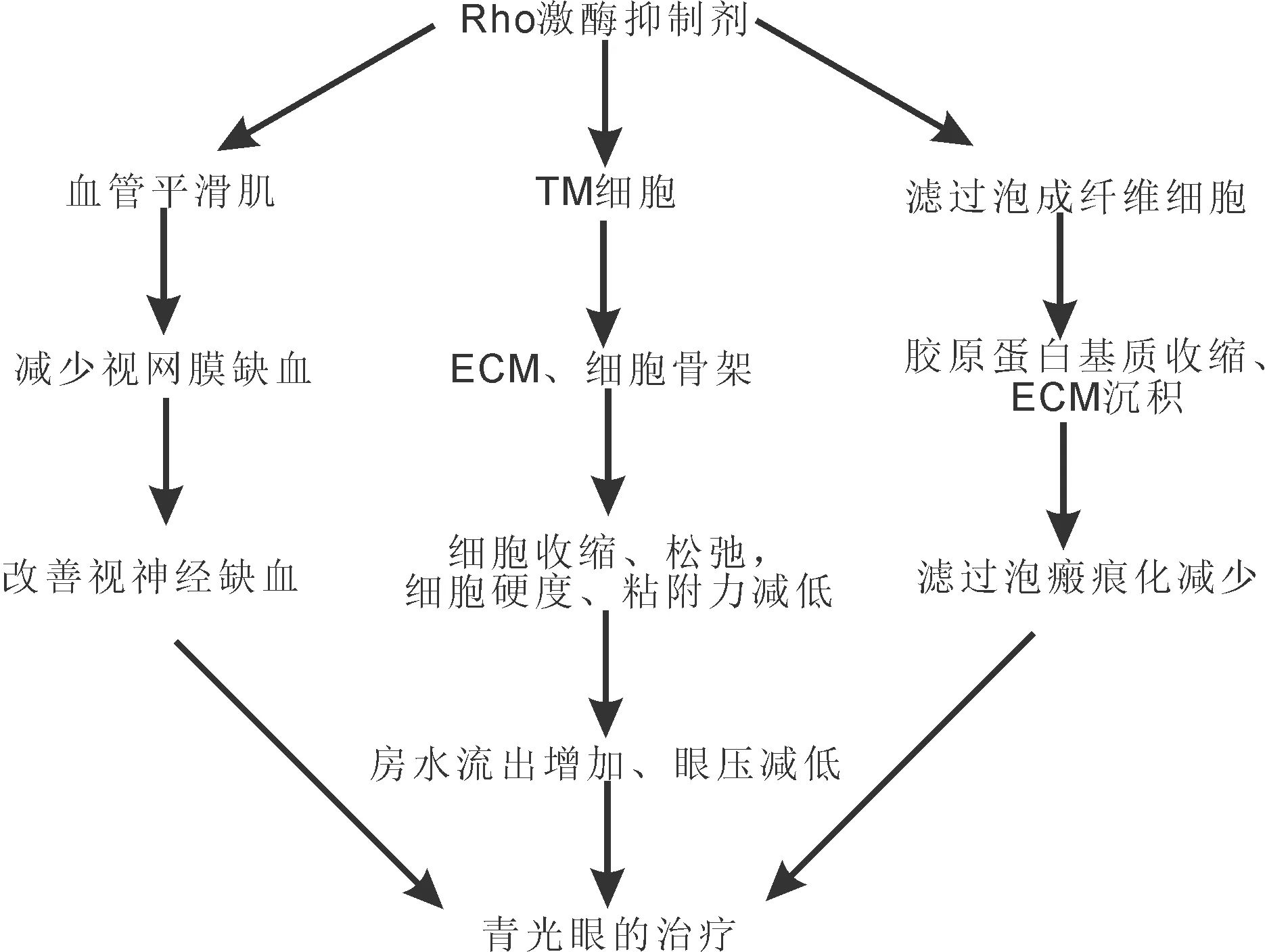
2.2 Y-27632在不同物种中的降眼压作用1997年首次通过局部给药、前房注射、玻璃体注射Y-27632分别测量兔眼的眼压和房水流畅系数、瞳孔直径,结果发现Y-27632有明显增加房水流出、增大瞳孔直径和降眼压的图1Rho激酶抑制剂在青光眼治疗中的作用模式图。
作用[29]。之后Y-27632作为最常用的ROCKi在不同物种实验中被广泛用于ROCKi的降眼压机制研究。在体内实验中,Y-27632在小鼠、兔、猪、猴、人身上都有显著增加房水流出,降低眼压的作用[15]。在猪眼、猴眼和人眼灌注模型中,灌注不同压力的Y-27632都呈现出近管小梁组织(juxtacanalicular TM,JCT)增厚,与房水流畅系数显著增大的结果成正相关[23]。但是由于灌注系统的不同,达到显著差异的时间和灌注量不同种类也不相同,无法进行种群的比较[24, 30-31]。但是可以明显看出Y-27632有改善房水外流的作用(图1)。
3 ROCKi在青光眼领域中的临床应用
3.1 ROCKi的降眼压应用基于以上体内外实验的研究,一些医药公司开始探索ROCKi在人体中降眼压的影响,相继研发新药物,在评估人体临床安全性和有效性后,目前研发出的药物包括Ripasudil(K-115)、Fasudil(HA-1077)、SNJ-1656、AMA0076、AR-12286和Netarsudil(AR-13324)等,其中Fasudil为虽然被批准运用于临床,但是还未用于青光眼的治疗[32], Ripasudil(Kowa)和Netarsudil(Aerie),分别在日本和美国成功进入Ⅲ期临床试验阶段。在Ⅲ期临床试验中,每日两次局部给予0.4% ripasudil平均减少青光眼患者昼夜眼压2.9mmHg。Ripasudil最近在日本获得批准用于治疗高眼压和青光眼,并且这种药物与β受体阻滞剂噻吗洛尔联用时可以增强疗效,这也预示作为与其他降眼压药物有不同降眼压机制的ROCKi可与其他类型降眼压药物联用,增大降眼压的效果。在Ripasudil Ⅲ期临床试验中发现,轻度结膜充血为最常见的不良反应,发生率高达75%。此外,结膜炎、点状角膜炎等也有发生[8, 14]。Netarsudil为ROCK/去甲肾上腺素转运蛋白(norepinephrine transporter, NET)抑制剂化合物,除了作为RCCK抑制剂的作用外,还有抑制去甲肾上腺素的作用,具有持续降眼压的作用,并且局部耐受性好,仅有轻度的结膜充血反应[33]。针对现有ROCKi药物的不良反应,目前改进的手段包括使用ROCK2特异性抑制药物KD025和短效的温和型ROCKi。不过目前看来,经过3a的临床应用,目前还没有发生较严重的不良事件[34]。因此,ROCKi这一直接作用于TM细胞的可以显著降眼压的新型药物是值得期待的。
3.2 ROCKi的其他眼部效应有研究表明,ROCKi除了作用于TM细胞而降低眼压外,对眼部其他部位的作用也可能有额外的效果,如延缓青光眼的进展、降低青光眼术后滤过道瘢痕化等。青光眼性视神经损伤的机制之一是血管缺血,导致视神经供血不足。最近,在小鼠动物模型中发现Ripasudil可以减轻视网膜水肿、减少缺血灌注区、改善视网膜静脉的灌注[10]。因此,ROCKi对于减缓青光眼的进展,不仅是由于降低眼压,还可能通过改善视神经缺血而发挥作用。此外,有研究报道称ROCKi对小鼠的视神经具有保护作用,可促进视神经轴突的再生,但在人体上是否也有同样的效果仍需进一步试验,如果在人身上有同样作用,那么ROCKi不仅在TM细胞上有着降眼压的作用,并且对于视神经也可能具有保护作用。另外,目前青光眼滤过手术失败的主要原因就是滤过泡和ECM沉积物瘢痕化,成纤维细胞转分化为肌成纤维细胞是伤口愈合和瘢痕形成的关键步骤,与ECM蛋白、生长因子和整合素的表达增强有关,最近研究表明ROCKi可通过抑制成纤维细胞转分化为肌成纤维细胞来减少瘢痕,主要是通过抑制TGF-β信号传导和LPA诱导的纤维化反应减少胶原蛋白基质收缩和ECM沉积[11](图1)。
4展望
综合前期的基础研究、临床试验及近3a的临床应用,ROCKi作为直接作用于TM细胞的新型降眼压药物的效果是值得肯定的。如果今后进一步研究发现ROCKi在人体上也有增加血液灌注,促进视神经再生的作用,那么ROCKi对于青光眼患者治疗中的应用价值可能会进一步提升。但是,目前对于ROCKi的认识还不够充分,其降眼压的机制尚未有完全的认识,需要进一步的研究。
