靶向人TIM3单抗制备及对肝癌细胞增殖的影响
2019-08-15刘晓波谭浩明邱敏婵
汪 琦 刘晓波 谭浩明 邱敏婵
(广东药科大学基础学院,广州510006)
在正常机体环境中,免疫检查点可对免疫应答的强度和持续性进行调节,防止在清除异常细胞过程中损伤正常组织,而在肿瘤微环境中,免疫检查点通路被利用,抑制性信号被进一步放大,T细胞功能受到抑制,导致肿瘤免疫逃逸[1]。通过抗体阻断免疫检查点抑制性信号通路,可调节T细胞抗肿瘤活性,达到抗肿瘤的效果。近年来,免疫检查点治疗已经成为抗肿瘤治疗的热点之一,在T细胞上已经发现了29个免疫球蛋白超级家族,为免疫检查点疗法抗肿瘤治疗提供了广阔的发展前景[2],T 细胞免疫球蛋白黏蛋白分子-3(T cell immunoglobulin domain and mucin domain-containing molecule-3,TIM3)就是其中备受关注的免疫检查点之一。
TIM3是一种跨膜糖蛋白,属于TIM 家族,其基本结构包括信号肽、免疫球蛋白样区、黏蛋白样区、跨膜区和具有磷酸化位点的胞内区,研究显示,TIM3在许多恶性肿瘤中高表达,在肿瘤的免疫逃逸、发生及发展中发挥着重要作用。利用抗TIM3抗体靶向封闭TIM-3的表达,可增强肿瘤微环境中T细胞的增殖和效应因子的产生,从而发挥抗肿瘤作用[3],同时还可改善自然杀伤细胞(NK细胞)的增殖,恢复NK细胞的免疫应答,从而抑制肿瘤转移和增殖[4]。抗TIM-3抗体在肿瘤诊断和治疗中应用广阔,但目前国内外尚未有抗TIM-3抗体药物上市。本研究通过杂交瘤技术制备抗人TIM3 单克隆抗体,经过多次筛选,获得一株分泌抗人TIM3单克隆抗体细胞株FD12,纯化的抗体对肝癌细胞HepG2增殖具有一定的抑制作用,研究结果将为进一步药物研发奠定基础。
1 材料与方法
1.1实验材料 实验用RPMI1640、DMEM高糖培养基、氨苄青霉素-链霉素均为美国Gibco公司产品,HAT、HT、弗氏完全和不完全佐剂购自美国Sigma公司,聚乙二醇2000购自BBI公司,羊抗小鼠IgG/HRP为武汉博士德产品,ELISA显色试剂购于碧云天生物技术公司,BCA蛋白定量试剂盒购于康为世纪,抗体亚型鉴定试剂盒购于北京博奥龙生物公司,胎牛血清、小牛血清为杭州四季青产品。
小鼠骨髓瘤细胞SP2/0由广东药科大学生命科学与制药学院田素娟教授惠赠,HepG2细胞由广东药科大学基础学院张咏莉教授惠赠,正常人肝细胞L7702由本室保种。多肽序列由苏州强耀生物公司体外合成。实验动物为雌性BALB/c小鼠,8周龄,由广东药科大学实验动物中心提供。
1.2方法
1.2.1抗原表位的筛选及合成 从Genebank获得人TIM3基因和蛋白序列(accession NM_032782.4),利用www.nih.gov中抗原表位分析预测软件进行抗原表位的筛选。筛选出的氨基酸片段,由苏州强耀公司合成。
1.2.2小鼠免疫 小鼠4只,3只免疫TIM3多肽,1只作为正常对照。常规方法免疫。
1.2.3细胞培养 骨髓瘤细胞培养基为20%的小牛血清1640,肝癌细胞HepG2的培养基为10%胎牛血清的高糖DMEM,肝细胞L7702的培养基为10%的小牛血清DMEM,细胞培养条件为5%CO2和37℃。
1.2.4细胞融合 常规方法进行。小鼠脾细胞与SP2/0细胞融合比例为10∶1。
1.2.5杂交瘤细胞的筛选及亚克隆 常规HAT培养液选择培养,HT过渡培养。常规间接ELISA法检测上清液抗体滴度。选择OD值最高的3个孔细胞,混匀并稀释到10个细胞/ml,铺板筛选。收集单克隆孔上清液检测抗体滴度。选择最高OD值3孔细胞,再次铺板筛选,重复至所有单克隆细胞孔检测均为阳性。
1.2.6单抗的纯化及亚型测定 辛酸-硫酸铵沉淀法纯化抗TIM3单克隆抗体,BCA法定量抗体蛋白。亚型鉴定按说明书进行。
1.2.7MTT法检测肝癌细胞增殖 HepG2细胞浓度2×106个/ml,每孔100 μl。细胞培养12 h仅加入一次抗体,为单次加药实验,细胞培养12 h和24 h 分别加入等量的抗体,为连续加药实验。MTT工作液浓度为5 mg/ml,常规检测。
1.3统计学处理 所有数据采用t检验,进行组间差异分析。P<0.05判定为差异有统计学意义。
2 结果
2.1小鼠血清抗体效价的测定 血清按1∶1 000、1∶2 000、1∶5 000稀释,正常小鼠血清1∶200稀释作为对照。1号小鼠效价如表1所示。
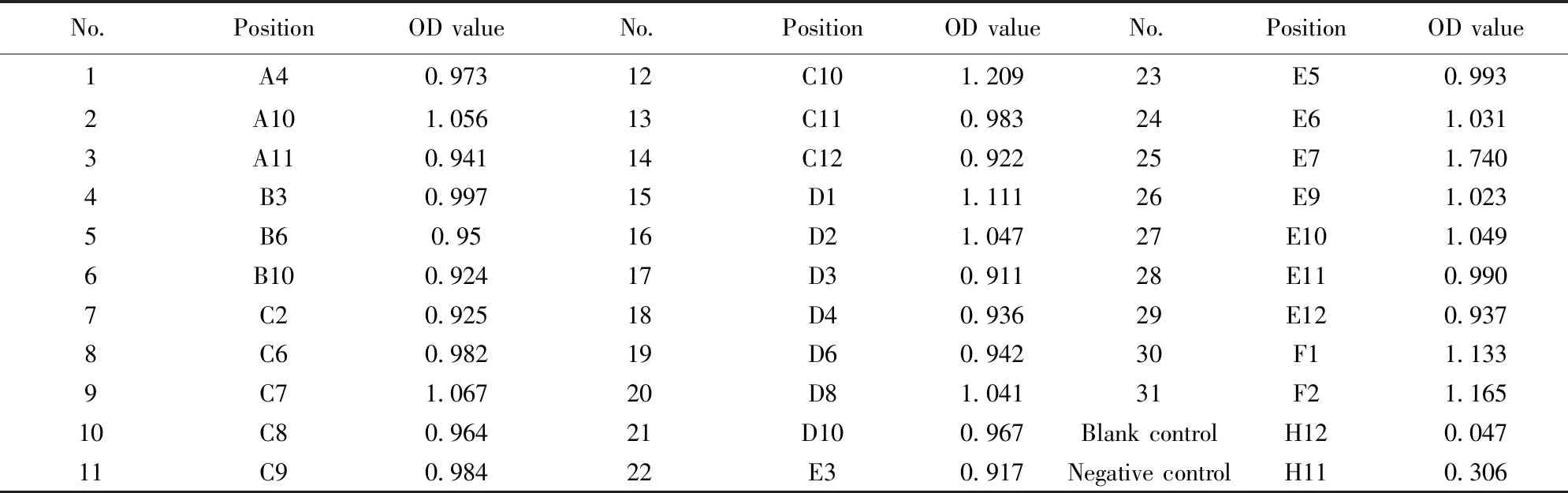
2.2阳性杂交瘤细胞的筛选 杂交瘤融合率达80%。间接ELISA法检测,筛选OD值最大的3个孔,进行第一次亚克隆。重复上述步骤,直至所有的单克隆孔为阳性。表2为最终筛选的阳性孔。
2.3抗TIM3单克隆抗体FD12的亚型鉴定、纯化及定量 胶体金试剂盒检测显示分泌的抗体为免疫球蛋白G(IgG),轻链为kappa链 (κ链)。根据亚型鉴定结果,选择辛酸-硫酸铵沉淀法纯化抗体,BCA法检测纯化蛋白的浓度为0.3 mg/ml。
2.4抗TIM3单克隆抗体对肝癌细胞HepG2增殖的抑制 纯化的抗TIM3抗体首先检测其对正常肝细胞和肝癌细胞的增殖影响。实验分为4组,分别为PBS作用于肝细胞、PBS作用于肝癌细胞、抗TIM3抗体作用于肝细胞、抗TIM3抗体作用于肝癌细胞。结果显示,12 h后抗TIM3抗体明显抑制肝癌细胞的增殖,和其他三组比较差异均有统计学意义(P<0.05),而抗TIM3抗体对肝细胞的增殖未出现明显抑制,t检验显示和PBS实验对照组无显著差异,说明本课题组制备的抗TIM3抗体具有抑制肿瘤增殖的活性,对正常细胞增殖无影响(图1)。随后课题组对抗体的药效及给药方式进行了进一步研究。单次加药后36 h检测肝癌细胞的增殖,结果表明,肝癌细胞的增殖受到明显的抑制,实验组和PBS对照组存在统计学差异,且差异有统计学意义(P<0.05),说明抗体在36 h后依然具有抑制肝癌细胞增殖的活性(图2)。在细胞培养12、24 h分别加入抗体,继续培养12 h后检测,结果显示,抗体对HepG2增殖具有明显抑制作用,实验组和对照组差异有统计学意义(P<0.05),且连续加药具有更强的抑制效应(图3)。
表1 间接ELISA测定小鼠血清抗体效价
Tab.1 Serum antibody titters of mice determined by indirect ELISA

Dilution ratioof serumA492 value(x±s)A ratio(immunized mice/normal mice)Mouse No.11∶1 0002.56±0.01234.591∶2 0002.22±0.03830.001∶5 0001.88±0.00925.41Normal mouse1∶2000.074±0.0081.00
表2 阳性单克隆抗体筛选结果
Tab.2 Scanning of specific anti-TIM3 antibody
No.PositionOD valueNo.PositionOD valueNo.PositionOD value1A40.97312C101.20923E50.9932A101.05613C110.98324E61.0313A110.94114C120.92225E71.7404B30.99715D11.11126E91.0235B60.9516D21.04727E101.0496B100.92417D30.91128E110.9907C20.92518D40.93629E120.9378C60.98219D60.94230F11.1339C71.06720D81.04131F21.16510C80.96421D100.967Blank controlH120.04711C90.98422E30.917Negative controlH110.306

图1 抗TIM3抗体对肝细胞和肝癌细胞增殖的影响Fig.1 Effect of anti-TIM3 antibody on proliferation of liver cells and HepG2 cells

图2 抗体36 h后对HepG2增殖的影响Fig.2 Effect of anti-TIM3 antibody on proliferation of HepG2 at 36 hours

图3 两次抗体加药对HepG2增殖的影响Fig.3 Effect of anti-TIM3 antibody on proliferation of HepG2 with two dosings
3 讨论
肿瘤免疫逃逸一直是治疗难题,但近年来研究发现,免疫检查点阻断药物能阻断肿瘤细胞对免疫系统的负向调节作用,增强免疫系统对肿瘤细胞监视攻击的能力[5],阻断PD-1、CTLA4信号途径的药物已进入临床,并取得良好疗效,但也存在着诸如脱靶效应、个体疗效差异等问题,研发更多的免疫检查点阻断药物迫在眉睫,TIM3就是目前热门的候选靶点之一。
TIM3最初被认为仅表达于Th1细胞,随后发现CD8+T细胞、Treg、DC、NK细胞以及肿瘤细胞均可表达[6]。异于其他免疫检查点分子,TIM3诱导性表达于炎症和肿瘤微环境中的T细胞表面。在肿瘤组织浸润CD4+T细胞和CD8+T细胞,TIM3的表达明显高于癌旁组织,其异常表达与预后不良密切相关[7,8],肿瘤浸润巨噬细胞上TIM3的高表达可诱导巨噬细胞向M2型极化,促进肝细胞肝癌的发展。在非小细胞肺癌(Non-small cell lung cancer,NSCLC)患者中,TIM3在NSCLC浸润巨噬细胞上过表达,并与肿瘤大小、淋巴结转移及TNM分期密切相关[9]。肿瘤微环境中TIM3影响髓系抑制细胞(MDSCs)的增殖和抑制NK细胞功能,促进肿瘤发展[10]。在癌症的发生和发展过程中,TIM3通过与配体的结合,引起T细胞衰竭,目前已发现的TIM3配体有三种:半乳糖凝集素9(Galactin 9,Gal-9)、高迁移率族蛋白1(High mobility group box 1 protein,HMGB1)、癌胚抗原相关细胞黏附分子1(Carcino-embryonic antigen related cellular adhesion molecule 1,CEACAM1),TIM3与配体结合所涉及的信号转导途径目前仍不清楚。但毫无疑问,由TIM3诱导的T淋巴细胞凋亡是导致肿瘤细胞发生免疫逃逸的重要原因之一。抗TIM3和抗Gal-9抗体可以解除由过量Gal-9表达特异性诱导的CD4+T细胞的凋亡,恢复T细胞的抗肿瘤效应[11]。TIM3阻断剂能够提高机体固有免疫功能,增强机体抗肿瘤效应[12]。在HNSCC小鼠模型中,靶向抑制TIM3可诱导CD4+CD25+Foxp3+Treg细胞降低,增强抗癌免疫反应[13]。抗TIM3抗体还可促进IFN-γ介导的T-细胞抗肿瘤免疫反应,抑制肿瘤生长[14]。
纵观目前文献中靶向TIM3治疗肿瘤的机理,均涉及T-细胞介导的抗肿瘤免疫效应。但本课题组将HepG2细胞株与抗体共孵育,却检测到HepG2细胞的增殖受到显著抑制,HepG2是高表达TIM3的细胞株,是否封闭TIM3靶点可以直接作用于高表达TIM3的肿瘤细胞,并诱导其凋亡,仍需要进一步的研究。本次实验所用抗体采用辛酸-硫酸铵沉淀法,所获抗体纯度不高,但作用于HepG2细胞,却显著抑制该细胞的增殖,表明所制备的抗TIM3抗体可能具有较高的抑癌活性,为进一步深入研究该抗体的抗肿瘤活性及临床研发奠定了基础。
