CaMKⅡδ基因沉默对破骨细胞分化功能及c-fos/c-jun/CREB基因的影响
2019-08-14张誉泓戚孟春董伟孙红
张誉泓 戚孟春 董伟 孙红
1.华北理工大学口腔医学院口腔颌面外科教研室 唐山 063000;
2.华北理工大学基础医学院病理教研室 唐山 063000
许多骨过度吸收性疾病(如骨质疏松、Paget氏病、多发性骨髓瘤、原发性/转移性骨肿瘤、牙周炎、风湿性关节炎等)在临床上均表现为破骨细胞(osteoclasts)数目和活性的异常升高[1-2]。对上述疾病的治疗,最主要的方法是抑制破骨细胞介导的骨吸收,因此有关破骨细胞分化调控的研究显得尤为重要。
Ca2+/钙调蛋白(calmodulin)/活化T细胞核因子(nuclear factor of activated T-cell,NFATc)1 是破骨细胞生成的重要信号通路之一。在钙调蛋白下游,钙调蛋白依赖性激酶(calmodulin-dependent kinase,CaMK)是钙调神经磷酸酶(calcineurin)之外的另一类信号分子,CaMK包括CaMKⅠ、CaMKⅡ、CaMKⅣ。在CaMKⅡ的4个异构体(α、β、γ、δ)中,CaMKⅡδ在破骨细胞分化不同阶段均呈持续性高表达,提示其作用可能更加关键[3]。破骨细胞经核因子-κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)诱导后,调控下游c-Fos、c-Jun、环腺苷酸反应原件结合蛋白(cyclic adenosine mono phosphate responsive elementbinding protein,CREB)等一系列信号分子[4-6]。然而,CaMKⅡδ对破骨细胞中c-fos、c-jun、CREB的表达发挥怎样的调控作用,目前还知之甚少。本研究通过构建CaMKⅡδ慢病毒干扰载体,探索其在mRNA和蛋白质水平对c-fos、c-jun、CREB表达的影响,以揭示CaMKⅡδ调控破骨细胞可能的分子机制。
1 材料和方法
1.1 细胞和主要试剂
小鼠白血病单核巨噬细胞株RAW264.7细胞(中国科学院典型培养物保藏委员会细胞库);RANKL及胎牛血清(Biovision公司,美国);Dulbecco改良Eagle培养基(Dulbecco’s modified Eagle medium,DMEM;Hyclone公司,美国);耐酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒(Sigma公司,美国);兔抗鼠CaMKⅡδ单克隆抗体(Abcam公司,英国);小鼠单克隆c-Fos抗体、兔单克隆c-Jun抗体(Abcam公司,英国);兔抗鼠CREB抗体(Cell Signaling Techonlogy公司,英国);SYBR PremixEx TaqTM(TaKaRa公司,日本);聚合酶链式反应(polymerase chain reaction,PCR)引物(Invitrogen公司,美国)等。
1.2 CaMKⅡδ RNA干扰效率测定
笔者课题组[7]在前期研究中成功构建了重组慢病毒CaMKⅡδ小干扰RNA(small interfe ring RNA,siRNA)载体。以最佳感染复数(multiplicity of infection,MOI)等于30转染RAW264.7细胞,将RAW264.7细胞分为3组:对照组、阴性载体组和干扰载体组。病毒转染12 h后,更换新鲜培养基;1 d后加入50 ng·mL-1RANKL诱导破骨细胞分化。于RANKL诱导5 d后收获细胞,进行相关检测。
实时PCR检测:Trizol法提取细胞总RNA,通过逆转录合成互补DNA(complementary DNA,cDNA),使用Rotor-Gene3000荧光定量PCR仪进行检测。CaMKⅡδ引物:上游5’-CAGTGGAGCTGTCTGTCGTT-3’,下游5’-GCAGACTACCACGCA ACTCA-3’(409 bp);编码内参β-肌动蛋白的基因(NM_007393.3)的引物,上游5’-GTTGGAGCAAACATCCCCCA-3’,下游5’-CGCGACCATCCTCCTCTTAG-3’(186 bp)。PCR反应条件为:95 ℃ 30 s,然后95 ℃ 15 s、55 ℃ 20 s、72 ℃20 s,共40个循环。通过Rotor-Gene软件自动计算目的基因mRNA相对水平。每组实验设置3个副孔,并重复3次。
Western-blotting检测:放射免疫沉淀分析法提取3组细胞总蛋白质,用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白质浓度。加入5倍浓度上样缓冲液,煮沸变性,电泳并转膜;5%牛血清白蛋白室温封闭后加兔抗鼠CaMKⅡδ一抗4 ℃孵育过夜。羊抗兔二抗孵育40~60 min,ECL显色仪上显色1 min,以β-肌动蛋白为内参。Image J软件检测膜上蛋白质条带的灰度值,实验重复3次。
1.3 CaMKⅡδ基因沉默对破骨细胞形成的影响
TRAP染色:5 d后收获的细胞用多聚甲醛固定。纯水洗涤细胞3次,固定0.5~1 h,纯水洗涤细胞爬片。配制染色液、反应液。取固定后的细胞,每孔加入0.5 mL反应液,37 ℃避光静止放置,染色1 h;吸去反应液,纯水冲洗,滴加苏木精进行细胞核染色15~30 s;滴加甘油封片,用200倍光学显微镜观察,记录每个视野中细胞核数目大于或等于3个且细胞质呈红色的破骨细胞数目,共观察6个视野,取平均值。
牛骨吸收陷窝检测:制备新鲜牛骨骨密质磨片(厚约0.2 mm),灭菌后将三代以内细胞以2×104cm-2接种其上。3组细胞实验处理5 d后收获骨磨片,扫描电子显微镜观察。放大500倍条件下随机选取6个视野观察吸收陷窝,应用图像分析软件Med 6.0测量吸收陷窝的数目和面积总和,每组检测5个磨片。
1.4 CaMKⅡδ基因沉默对c-fos、c-jun、CREB表达的影响(NM_007393.3)
Trizol法提取细胞总RNA,逆转录合成cDNA;用Rotor-Gene3000荧光定量PCR仪进行检测。β-肌动蛋白基因的引物:上游5’-GT TGGAGCAA ACATCCCCCA-3’,下游5’-CGCG AC CATCCTCCTCTTAG-3’(186 bp);c-fos引物:上游5’- GGCTTTCCCCAAACTTCGAC-3’,下游5’- GCGCAAAAGTCCTGTGTGTT-3’(173 bp);c-jun引物:上游5’-TGGGAGGGGTTACAA ACTGC-3’,下游5’-TAGCCTGGCACTTAC- AAGCC-3’(109 bp);CREB引物:上游5’-CCGAATTCATGACCATGGA ATCTGGAGC-3’,下游5’-GGTCTAGATTAATCT GATTTGTGGCAGT-3’(109 bp)。c-fos、c-jun和CREB基因的登记号分别是NM_010234.2、NM_010591.2和NM_001037726.1。
PCR的反应条件为:95 ℃ 30 s,然后95 ℃15 s、55 ℃ 20 s、72 ℃ 20 s,共40个循环。通过Rotor-Gene软件自动计算目的基因mRNA相对水平。每组实验设置3个副孔,并重复3次。
1.5 CaMKⅡδ基因沉默对c-Fos、c-Jun、CREB的影响
病毒转染细胞1 d后,加入50 ng·mL-1RANKL诱导其向破骨细胞分化,并于诱导作用2 d后收获细胞,Western-blotting检测c-Fos、c-Jun、CREB,方法同前。
1.6 统计学分析
定量数据采用均数±标准差表示。应用SPSS 17.0软件对实验1.2中数据进行单因素方差分析,实验1.3~1.5数据采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 CaMKⅡδ siRNA慢病毒载体干扰效率测定
经实时PCR检测,对照组、阴性载体组和干扰载体组中CaMKⅡδ mRNA相对表达水平分别为1.282±0.234、0.950±0.275和0.377±0.148(P<0.05);对照组与阴性载体组之间差异无统计学意义(P>0.05),而干扰载体组较对照组下降了70.6%(P<0.01),也就是mRNA干扰效率为70.6经Western-blotting检测(图2),对照组、阴性载体组和干扰载体组中CaMKⅡδ的相对表达水平(与β-肌动蛋白表达水平的比值)分别为1.063 ±0.457、1.006±0.139和0.295±0.032;对照组与阴性载体组差异无统计学意义(P>0.05);干扰载体组中CaMKⅡδ的水平较对照组下降了72.2 %(P< 0.01),即在蛋白质水平,干扰效率为72.2 %。
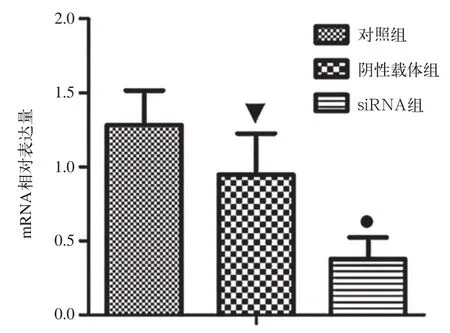
图 1 实时PCR检测CaMKⅡδ mRNA水平Fig 1 CaMKⅡδ mRNA levels detected by real-time PCR
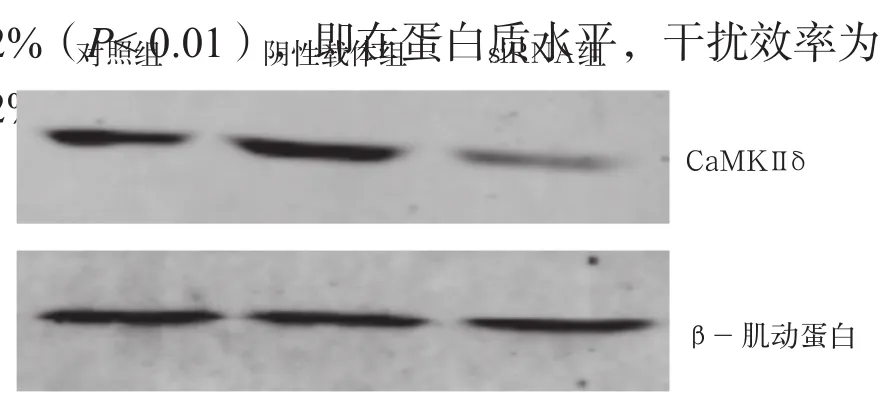
图 2 Western-blotting检测CaMKⅡδ表达水平Fig 2 CaMKⅡδ levels detected by Western-blotting
2.2 CaMKⅡδ基因沉默对破骨细胞生成、分化功能的影响
细胞培养5 d后,3组细胞均出现了TRAP染色阳性的多核破骨细胞,空白对照组和阴性载体组细胞质红染的多核破骨细胞的数目较多,体积较大;干扰载体组细胞质红染的多核破骨细胞的数目较少,体积小。定量数据表明,干扰载体组中红染破骨细胞数目为4.0±1.6,较对照组(12.7±2.5)及阴性载体组(11.0±1.6)明显减少,分别下降68.5%和63.6%,其差异具有统计学意义(P<0.05)。对照组和阴性载体组间细胞质红染的多核破骨细胞的数目无明显差异(P>0.05)。结果表明,CaMKⅡδ基因沉默可显著抑制破骨细胞分化。
扫描电镜观察,3组细胞在牛骨磨片上均有不同程度的骨吸收陷窝形成,其中干扰载体组吸收陷窝数目明显低于对照组和阴性载体组(图3)。定量分析表明,干扰载体组中骨吸收陷窝的数目为3.0±2.3,骨吸收陷窝的面积为(2 437.0±143.7)μm2,显著低于对照组中的10.0±2.7和(5 694.0±536.2)μm2以及阴性载体组中的12.0±1.2和(5 247.0±635.2)μm2,差异具有统计学意义(P<0.05)。其中,干扰载体组骨吸收陷窝的数目较对照组和阴性载体组分别下降了67.1%和65.7%,干扰载体组中骨吸收陷窝的面积较对照组和阴性载体组分别下降了52.3%和48.2%。对照组与阴性载体组相比,破骨细胞数目、骨吸收陷窝的数目和面积的差异无统计学意义(P>0.05)。实验结果提示,CaMKⅡδ基因沉默可显著抑制破骨细胞生成和分化。
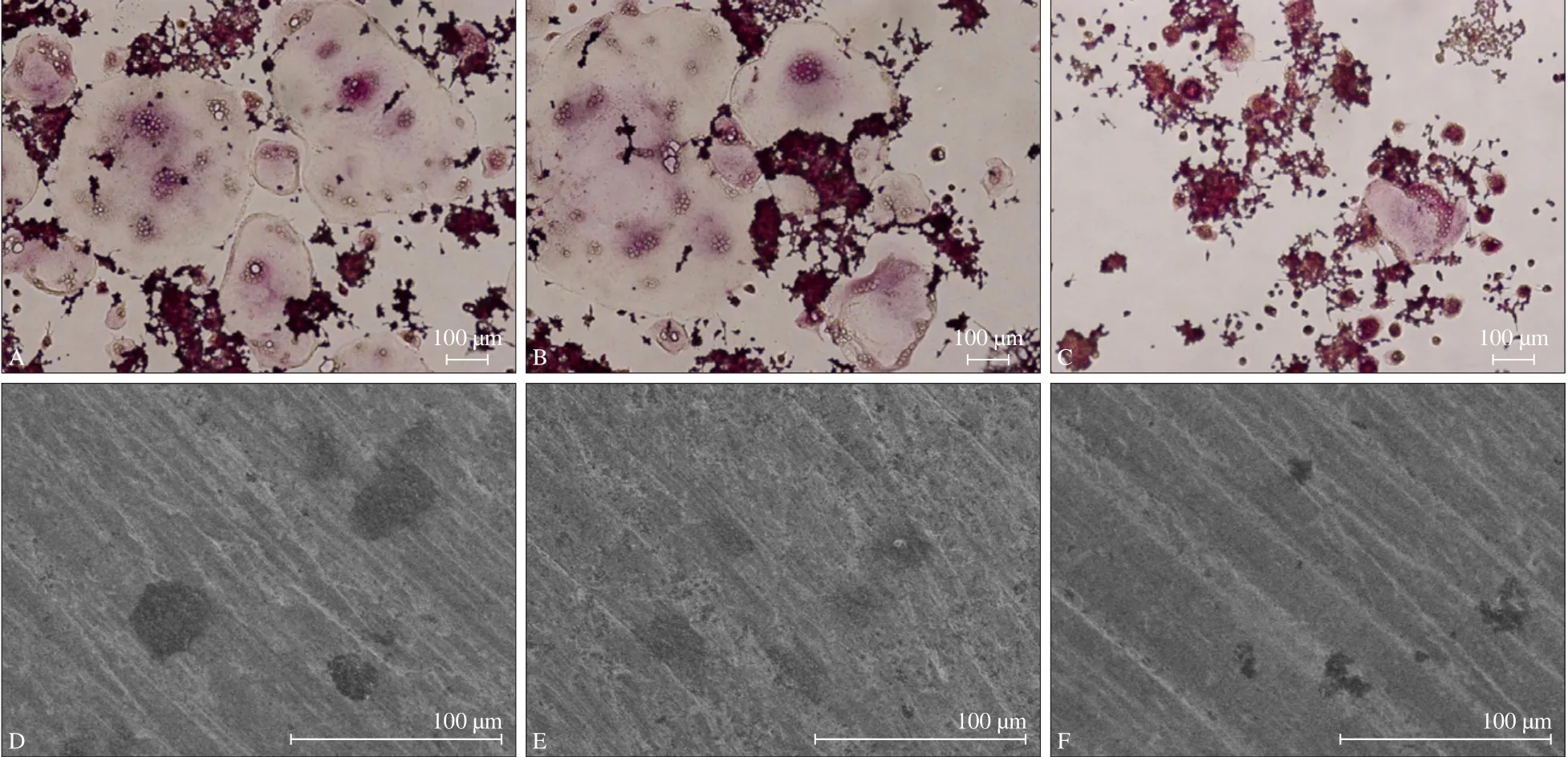
图 3 TRAP、牛骨吸收陷窝检测破骨细胞的形成Fig 3 Osteoclast differentiation detected by TRAP and bovine bone resorption lacuna
2.3 CaMKⅡδ基因沉默对c-fos、c-jun、CREB表达的影响
经实时PCR检测(图4),对照组、阴性载体组和干扰载体组中c-fos mRNA相对表达水平分别为1.00±0.97、0.98±0.86和0.26±0.19(P<0.05);c-jun mRNA相对表达水平分别为1.0±0.89、1.04±0.93和0.76±0.63(P<0.05);CREB mRNA相对表达水平分别为1.00±0.92、0.94±0.79和0.51±0.48(P<0.05)。对照组与阴性载体组的差异无统计学意义(P>0.05),而干扰载体组c-fos mRNA、c-jun mRNA和CREB mRNA相对表达水平较对照组分别下降了7 4%、2 4%和4 9%(P<0.01)。
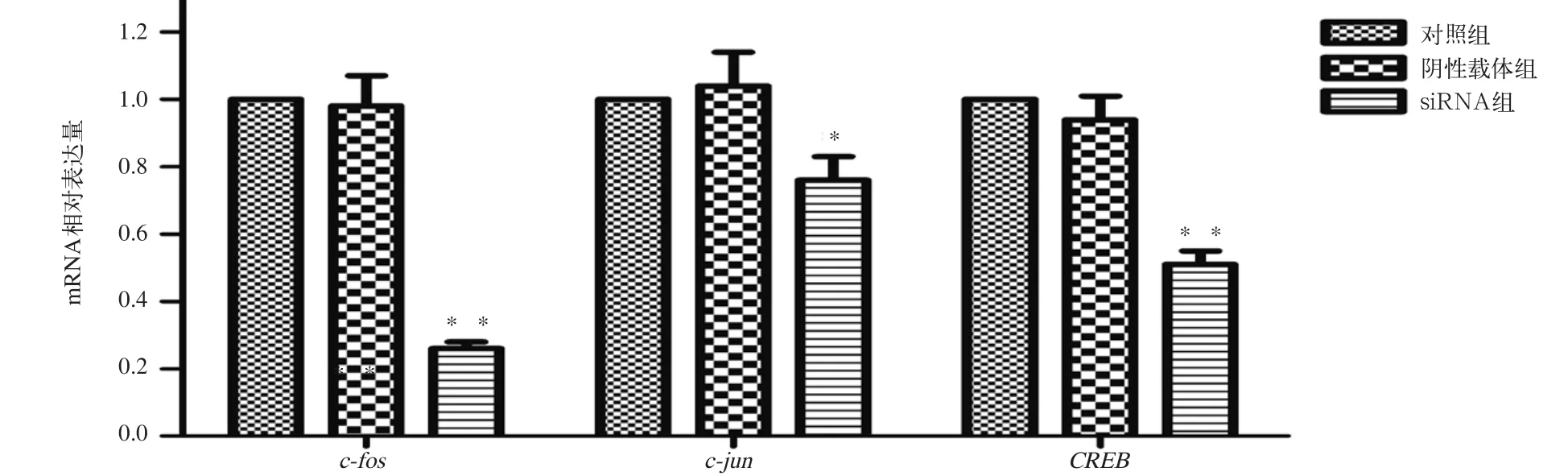
图 4 实时PCR检测c-fos mRNA、c-jun mRNA和CREB mRNA水平Fig 4 c-fos mRNA, c-jun mRNA and CREB mRNA detected by real-time PCR
2.4 CaMKⅡδ基因沉默对c-Fos、c-Jun和CREB表达的影响
经过Western-blot检测,各组蛋白质条带的情况如图5所示,干扰载体组c-Fos、c-Jun、CREB与β-肌动蛋白的比值分别为0.33±0.02、0.41±0.03和0.49±0.05,显著低于对照组的1.27±0.14、1.05±0.96和1.12±0.13(P<0.05),分别下降了74.3%、61.3%和59.2%。蛋白质检测结果说明,CaMKⅡδ基因沉默可显著抑制c-F 和CREB的表达。
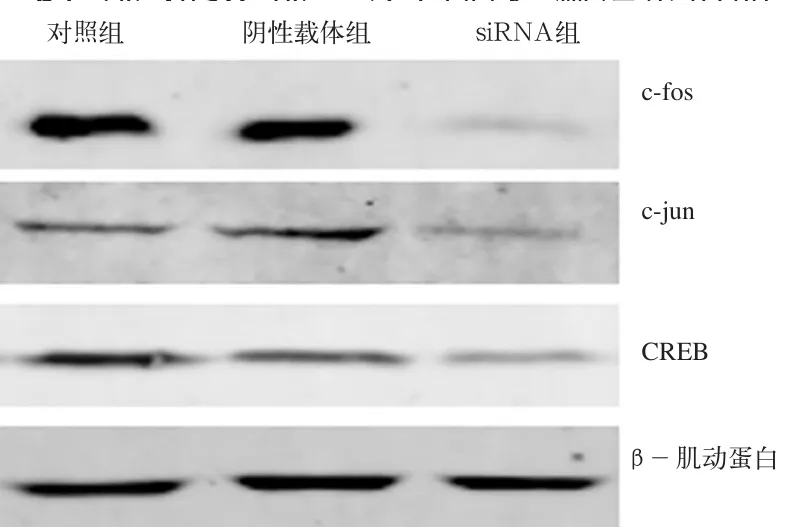
图 5 Western-blotting检测c-Fos、c-Jun和CREB表达Fig 5 Expression of c-Fos, c-Jun and CREB detected by Western-blotting
3 讨论
破骨细胞在骨吸收过程中具有重要作用[8]。破骨细胞发挥作用是多种细胞因子共同作用的结果,其中Ca2+/钙调蛋白/NFATc1与核因子-κB受体活化因子(receptor activator of nuclear factor-κB,RANK)/RANKL/骨保护素(osteoprotegerin,OPG)轴是破骨细胞生成、调控的重要信号通路,而核因子(nuclear factor,NF)-κB是RANKL诱导破骨细胞分化与成熟的重要转录因子。在RANKL激活NF-κB的同时,还调节多个破骨细胞分化相关转录因子,如AP-1、NFATc1。
破骨细胞中c-Fos的主要功能是通过促进NFATc1的表达以及与NFATc1协同作用,触发转录调节级联反应,导致破骨细胞分化和功能活化中的多种靶基因的激活。c-Fos影响破骨细胞的增殖和分化,可能与其前体细胞向成熟转化有关[9]。有研究[10]发现,当敲除小鼠c-fos基因后,最先表现出骨硬化,而这种硬化是由破骨细胞前体细胞的缺陷所致,说明c-fos基因在破骨细胞的发育中起着重要的作用。在破骨细胞分化的过程中,c-Jun也起着一定的作用。有报道[11]显示,活化的c-Jun从细胞质转移到细胞核,诱导AP-1活化并激活特定的基因(如编码基质金属蛋白酶和碱性磷酸酶的基因),刺激了破骨细胞前体细胞的成熟,诱导破骨细胞的分化、存活、融合和活化。
c-Jun/c-Fos与NFATc1家族的相互联系被认为是RANKL诱导破骨细胞分化的关键环节。本研究的结果显示,CaMKⅡδ沉默抑制了c-fos、c-jun的表达及破骨细胞的分化。与王想福等[12]通过靶向抑制破骨细胞p38促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路中c-fos的表达抑制了破骨细胞吸收功能的结果相似。Izawa等[13]研究结果表明,c-Jun在破骨细胞的分化中起着重要的作用。因此,在调节破骨细胞的分化和功能中,c-Fos、c-Jun有重要的作用。
CREB是一种核转录因子,在破骨细胞信号通路起着重要作用。本研究发现,CaMKⅡδ沉默抑制了CREB。作为CaMK下游重要的信号分子,CREB的激活可以促进原癌基因c-fos的表达,并且CREB家族中的某些成员可以与c-Jun形成二聚体。CREB被活化后,可进入细胞核并与NFATc1基因的启动子相结合,参与NFATc1表达,调控破骨细胞分化[14-15]。
在本研究中,为了研究沉默CaMKⅡδ基因对RAW264.7细胞中c-fos、c-jun、CREB表达的影响以及CaMKⅡδ基因在破骨发生中的作用,采用RNA干扰技术成功构建了针对CaMKⅡδ的siRNA重组慢病毒载体,特异性沉默CaMKⅡδ。结果证明,转染siRNA载体病毒后,CaMKⅡδ在mRNA和蛋白质水平的表达显著降低。总之,本研究的结果表明,通过沉默CaMKⅡδ,可以抑制破骨细胞分化,下调了c-fos、c-jun和CREB基因的表达,说明c-Fos、c-Jun、CREB参与了破骨细胞的分化。这将为研究破骨细胞所引起的疾病提供参考。 虽然相关机制尚需要进一步研究,CaMKⅡδ可能是一个有吸引力的治疗骨吸收相关疾病的目标分子。
