牡丹愈伤组织增殖及褐化研究
2019-08-14程雨飞朱向涛洪尔蔓张俊丽
程雨飞,朱向涛,季 雯,洪尔蔓,林 芯,范 贞,张俊丽
(1.浙江农林大学暨阳学院,浙江 诸暨 311899;2.临沂市园林局,山东 临沂 276037;3.潍坊职业学院农林科技学院,山东 潍坊 262737)
【研究意义】牡丹(Paeonia suffruticosa L.)为芍药科芍药属亚灌木,是名贵的观赏和药用植物。其花大色艳,观赏价值高,是我国传统十大名花之一。然而,传统的牡丹育种方法周期长、选择效率低,无法满足日益增长的牡丹市场需求。组织培养作为高效的繁殖方法,可以提高繁殖效率,具有较好的应用前景[1]。【前人研究进展】目前牡丹组织培养研究主要集中在体细胞胚发生和器官发生两大方面。关于牡丹体细胞胚诱导的研究已经取得一定进展,通过改变添加物[2]、植物生长调节剂[3]、外植体成熟度[4]来提高体细胞胚的诱导率。器官发生途径在牡丹组织培养中研究较多也较早,以牡丹茎段[5]、叶柄、茎尖[6]为外植体通过试验建立牡丹离体快繁体系,虽已有一定基础,但愈伤组织增殖和分化困难、增殖过程中褐化严重[7]以及生根难[8]等问题仍然存在,也是制约牡丹离体快繁体系建立的主要问题。通过组织培养建立高效牡丹繁殖体系是目前研究的重点和热点,而两种组织培养途径都需要大量愈伤组织作为材料,因此获得大量愈伤组织是牡丹组织培养体系建立的基础。而愈伤组织的继代增殖是愈伤组织大量繁殖与分化成功与否的关键[9]。现阶段,牡丹愈伤组织增殖过程存在的主要问题是增殖系数低[10]、褐化率高。有研究表明,在不同质量浓度的PIC处理下,凤丹牡丹的增殖系数存在显著差异[11]。而光源CCFLs(冷阴极荧光灯)[12]、KT(呋喃甲氨基嘌呤)[13]可一定程度上促进牡丹愈伤组织生长。关于牡丹增殖过程中易褐化的现象,有研究发现低温培养[11]、添加适宜浓度硝酸银[14]、PVP(聚乙烯吡咯烷酮)[15]、活性炭、去除培养基中Cu2+[16]、添加不同糖源或不同质量浓度蔗糖培养基[17]进行增殖培养等措施,都可有效降低褐化率。但关于预培养时间和赤霉素(GA3)对牡丹愈伤组织增殖及增殖过程中褐化情况的影响,尚未见报道。【本研究切入点】以牡丹胚轴、子叶愈伤组织为材料,研究了不同植物生长调节剂组合及浓度、不同外植体预培养时间以及GA3对牡丹愈伤组织增殖的影响。【拟解决的关键问题】确定牡丹胚轴、子叶愈伤组织适合的增殖培养基以及预培养时间,有效抑制增殖过程中的褐化现象,以期通过愈伤组织大量增殖、分化奠定基础,进一步建立牡丹离体再生体系。
1 材料与方法
1.1 试验材料
以不同生长阶段的胚轴愈伤组织和子叶愈伤组织为材料,供试牡丹品种为‘凤丹白’,种子采自浙江农林大学暨阳学院的牡丹圃。
1.2 试验方法
1.2.1 材料处理 试验在浙江农林大学暨阳学院组培室进行,晴天上午,取生长状况良好的成熟牡丹种子,装入样品袋,带回组培室进行表面灭菌:用软刷刷去表面污垢,2% NaClO浸泡20 min。然后置于超净工作台内,用无菌水冲洗3~5遍,70%酒精消毒10 s后,无菌水冲洗3~5遍,将表面水分用无菌滤纸吸干,在超净工作台将种胚取出接于培养基 NAA 3.0 mg/L+6-BA 1.0 mg/L+TDZ 1.0 mg/L中进行暗培养。种胚暗培养30 d后,切取胚轴与子叶部分,分别接种于上述相同培养基中进行暗培养,得到牡丹胚轴愈伤组织和子叶愈伤组织。
1.2.2 不同培养基对愈伤组织增殖的影响 以MS为基本培养基,采用L9(34)设计4因素3水平的正交试验(表1),共9个处理。将牡丹胚轴、子叶愈伤组织转接至试验培养基(蔗糖30.0 g/L、琼脂7.0 g/L,pH 5.8)中培养,培养条件为温度24(±1)℃、光照时间10 h/L、光照强度30~50 μmol/m2·s,每个处理3次重复。每隔15 d记录愈伤组织的增重量、褐化情况,30 d为一个继代周期。愈伤组织质量用电子天平测量,培养30 d后统计愈伤组织在增殖过程中的褐化情况,统计愈伤组织的增殖倍数,方法如下:
愈伤组织增殖倍数=愈伤组织继代30 d增长质量/继代初质量
愈伤组织褐化情况:将愈伤组织褐化情况分为4个等级:0级,无褐化;1级,轻微褐化,褐化部分占愈伤组织总体积1/10以下;2级,中度褐化,褐化部分占愈伤组织总体积的1/10~1/3;3级,重度褐化,褐化部分占愈伤组织总体积1/3以上(图1)。
数据用Excel统计,运用SPSS 22.0进行单因素方差分析(One-way ANOVE)和邓肯多重比较(Duncan)。
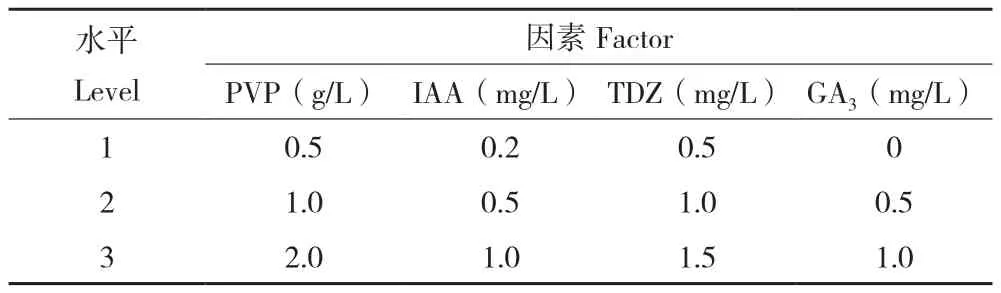
表1 L9(34)愈伤增殖试验因素水平Table1 Factors in L9 (34) callus proliferation test

图1 牡丹愈伤组织增殖过程中的褐化等级Fig.1 Browning level during peony callus proliferation
1.2.3 不同预培养时间对愈伤组织增殖的影响把诱导出的牡丹胚轴、子叶愈伤组织接入相同培养基NAA 3.0 mg/L+6-BA 1.0 mg/L+TDZ 1.0 mg/L中,在黑暗条件下预培养,预培养时间分别为30、60、90 d,在空白培养基上进行3 d过渡培养后,转接至筛选出的最佳增殖培养基(蔗糖30.0 g/L、琼脂7.0 g/L,pH 5.8)。培养条件为温度24(±1)℃、光照时间 10 h/L、光照强度 30~50 μmol/m2·s,每个处理3次重复。每隔15 d记录愈伤组织的增重量、褐化情况,统计方法如1.2.2。
2 结果与分析
2.1 牡丹愈伤组织继代增殖最佳培养基筛选
2.2.1 牡丹胚轴愈伤组织继代增殖最佳培养基表2显示,牡丹胚轴愈伤组织在不同培养基组合上的增殖效果差异显著。其中增殖倍数最高的是4号培养基、为5.75,最低的是1号培养基、为2.69。胚轴愈伤组织在3、4、9号培养基中褐化程度最轻。综合来看,4号培养基(PVP 1.0 g/L+IAA 0.2 mg/L+TDZ 1.0 mg/L+GA31.0 mg/L)是牡丹胚轴愈伤组织增殖继代的最佳组合。
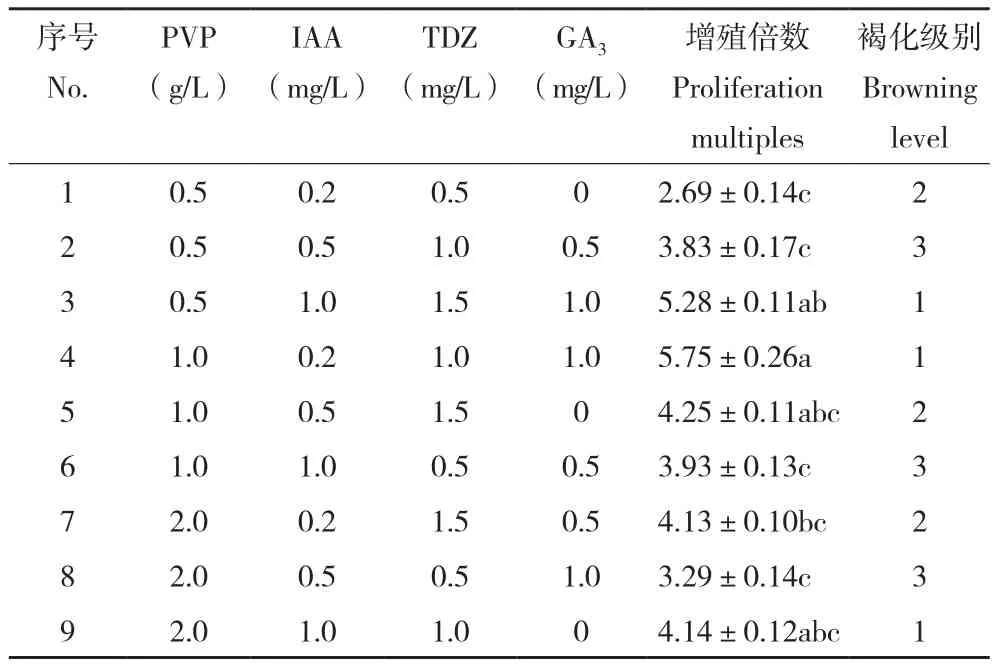
表2 不同培养基对牡丹胚轴愈伤组织继代增殖的影响Table2 Effects of different media on subculture mulitiplication of peony hypocotyl callus
2.2.2 牡丹子叶愈伤组织继代增殖最佳培养基由表3可知,牡丹子叶愈伤组织在不同培养基组合上的增殖效果差异显著。其中增殖倍数最高的是8号培养基、为5.50,最低的是1号培养基、为3.13。子叶愈伤组织在3、4、8号培养基中褐化程度最轻。综合来看,8号培养基(PVP 2.0 g/L+IAA 0.5 mg/L+TDZ 0.5 mg/L+GA31.0 mg/L)是牡丹子叶愈伤组织增殖继代的最佳组合。
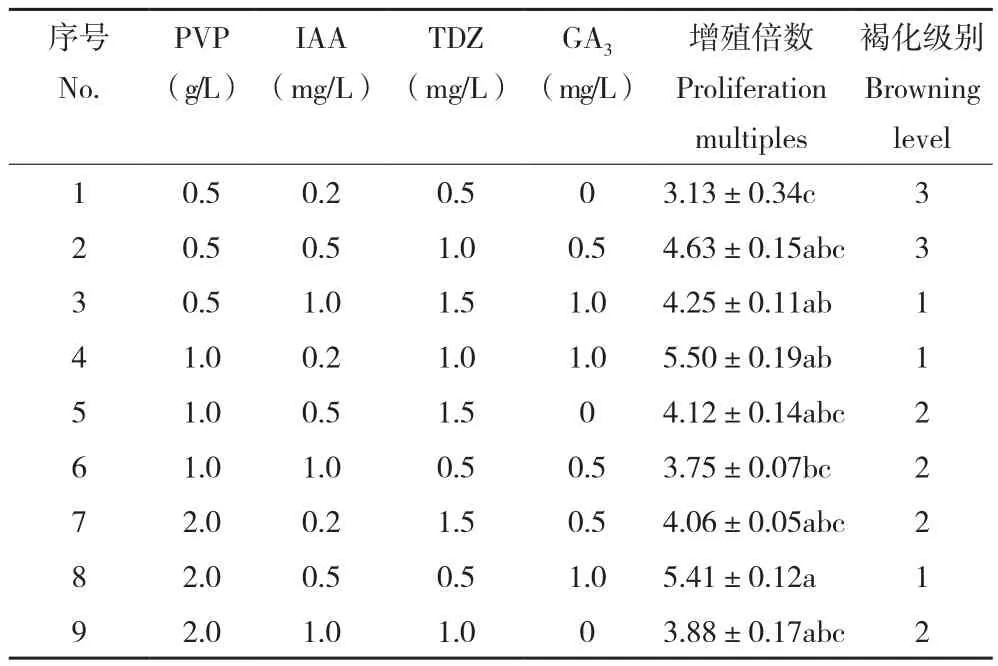
表3 不同培养基对牡丹子叶愈伤组织继代增殖的影响Table3 Effects of different media on subculture mulitiplication of peony cotyledon callus
2.2 赤霉素对牡丹愈伤组织继代增殖的影响
本研究结果发现,牡丹胚轴愈伤组织3、4、9号处理组(表2)以及子叶愈伤组织3、4、8号处理组(表3)增殖培养30 d后未出现明显褐化现象。以上6个处理中,GA3浓度均为1.0 mg/L。牡丹胚轴愈伤组织培养基中GA3浓度为1.0 mg/L的处理组,增殖倍数为5.28、5.75、4.14,增殖倍数较高,分别为第1、2、3位;牡丹子叶愈伤组织培养基中,GA3浓度为1.0 mg/L的处理组,增殖倍数为4.25、5.50、5.41,增殖倍数也处于较高水平,分别为第1、2、4位。可见,1.0 mg/L GA3有利于抑制愈伤组织增殖过程中的褐化现象,并促进愈伤组织增殖。
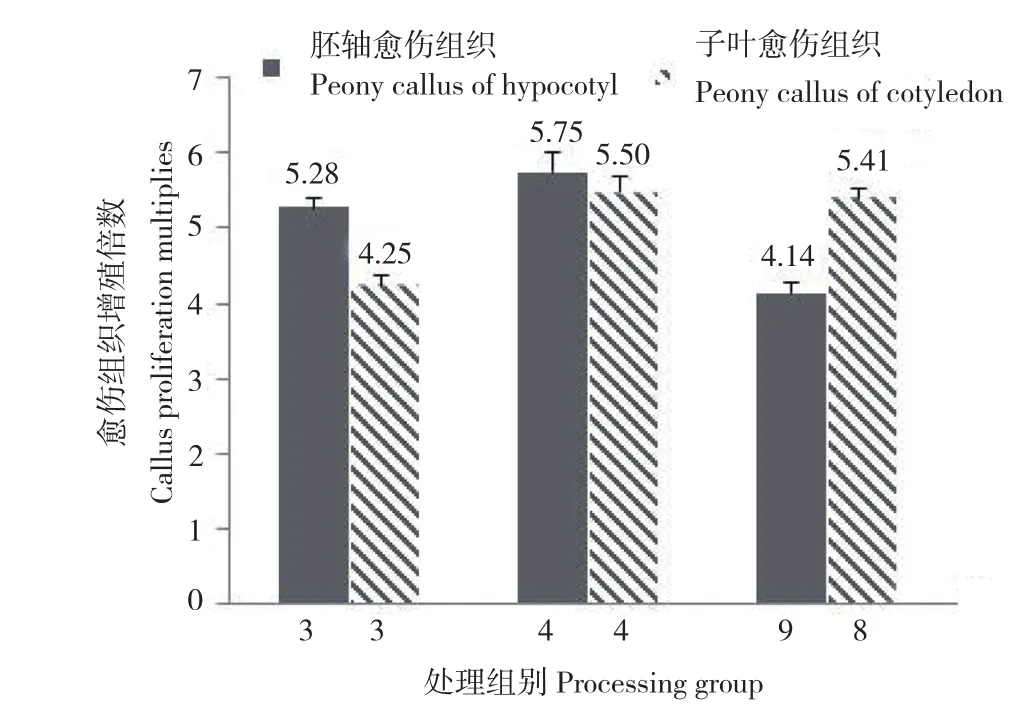
图2 牡丹愈伤组织继代增殖培养30 d后未出现明显褐化组别Fig.2 Groups without obvious browning after 30d of subculture mulitiplication of peony callus
2.3 不同外植体预培养时间对牡丹愈伤组织继代增殖的影响
从图3和表4可以看出,预培养不同时间的外植体其增殖情况不同。预培养30 d的愈伤组织相较于预培养60、90 d的愈伤组织,增殖倍数最高,褐化程度最轻,随着预培养时间的增长,愈伤组织的增殖倍数呈降低后升高的变化趋势,差异明显,褐化程度则更严重。综合来看,不同外植体预培养时间影响愈伤组织增殖和褐化情况,在增殖继代中利用预培养30 d的愈伤组织,有利于提高增殖倍数、减轻褐化现象。

图3 预培养30 d愈伤组织继代增殖Fig.3 Multiplication of callus precultured for 30 d
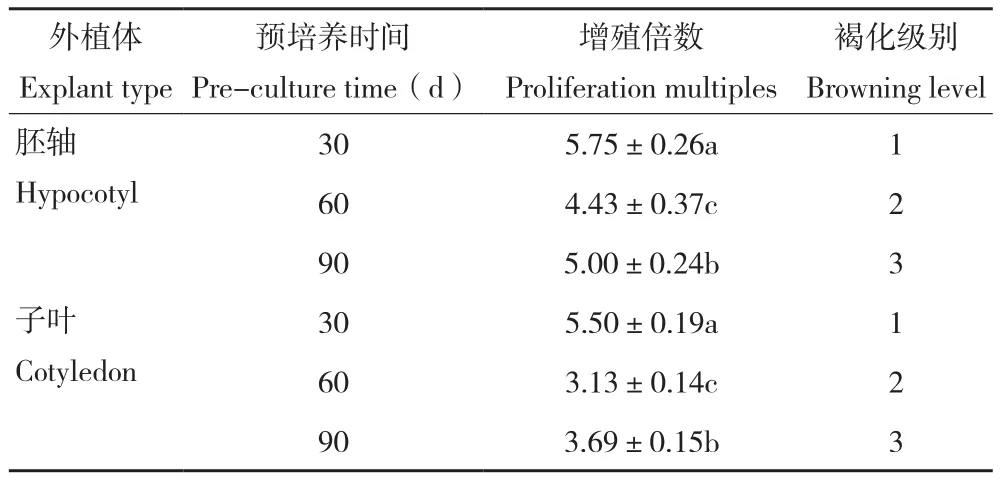
表4 不同外植体预培养时间对牡丹愈伤组织继代增殖的影响Table4 Effects of different explant preculture time on multiplication of peony callus
2.4 不同愈伤组织状态对牡丹愈伤组织继代增殖的影响
研究过程中发现,愈伤组织在继代增殖过程中,状态大致可以分为3种情况:(1)表面附着一层絮状物,与愈伤组织一起增大,愈伤整体呈淡黄绿色,略为松软(图4A);(2)顶部呈颗粒状的愈伤组织不再增长,基部密实的愈伤组织不断增大,愈伤组织软硬适中(图4B);(3)新旧愈伤组织呈相同活性,愈伤组织整体增殖变大,颜色逐渐翠绿,硬度逐渐增大(图4C)。呈现第1种状态的愈伤组织,在整个增殖培养过程中的状态比较稳定,不易褐化且中后期体积增殖变化明显;呈现第2种状态的愈伤组织,在增殖过程中存在一定的褐化现象,不严重,体积增长情况则稳定且缓慢;呈现第3种状态的愈伤组织,在增殖培养前期表现十分突出,体积增大较快,但到中后期往往不再增长,且极易出现褐化现象。

图4 牡丹愈伤组织继代增殖状态Fig.4 Status of subculture multiplication of peony callus
3 讨论
褐化问题是木本植物组培试验中常见的问题[18],而增殖系数不高则是现阶段牡丹愈伤组织增殖过程存在的主要难题。本试验通过研究不同添加物组合及浓度、不同预培养时间,对影响褐化情况和增殖倍数的因素进行了系统分析。结果发现,当增殖过程中添加1.0 mg/L GA3时,牡丹愈伤组织增殖倍数提高且不易褐化,添加其他浓度或未添加GA3的处理组则发生了不同程度的褐变。GA3是一种植物生长调节剂,在牡丹领域常用于解除种子休眠[19]、促进种子生根和发芽[20]、延缓叶片衰老[21],但在愈伤组织增殖方面应用较少。有研究表明,GA3可影响黄冠梨[22]和红叶石楠[23]的增殖率,并对渝茶1号的增殖和生长都有很好的促进作用[24],这与本试验的结果相一致。在组培试验中,添加抗褐化剂可减轻外植体褐化情况,且不同抗褐化剂对不同种类植物的抗褐化效果及作用机理存在差异。例如,Vc作为一种抗氧化剂对总酚的形成和积累有一定的抑制作用、AC能吸附植物在组织培养中分泌的酚类物质。本试验发现1.0 mg/L GA3可有效抑制牡丹愈伤组织增殖过程中的褐化现象,有研究表明GA3也能有效抑制冬凌草褐化[25],可能是适量的GA3可阻止组织中多酚氧化酶被激活或酚类化合物被氧化,但具体作用机理还需进一步研究。与以往GA3在植物方面多应用于打破种子休眠、调控花期不同,可以考虑将其作为一种新型抗褐化剂应用于组培试验。
本研究结果表明,增殖过程中采用预培养30 d的愈伤组织相较于采用预培养60 d和90 d的愈伤组织,可以获得更高的增殖倍数,且褐化程度差异明显。在继代增殖中,预培养30 d的愈伤组织增长最快、体积变化最为明显、且褐化程度最轻,预培养60 d的愈伤组织次之,预培养90 d的愈伤组织增殖情况最差且极易出现褐化情况,这可能是由于体内积累太多代谢产物,从而促进酚类化合物的合成[26]。有研究表明,经过预培养的油菜子叶和下胚轴愈伤组织分化效果较好[27],这为牡丹分化研究提供了思路。与前人研究不同的是,本试验中采用的预培养培养基,与愈伤组织诱导培养基相同,不同预培养时间改变的可能是愈伤组织成熟度,在今后的增殖试验中,可通过调整预培养阶段培养基中的生长调节剂及外源添加物种类来进行优化,以期得到更好的增殖效果。
研究中还发现,愈伤组织的状态很大程度上影响愈伤组织的增殖情况,呈现淡黄绿色且质地松软的愈伤组织在增殖过程中生长迅速,不易出现褐化现象,可以稳定增殖。而呈现翠绿色且质地坚硬的愈伤组织,在增殖前期体积变化较为明显,但中后期生长十分缓慢,且状态极不稳定、易褐化。在本试验中,前者多为预培养30 d的愈伤组织,而颜色较深硬度较大的后者则多为预培养90 d的愈伤组织。有关研究表明,黄绿色较疏松的华北八宝愈伤组织[28]、淡黄颗粒疏松的苎麻愈伤组织[29]、淡黄色至黄褐色的莲藕愈伤组织[30]、淡黄色的水稻愈伤组织[31]状态良好、生长旺盛,这与本研究结果一致。当愈伤组织处于上述状态时即可进行增殖,并可考虑将这两种愈伤组织进行电镜观察,柔软与坚硬的区别可能是生理结构层面出现了变化,有待进一步深入研究。
4 结论
1.0 mg/L GA3有利于促进牡丹愈伤组织的增殖并抑制愈伤组织增殖过程中的褐化现象,30 d是继代增殖最适宜的外植体预培养时间,呈淡黄绿色且质地松软的愈伤组织在增殖过程中生长量大且不易褐化。但褐化仍是牡丹组织培养中较为重要的难题,因此对牡丹外植体培养过程中的生长调节剂种类选择与浓度配比、抗褐化剂的选取等,仍然需要进一步深入研究。
