逍遥抗癌解郁方对乳腺癌并发抑郁症小鼠海马CRHR1、GR、BDNFmRNA表达的影响
2019-08-13金狮韩远山王宇红孟盼赵洪庆杨琴凌佳杨蕙向韵
金狮 韩远山 王宇红 孟盼 赵洪庆 杨琴 凌佳 杨蕙 向韵
〔摘要〕 目的 研究復方中药逍遥抗癌解郁方对乳腺癌并发抑郁症(breast cancer related depression, BCRD)小鼠海马促肾上腺皮质激素释放激素受体1(corticotropin releasing hormone receptor 1, CRHR1)、糖皮质激素受体(glucocorticoid receptor, GR)、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF) mRNA的调控作用,阐明其对海马组织的可能保护机制。方法 通过腋下注射4T1炎性乳腺癌细胞联合背部皮下注射皮质酮建立BCRD小鼠模型并随机分为模型组、紫杉醇组、紫杉醇+氟西汀组、逍遥抗癌解郁方组、紫杉醇+逍遥抗癌解郁方组,同时设正常组。采用悬尾实验和强迫游泳实验检测小鼠抑郁样行为,HE染色观察小鼠海马的病理结构变化,实时荧光定量PCR检测CRHR1、GR、BDNF mRNA的表达。结果 与正常组相比,模型组小鼠悬尾实验、强迫游泳实验中不动时间显著增加(P<0.01),海马结构损伤明显,GR、BDNF mRNA表达显著下降(P<0.01),CRHR1 mRNA表达显著上升(P<0.01);给予逍遥抗癌解郁方干预后,模型小鼠悬尾实验、强迫游泳实验中不动时间下降(P<0.05),海马结构损伤得以恢复,GR、BDNF mRNA表达显著上升(P<0.01)、CRHR1 mRNA表达显著下降(P<0.01)。结论 逍遥抗癌解郁方可以改善BCRD小鼠的抑郁症状,保护海马组织,其作用机制与上调GR、BDNF和下调CRHR1的mRNA表达有关。
〔关键词〕 海马组织;促肾上腺皮质激素释放激素受体1;糖皮质激素受体;脑源性神经营养因子;乳腺癌并发抑郁症;逍遥抗癌解郁方
〔中图分类号〕R285.5;R737.9;R749 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.05.005
〔Abstract〕 Objective To study the effects of Xiaoyao Kangai Jieyu Decoction on corticotropin releasing hormone receptor 1 (CRHR1), glucocorticoid receptor (GR), brain-derived neurotrophic factor (BDNF) and regulation of mRNA in Hippocampus of breast cancer related depression (BCRD) mice, to elucidate its possible protective mechanism on hippocampus. Methods The BCRD mice model was established by subaxillary injection of 4T1 inflammatory breast cancer cells combined with subcutaneous injection of corticosterone on the back, and the mice were randomly divided into a model group, a paclitaxel group, a paclitaxel + fluoxetine group, a Xiaoyao Kangai Jieyu Decoction group, a paclitaxel + Xiaoyao Kangai Jieyu Decoction and a normal group. The depression-like behavior of mice was detected by tail suspension test and forced swimming test. The pathological changes of hippocampus were observed by HE staining. The mRNA expressions of CRHR1, GR and BDNF were detected by real-time fluorescent quantitative PCR. Results Compared with the normal group, the immobility time in the tail suspension test and forced swimming test in the model group was significantly increased (P<0.01), and the hippocampal structural damage was obvious. The mRNA expressions of GR, BDNF were significantly decreased (P<0.01). The mRNA expression of CRHR1 increased significantly (P<0.01). After the intervention of Xiaoyao Kangai Jieyu Decoction, the immobility time in tail suspension test and forced swimming test in the model mice were decreased significantly (P<0.05), the mRNA expression of GR, BDNF was increased significantly (P<0.01), and the mRNA expression of CRHR1 was decreased significantly (P<0.01). Conclusion Xiaoyao Kangai Jieyu Decoction can improve the depressive symptoms of BCRD mice and protect hippocampus, and the mechanism of action is related to up-regulation of GR, BDNF and down-regulation of mRNA expression of CRHRI.
〔Keywords〕 hippocampus; corticotropin releasing hormone receptor 1; glucocorticoid receptor; brain-derived neurotrophic factor; breast cancer complicated with depression; Xiaoyao Kangai Jieyu Decoction
乳腺癌是女性恶性肿瘤之首。随着治疗手段的不断革新,乳腺癌的治愈率虽有所提高,但化疗通常会导致乳腺癌患者出现抑郁和认知功能下降等不良反应[1]。临床研究表明,10%~25%的乳腺癌患者出现抑郁症[2],持续性抑郁症状会加速肿瘤恶化,导致患者生存率降低。因此,研究乳腺癌并发抑郁症(breast cancer related depression, BCRD)的发病机制,并在此基础上开展防治具有十分重要的意义。
目前关于BCRD的生物学机制研究多集中在神经免疫因子、神经内分泌、神经生理及生化等方面[3],而以上生物学机制均与下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)軸功能紊乱有关[4]。HPA轴功能障碍,导致包括神经元损伤、神经再生障碍和神经营养低下在内的海马病理结构改变,是抑郁症发生的重要神经生物学机制[5]。逍遥抗癌解郁方由逍遥散加减,具有疏肝解郁、健脾补肾、化瘀解毒的功效。课题组前期研究表明[6],逍遥抗癌解郁方联合紫杉醇可以逆转BCRD小鼠单胺类神经递质的降低,有效改善抑郁样指征,降低肿瘤标志物CA153、CA125和CEA含量,延缓BCRD的发展。基于此,本实验拟观察逍遥抗癌解郁方对BCRD小鼠海马促肾上腺皮质激素释放激素受体1(corticotropin releasing hormone receptor 1, CRHR1)、糖皮质激素受体(glucocorticoid receptor, GR)、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)mRNA的影响,探讨其对海马的保护作用,进一步研究BCRD发病机制及中药干预作用。
1 材料与方法
1.1 实验动物
SPF级BALB/c雌性小鼠,4~6周龄,18~22 g,购自湖南斯莱克景达实验动物有限公司,实验动物许可证号:SCXK(湘)2013-0004,合格证号:43004700025656。动物自购买之日起,在光暗周期为12 h/12 h环境中适应性喂养5 d,自由获取食物与水。
1.2 材料及药物
4T1炎性乳腺癌原代细胞株,购于中国科学院上海生科院细胞资源中心。逍遥抗癌解郁方(夏枯草15 g,菟丝子9 g,姜黄9 g,人参6 g,柴胡9 g,枸杞9 g,重楼9 g,贯叶连翘3 g等),饮片均购于湖南中医药大学第一附属医院,并由该院制剂科按比例水煎浓缩;注射用紫杉醇脂质体,深圳万乐药业有限公司,规格:30 mg/支,批号:20150618;盐酸氟西汀胶囊,法国Patheon,规格:20 mg/粒,批号:J20130010。
1.3 主要试剂与仪器
逆转录试剂盒(美国Thermo Fisher Scientific公司),荧光定量PCR试剂盒(日本TaKaRa公司),Trizol(美国ambion公司),RPMI培养基、双抗、胰酶(美国HyClone公司),胎牛血清(中国杭州四季青公司),DMSO、二甲苯、伊红、苏木素、多聚甲醛、无水乙醇(中国上海蓝润公司)。核酸蛋白浓度测定仪(英国BioDrop公司),梯度PCR扩增仪(美国BIO-RAD公司),实时荧光定量PCR仪(美国I llumina公司),生物组织切片机(美国Thermo Scientific公司),光学显微镜(德国Zeiss公司),Z32HK型高速冷冻离心(德国Hermle公司)。强迫游泳实验用水缸(中国北京智鼠多宝生物科技有限责任公司)。
1.4 动物模型的制备
参照课题组前期研究[6],以BALB/c小鼠为造模对象,在其腋下接种0.1 mL的1×107个/mL 4T1炎性乳腺癌细胞,用以制备乳腺癌小鼠模型,接种7 d后,观察其是否成瘤。在乳腺癌小鼠成功造模后,采用背部皮下注射皮质酮混悬液(30 mg/kg),连续注射21 d,从而制备BCRD小鼠模型。
1.5 分组与药物干预
将筛选出的乳腺癌小鼠按随机数表分为模型组、紫杉醇组、紫杉醇+氟西汀组、逍遥抗癌解郁方组和紫杉醇+逍遥抗癌解郁方组,另取正常BALB/c小鼠作为正常组,每组10只。各组小鼠于皮质酮注射同时干预,紫杉醇组腹腔注射紫杉醇脂质体(20 mg/kg),每周1次;紫杉醇+氟西汀组给予紫杉醇脂质体的同时每天灌胃盐酸氟西汀(2.6 mg/kg);逍遥抗癌解郁方组每天灌胃给予临床等效剂量的逍遥抗癌解郁方(19.5 g/kg);紫杉醇+逍遥抗癌解郁方组给予紫杉醇脂质体的同时给予逍遥抗癌解郁方;正常组和模型组分别给予等容量蒸馏水,共21 d。末次皮质酮注射完成后,对各组小鼠进行悬尾实验和强迫游泳实验,然后取全脑、海马组织,保存待测。
1.6 行为学测试
1.6.1 悬尾实验 小鼠禁食不禁水24 h后,将小鼠尾部固定在距离地面60 cm处,使其呈倒挂状态,要求动物之间视线彼此隔离,适应30 s后,记录动物3 min内四肢不动时间。
1.6.2 强迫游泳实验 小鼠禁食不禁水24 h后,将动物头朝下放入高50 cm、直径20 cm的圆柱形水缸中,实验用水缸要求视线隔离,水室温,水深要求小鼠自然漂浮状态尾部无法接触缸底,适应30 s后,记录4 min内动物不动时间。
1.7 海马病理结构检测
将固定好的脑组织,进行常规石蜡包埋后切片;脱蜡后采用苏木精-伊红染色(HE染色)后,脱水至透明,擦去切片周围多余的液体,迅速滴加适量中性树脂至切片上,盖上盖玻片封固,常溫下风干。玻片晾干后,放置于载物台上,光镜下观察并拍摄图片,记录下海马的形态学变化(细胞核呈现蓝色,细胞浆呈现粉红色)。
1.8 实时荧光定量PCR检测海马CRHR1、GR、BDNF mRNA的表达
取冻存备用的海马组织,按说明书提取各组mRNA、反转录合成cDNA,进行PCR扩增。引物由华大基因合成,引物序列和扩增产物长度见表1。以β-actin为管家基因,用2-?荭?荭Ct法对海马神经元中CRHR1、GR、BDNF mRNA表达量进行分析,即相对mRNA表达=2-?荭?荭Ct,其中?荭?荭Ct=?荭Ct其他组-?荭Ct空白组,?荭Ct=Ct靶基因-Ct管家基因。
1.9 统计学分析
使用SPSS 21.0软件对数据进行统计,实验数据使用“x±s”表示。数据符合正态分布采用单因素方差分析,两两比较方差齐时采用LSD检验法,方差不齐时采用Dunnetts T3检验。P<0.05表示差异有统计学意义。
2 结果
2.1 行为学测试
与正常组比较,在悬尾和强迫游泳实验中,模型组小鼠不动时间明显上升,差异具有统计学意义(P<0.01);与模型组比较,紫杉醇+氟西汀组、逍遥抗癌解郁方组和紫杉醇+逍遥抗癌解郁方组BCRD小鼠不动时间明显下降(P<0.01或P<0.05),紫杉醇组强迫游泳实验中小鼠不动时间无统计学差异。结果见表2。
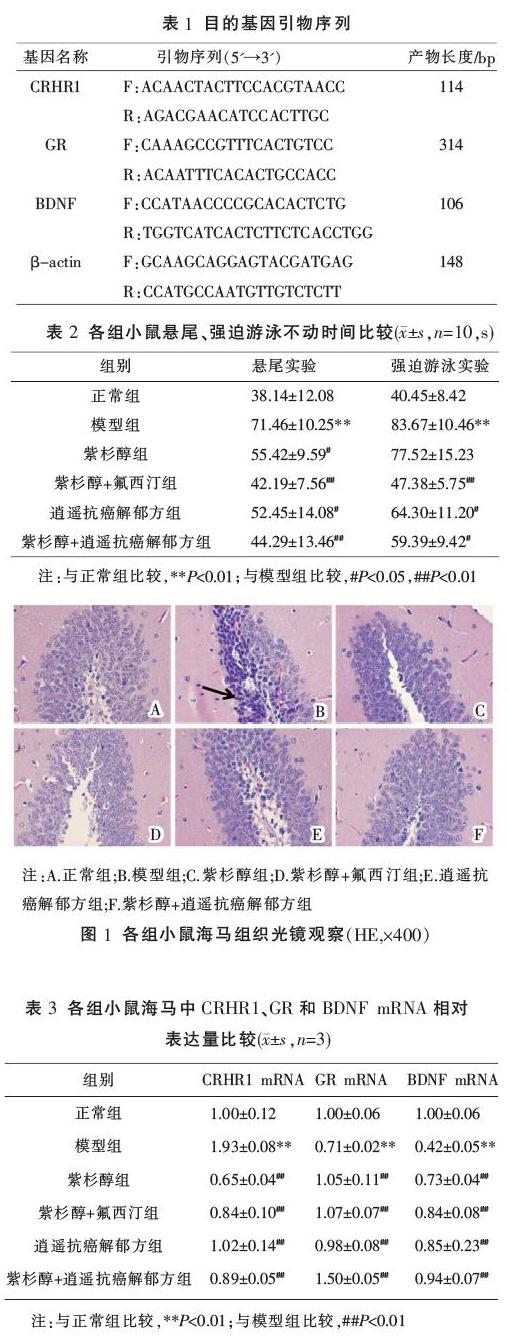
2.2 各组小鼠海马组织病理学检查
光镜下观察BCRD小鼠海马组织DG区神经元细胞,与正常组比较,模型组小鼠海马神经元细胞大部分胞浆浓缩,呈现萎缩现象,细胞核消失或者体积变小,细胞核深染。与模型组比较,紫杉醇+氟西汀组和紫杉醇+逍遥抗癌解郁方组海马神经元细胞结构恢复,神经元细胞增多,细胞界限清楚,细胞结构层次分明,细胞核形态正常,可见少量变性细胞,逍遥抗癌解郁方组和紫杉醇组细胞萎缩、核深染现象有一定程度的减轻。结果见图1。
2.3 各组小鼠海马CRHR1、GR、BDNF mRNA表达的变化
与正常组比较,BCRD模型组小鼠海马中CRHR1 mRNA的表达明显升高,GR和BDNF mRNA的表达明显降低,差异均具有统计学意义(P<0.01);与模型组比较,紫杉醇组,紫杉醇+氟西汀组、逍遥抗癌解郁方组、紫杉醇+逍遥抗癌解郁方组海马中CRHR1 mRNA的表达明显降低,GR和BDNF mRNA的表达明显升高,差异均具有统计学意义(P<0.01)。结果见表3,图2-图4。
3 讨论
乳腺癌患者在诊治过程中承受着巨大的心理压力,对未来的不确定性和身体形象的担忧诱发精神疾病的产生,抑郁症作为乳腺癌患者最常见的并发症,严重影响了乳腺癌的诊断、治疗和预后过程。有效控制BCRD患者的抑郁症状,有助于提高患者用药依从性,帮助患者积极参与治疗,改善治疗效果[7]。本课题组首次采用腋下注射4T1炎性乳腺癌细胞联合背部皮下注射皮质酮建立BCRD小鼠模型,该模型不仅具有人类乳腺癌相似的生物学特性,乳腺癌标志物明显升高,而且表现出典型的抑郁症状,快感缺乏,自主活动降低,单胺类神经递质含量降低,为BCRD发病机制的研究及药物研究奠定基础[8]。
悬尾实验和强迫游泳实验广泛应用于精神神经药理学的基础研究,是经典的抗抑郁药物模型评价方法。两种方法具有相同的设计原理,利用动物无法逃脱恶劣环境产生绝望行为。悬尾实验是通过无法克服不正常体位而诱导产生抑郁绝望行为,属于“干型”行为绝望;而强迫游泳实验是通过无法挣脱水环境诱导产生抑郁绝望行为,属于“湿型”行为绝望[9]。本实验中,与正常组相比,模型组小鼠悬尾实验、强迫游泳实验中不动时间增加(P<0.01),提示BCRD模型小鼠存在抑郁样行为。给予逍遥抗癌解郁方干预后,BCRD小鼠悬尾实验、强迫游泳实验中不动时间降低(P<0.05),表明逍遥抗癌解郁方可以有效改善BCRD小鼠的抑郁症状。
海马是调节机体情绪及学习记忆功能的重要部位,海马功能障碍被认为是至关重要的抑郁症发病机制[10]。乳腺癌模型小鼠的海马体积明显缩小,空间记忆和认知功能障碍,促炎因子水平升高[11]。临床实验发现,乳腺癌患者认知困难程度增加,情节记忆能力下降,海马体积较正常人明显缩小,且其结构形态的改变较非乳腺癌患者有显著差异[12]。因此海马损伤可能在BCRD的发生发展中发挥重要作用。海马组织病理学检查结果表明,模型组小鼠海马神经元大部分胞浆浓缩,呈现萎缩现象,细胞核消失或者体积变小,提示BCRD小鼠海马存在结构损伤。给予逍遥抗癌解郁方干预后,海马结构损伤有所恢复。
CRH及其受体CRHR1可调节慢性应激下大鼠学习记忆能力及海马CA3区神经元树突形态。研究海马CRHR1基因缺乏的小鼠可发现,CRHR1对压力应激下的HPA轴及其行为学影响显著,表现为血浆COR水平、HPA轴功能紊乱及抑郁样行为降低[13]。GR在HPA轴的负反馈调节中发挥重要作用,海马GR表达下降,使其对HPA轴的负反馈抑制作用减弱,导致HPA轴功能失调,持续亢进,糖皮质激素分泌增加。糖皮质激素易通过血脑屏障进入脑,使海马中皮质醇含量升高,可产生神经毒性,导致海马结构损伤和功能障碍[14-15]。BDNF是一种在海马中广泛表达和释放的生长因子,可以影响海马神经元存活,突触发生和脊柱形成,以及成人海马神经发生,在突触可塑性中发挥重要作用[16]。BDNF表达下调,会影响神经元再生障碍,导致海马神经元损伤[17]。乳腺癌作为一个慢性应激事件,促进HPA轴激活,GR抑制HPA轴的主导位点是下丘脑室旁核和垂体肾上腺皮质激素细胞,GR表达下调,对HPA轴负反馈调节减弱,导致CRHR1表达上调,HPA轴持续亢进[18],分泌大量糖皮质激素,作用于海马神经元,BDNF表达下调,海马突触可塑性障碍,最终导致海马损伤,从而逐渐诱发抑郁症的发生。本实验中,与正常组比较,模型组小鼠海马组织GR、BDNF mRNA表达显著下降、CRHR1 mRNA表达显著上升(P<0.01);给予逍遥抗癌解郁方干预后,GR、BDNF mRNA表达显著上升、CRHR1 mRNA表达显著下降(P<0.01)。结果表明,逍遥抗癌解郁方可以通过上调GR的表达,增强对HPA轴的负反馈调节作用,下调CRHR1的表达,缓解HPA轴亢进,从而促进海马中神经营养因子BDNF的表达,增强海马突触可塑性,保护海马组织,改善抑郁症状。
逍遥抗癌解郁方以《太平惠民和剂局方》中逍遥散为基础化裁而成,全方由当归、柴胡、茯苓、白芍、炙甘草、白术、菟丝子、枸杞、重楼、夏枯草、姜黄、人参、贯叶连翘组成。方用重楼、夏枯草化瘀解毒,菟丝子、枸杞补肾益精,而贯叶连翘、姜黄、人参三味具有宁心安神、理气活血之功。貫叶连翘取散诸结,疏肝解郁之意;姜黄行气止痛、活血化瘀,善破肝脾二经之血瘀气结;人参安神益智、大补元气。以上诸药合用,配伍精当。全方寓攻于补,补中有消,攻补兼顾,标本兼治,使肝气得疏,脾肾得补,瘀毒得消,抑郁得除。本研究表明,逍遥抗癌解郁方可以改善乳腺癌并发抑郁症小鼠的抑郁症状,保护海马组织,其作用机制与上调GR、BDNF和下调CRHR1的mRNA表达有关。
参考文献
[1] SU J A, YEH D C, ChANG C C, et al. Depression and family support in breast cancer patients[J]. Neuropsychiatric Disease and Treatment, 2017, 13(9): 2389-2396.
[2] BEDILLION MF, ANSELL EB, THOMAS GA. Cancer treatment effects on cognition and depression: The moderating role of physical activity[J]. The Breast, 2019,44(4): 73-80.
[3] CVETKOVI■ J, NENADOVI■ M. Depression in breast cancer patients[J]. Psychiatry Research, 2016, 240: 343-347.
[4] SHIN KJ, LEE YJ, YANG YR, et al. Molecular mechanisms underlying psychological stress and cancer[J]. Current Pharmaceutical Design, 2016, 22(16): 2389-402.
[5] FOURNIER N M, DUMAN R S. Role of vascular endothelial growth factor in adult hippocampal neurogenesis: Implications for the pathophysiology and treatment of depression[J]. Behavioural Brain Research, 2012, 227(2): 440-449.
[6] 孟 盼,黄会珍,杨 琴,等.逍遥抗癌解郁方对乳腺癌并发抑郁症模型小鼠抑郁样指征的影响[J].中国中医药信息杂志,2018,25(11):46-51.
[7] MAUSBACH B T, SCHWAB R B, IRWIN S A. Depression as a predictor of adherence to adjuvant endocrine therapy (AET) in women with breast cancer: a systematic review and meta-analysis[J]. Breast Cancer Research and Treatment, 2015, 152(2): 239-46.
[8] 杨 蕙,孟 盼,杨 琴,等.4T1炎性乳腺癌细胞接种联合皮质酮注射诱导乳腺癌并发抑郁症小鼠模型的研究[J].中国比较医学杂志,2018,28(11):21-26.
[9] 孙世光,刘 健,鹿 岩,等.昆明小鼠强迫游泳实验与悬尾实验抑郁模型相关性[J].中国药理学与毒理学杂志,2014,28(1):107-112.
[10] LAW J, IBARGUEN-VARGAS Y, BELZUNG C, et al. Decline of hippocampal stress reactivity and neuronal ensemble coherence in a mouse model of depression[J]. Psychoneuroendocrinology, 2016, 67(5): 113-123.
[11] WINOCUR G, BERMAN H, NGUYEN M. Neurobiological mechanisms of chemotherapy-induced cognitive impairment in a transgenic model of breast cancer[J]. Neuroscience, 2018, 369(1): 51-65.
[12] APPLE A C, RYALS A J, ALPERT K I, et al. Subtle hippocampal deformities in breast cancer survivors with reduced episodic memory and self-reported cognitive concerns[J]. NeuroImage-Clinical, 2017, 14(3): 685-691.
[13] INDA C, BONFIGLIO J J, DOS SAUTOS CLARO P A, et al. cAMP-dependent cell differentiation triggered by activated CRHR1 in hippocampal neuronal cells[J]. Scientific Reports, 2017,7(1): 1944.
[14] DOREY R, PIéRARD C, CHAUVEAU F, et al. Stress-Induced memory retrieval impairments: different time-course involvement of corticosterone and glucocorticoid receptors in dorsal and ventral hippocampus[J]. Neuropsychopharmacology, 2012,37(13): 2870-2880.
[15] FOURNIER J C, DERUBEIS R J, HOLLON S D, et al. Antidepressant drug effects and depression severity: a patient-level meta-analysis[J]. Jama, 2010, 303(1): 47-53.
[16] ANTONIAZZI C T D, METZ, VINíCIA G, ROVERSI K, et al. Tactile stimulation during different developmental periods modifies hippocampal BDNF and GR, affecting memory and behavior in adult rats[J]. Hippocampus, 2017, 27(2): 210-220.
[17] FEINSTEIN D L, MADRIGAL J L M, BRAUN D. Noradrenergic regulation of glial activation: molecular mechanisms and therapeutic implications[J]. Current Neuropharmacology, 2014, 12(4):342-52.
[18] 孟庆元.糖皮质激素对前额皮层促肾上腺皮质激素释放因子的调控[D].合肥:中国科学技术大学,2010.
