低温对枇杷苗叶片与根尖的生理状况及超微结构的影响
2019-08-08杜丽君牛先前林晓红张玉容郑国华
杜丽君,牛先前,林晓红,张玉容,郑国华*
(1.漳州城市职业学院,福建 漳州 363000;2.福建农林大学园艺学院,福州 350002;3.福建省热带作物科学研究所,福建 漳州 363001)
枇杷(Eriobotrya japonica)是著名的名优特水果,具有较高的经济价值。然而,枇杷开花座果期一般在11月至次年1月,此时正值一年中气温最低的季节,花果极易受冻。冻害是限制枇杷生产的重要因子。有关枇杷冻害发生机制的研究有较多报道,涉及叶片[1-6]、幼果[7-12]和枇杷外生菌(冰核细菌)[8-10,13]、抗寒基因[14-15]、转录组[16]等方面。枇杷冻害机制的理论研究为解决枇杷冻害提供了思路,也为缓解枇杷冻害起到了积极作用,但低温仍然是限制枇杷生产的主要因子。前人的研究表明,枇杷叶片和幼果在耐寒生理方面具有密切相关性[17],作为植物生产力和养分利用率的重要驱动者——地下部,直接参与养分活化、转化、吸收和运输等过程,通过紧密而复杂的物质和信息交换,实现各要素间的相互作用[18]。地上部与地下部在资源获取和利用方面又具有相对独立性[18]。已有研究表明,地下部的低温条件会造成地上部的低温伤害并影响其低温伤害程度[19-20]。植物地下部能显著影响地上部的抗逆性,这在黄瓜(Cucumis sativus)[21]、茄子(Solanum melongena)[22]嫁接苗的抗冷性以及葡萄(Vitis vinifera)[23]嫁接苗的抗旱性上均获得了证实。因此,研究枇杷地下部与地上部低温胁迫下的生理变化,认识枇杷地上与地下在耐寒生理方面的相关性,对解决枇杷冻害问题具有重要意义。本文以较不耐寒品种‘解放钟’枇杷苗为材料,人工模拟自然低温条件,在透射电镜下观察低温下根尖和叶片细胞超微结构的变化,并结合低温胁迫下的相关生理变化,探讨枇杷地上部与地下部的抗寒生理相关性,以期为枇杷冻害问题提供解决思路。
1 材料和方法
1.1 材料
试验于2011年10月至2014年1月在福建农林大学园艺场进行。供试枇杷(Eriobotrya japonica)品种为 ‘解放钟’实生苗,选择长势健壮、无病虫害且整齐度高的1年龄枇杷苗,移入培养钵(直径20 cm)进行单株培养,培养基质为果园土∶复合肥=20∶1,统一管理。生长1年半后,选择株高30~35 cm,生长健壮、无病虫危害的枇杷苗285株为低温处理试验材料。
1.2 低温处理
参考谢钟琛等[24]的试验设计,设置3个处理温度:0℃、-3℃和-5℃。枇杷苗在10℃低温锻炼2 d后,采用梯度降温法,将植株放入改装的可控温冰柜(上海精创 ETC-100通用型温控仪控温),以10℃ h-1降温到4℃维持10 h,再以2℃ h-1降温到设置温度。在0℃、-3℃、-5℃分别胁迫0(对照)、12、24、36、48、60和72 h后,将植株在10℃恢复生长2 d后统计枇杷苗受害情况,叶片以褐变面积大于总面积1/2判定为受冻害褐变[13]。所有处理均在室内进行,每处理5株,重复3次。叶片褐变率=植株褐变叶片总数/植株叶片总数×100%。
1.3 电镜观察
取从顶叶算起第4片功能叶,取完为止,用蒸馏水洗净,吸干,然后用锋利刀片沿主脉中部两侧取0.5 mm×1 mm的组织块,每片叶在相同部位切取4片,重复5次。
割开营养钵后用自来水浸泡,待土松软后获得完整根系,用自来水洗净根系,再用蒸馏水清洗,吸水纸吸干,然后用锋利刀片从根尖向内1 cm处取0.5 mm×1 mm的组织块4片,重复5次。
参照郑国华等[7]的方法制备超薄切片。将切取好的组织块迅速投入用含2%焦锑酸钾的磷酸缓冲液(pH 7.6)配制的3%戊二醛固定液中,脱气后于4℃固定1 d以上;用2%焦锑酸钾-0.1 mol L-1磷酸氢二钾(pH 7.6)洗涤4次,每次30 min,4℃过夜;将材料转移至用含2%焦锑酸钾的磷酸缓冲液(pH 7.6)配制的1%锇酸中,4℃冰箱内固定4 h;然后重蒸水洗涤4次,每次30 min,冷乙醇梯度脱水,丙酮过渡,环氧树脂618包埋,LKB-5型超薄切片机切片(厚度50 nm),经醋酸双氧铀染色后,在JEM1010型透射电镜(日本电子株式会社,日本)下观察照相。
1.4 生理指标的测定
根系活力测定参考张志良等[25]的方法;细胞质膜相对透性(PMP)的测定参考李合生[26]的方法。
1.5 数据处理
采用DPS软件的新复极差法对数据进行统计分析,用SigmaPlot作图。
2 结果和分析
2.1 叶肉细胞超微结构的变化
透射电镜下,正常枇杷叶肉细胞的细胞壁结构紧密,细胞膜完整,液泡很大占据中央;叶绿体呈椭圆形或近圆形,双层膜完整,且沿细胞膜排列,切面上可见叶绿体内嵌3~5个明亮的淀粉粒(图1:A);淀粉粒周围分布垛叠规则的类囊体片层,并和基质片层连成整体(图1:B);线粒体分布在叶绿体周围,呈圆形或椭圆形,双层膜结构完整,嵴清晰且数量较多(图 1:C)。
0℃胁迫12 h叶肉细胞的细胞壁未有明显变化(图1:D),叶绿体淀粉粒清晰,基粒片层排列有序,但片层之间出现明显间隙(图1:D,E);线粒体数量增加2~3倍且嵴更清晰(图1:E)。胁迫24 h的叶绿体双层膜结构破坏,淀粉粒清晰,基粒片层垛叠程度降低;线粒体结构保持完整且嵴数量明显增加(图1:F)。胁迫36 h的叶绿体双层膜结构消失,淀粉粒变小,基粒片层结构解体明显(图1:G);线粒体膜及嵴模糊不清,细胞内含物明显增多,细胞壁变化不明显(图1:G)。胁迫48 h的叶绿体边缘解体,淀粉粒开始消失(图1:H),线粒体变形,双层膜破裂,嵴消失(图1:I)。胁迫60 h细胞解体严重,细胞内散布小泡、片层、絮状物,细胞器只有线粒体依稀可辨(图 1:J)。
-3℃胁迫12 h的叶绿体发生膨胀、扭曲,双层膜断裂,基粒片层松散但排列依然整齐(图1:K);线粒体数量增多但嵴数量减少,并少数出现空胞化(图1:K)。胁迫24 h细胞壁完好,液泡完全破裂,叶绿体胀裂,双层膜消失,基粒片层松散并出现解体,淀粉粒清晰(图1:L);细胞内出现大量絮状物,线粒体明显空胞化但尚可辨认(图1:M)。胁迫36 h后各细胞器解体严重,形态紊乱,细胞中零星分布残存的小泡、颗粒和叶绿体片层(图1:N)。胁迫60 h细胞器完全解体难以辨别(图1:O)。
-5℃胁迫12 h的叶绿体膨涨变形,淀粉粒清晰,叶绿体被膜消失(图1:P);片层结构松散断裂(图1:Q),线粒体数量增加2~3倍,嵴消失,内部出现解体和空胞化,细胞壁结构破坏明显(图1:Q)。24 h后原生质体缩成一团,细胞器解体严重难以辨别(图 1:R)。
2.2 根细胞超微结构的变化
透射电镜下观察,常温下枇杷根细胞有明显的质壁分离,中央液泡很大并将其他细胞器挤到边缘,细胞中无叶绿体(图2:A),液泡膜结构清晰可见,线粒体呈圆形或椭圆形,双层膜结构明显,嵴清晰(图 2:B)。
0℃胁迫12 h,根细胞液泡膜破裂,泡内基质外流;线粒体数量增多2~3倍(图2:C),双层膜结构完整、嵴清晰,细胞壁有破坏现象(图2:C)。胁迫24 h,细胞壁结构变得松散,内侧出现絮状物(图2:D);线粒体变形,双层膜模糊,但嵴依然清晰(图2:E)。胁迫36 h,细胞壁破坏加剧,线粒体膜破裂,嵴消失,空胞化严重(图2:F)。胁迫48 h时,细胞壁结构出现明显间隙(图2:G),线粒体少量依稀可辨,大部分被膜破裂或消失,嵴严重解体(图2:H)。胁迫60 h时,细胞壁破坏严重,线粒体解体为絮状物难以辨别(图 2:I)。
-3℃胁迫12 h,细胞膜结构破坏明显,液泡消失,原生质体缩成一团聚在中间(图2:J),细胞壁边缘解体出现絮状物(图2:K),线粒体数量增多2~3倍,形态完整但嵴的数目明显减少且部分出现空胞化(图2:L)。胁迫24 h时细胞壁胞内一侧解体加剧(图2:M),线粒体依稀可辨,嵴严重解体或消失(图2:N)。胁迫36 h后,细胞严重破坏,细胞器完全解体,无法辨认(图 2:O)。
-5℃胁迫12 h,细胞器聚成一团,线粒体外膜破裂、内嵴解体,较难识别(图2:P)。胁迫24 h时,细胞壁破坏严重,细胞器解体,残体散落在细胞各处(图2:Q)。胁迫36 h后,细胞器完全解体,细胞内充满絮状物(图 2:R)。
2.3 叶片受害情况
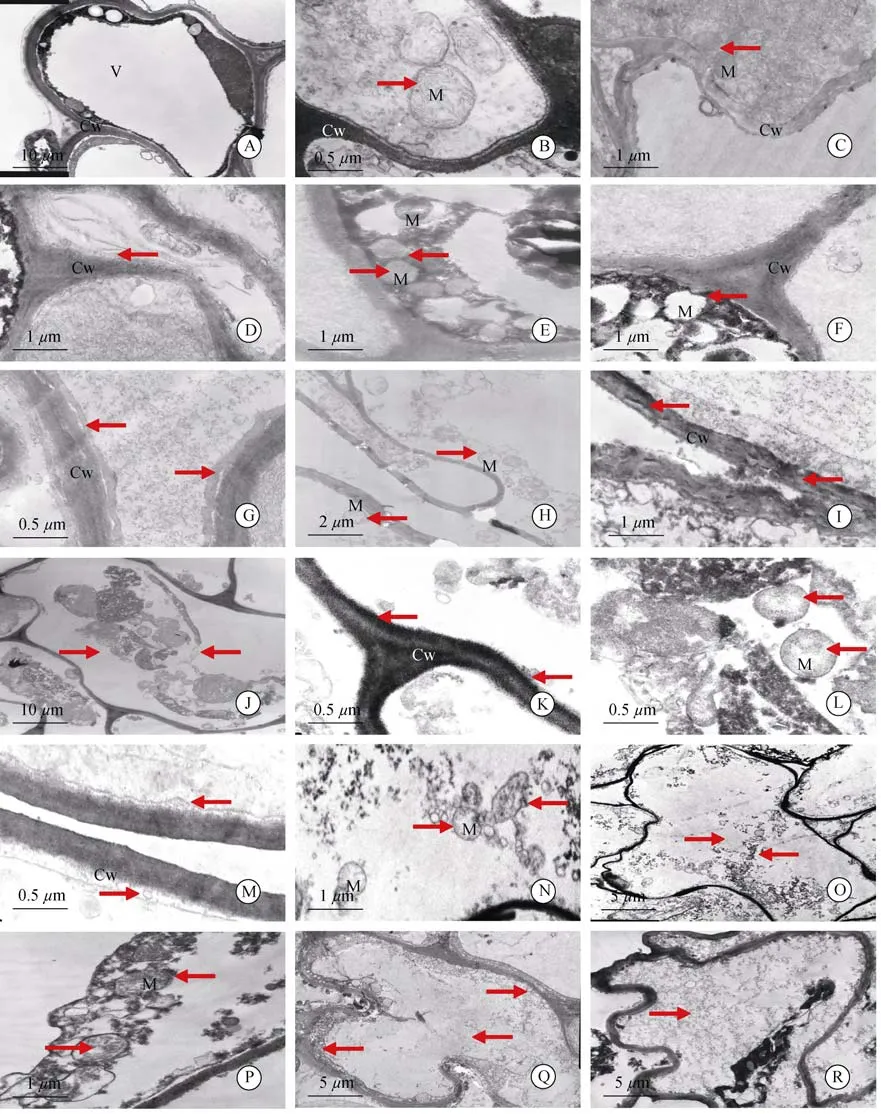
图 2 低温胁迫过程中根细胞结构的变化(箭头)。A,B:正细胞;C:0℃胁迫 12 h;D,E:0℃胁迫 24 h;F:0℃胁迫 36 h;G,H:0℃胁迫 48 h;I:0℃胁迫60 h;J~L:-3℃胁迫 12 h;M,N:-3℃胁迫 24 h;O:-3℃胁迫 36 h;P:-5℃胁迫 12 h;Q:-5℃胁迫 24 h;R:-5℃胁迫 36 h。Fig.2 Changes in structure of root cells under low temperature stress(arrows).A,B:Normal cel;C:Under 0℃ for 12 h;D,E:Under 0℃ for 24 h;F:Under 0℃ for 36 h;G,H:Under 0℃ for 48 h;I:Under 0℃ for 60 h;J-L:Under-3℃ for 12 h;M,N:Under-3℃ for 24 h;O:Under-3℃ for 36 h;P:Under-5℃ for 12 h;Q:Under-5℃ for 24 h;R:Under-5℃ for 36 h.
低温胁迫下,最先出现低温伤害症状的是幼叶 (约占20%)、其次为成熟功能叶(约占60%)、最不敏感的是老叶(约占20%)。由图3可见,0℃胁迫12~36 h,叶片褐变率仅增加5.02%,受冻叶片基本为幼叶,而在低温持续48 h后,成熟叶片出现伤害症症状,胁迫60 h后51.37%的叶片呈现低温受害症状。而-3℃胁迫12 h的伤害症状与0℃胁迫60~72 h的相当。枇杷苗在-5℃胁迫12 h后表现出完全冻害症状。这说明叶片褐变率与胁迫温度呈反比,与胁迫时间呈正比,且-3℃胁迫36 h和-5℃胁迫12 h即表现完全冻害症状。
2.4 低温对根系活力的影响
由图3可见,在0℃、-3℃、-5℃下,枇杷苗的根系活力随胁迫时间的延长整体呈下降趋势,且温度愈低,根系活力下降幅度愈大。0℃胁迫12 h的根系活力显著下降26.09%(P<0.05),之后根系活力缓慢下降但未达到显著水平,说明随0℃胁迫时间的延长,根系受害程度增加。-3℃胁迫0~12、12~24 h的根系活力分别下降32.74%和26.01%,均达极显著差异,胁迫24 h后变化平缓,说明-3℃胁迫根系即持续受害。-5℃胁迫12 h的根系活力极显著下降42.13%(P<0.01),之后则下降平缓,说明-5℃胁迫使根系受害严重。
2.5 细胞质膜相对透性(PMP)的变化
由图4:A可见,在0℃、-3℃和-5℃胁迫下,叶片的PMP随胁迫时间的延长呈持续上升趋势,且温度越低上升幅度越高。0℃胁迫12 h,PMP显著上升37.47%(P<0.05),胁迫48h的PMP仅上升23.6%,与胁迫12h的差异不显著。-3℃胁迫下,PMP随胁迫时间的延长持续上升,不同时间间均达到差异显著水平。-5℃胁迫12 h的PMP极显著上升51.19%(P<0.01),之后仍缓慢上升,说明低温胁迫对叶片造成受害。
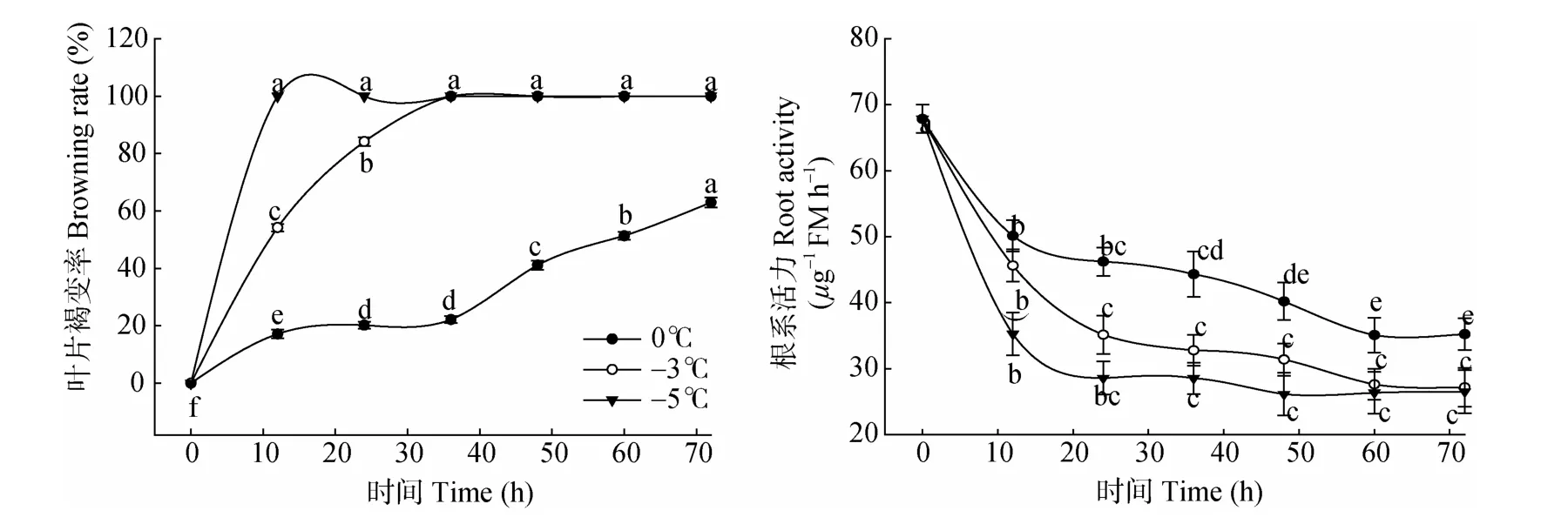
图3 低温胁迫下枇杷苗叶片褐变率和根系活力的变化。不同英文字母表示差异显著(P<0.05)。下同。Fig.3 Changes in leaf browning rate and root vigor of loquat seedlings under low temperature stress.Different letters indicate significant difference at 0.05 level.The same is following figure.
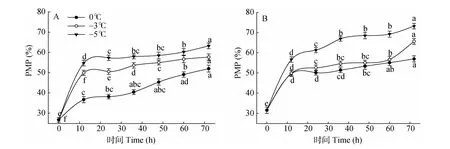
图4 低温胁迫对枇杷苗叶(A)、根(B)的PMP变化Fig.4 Changes in leaf(A)and root(B)PMP of Eriobotrya japonica under low temperature stress
由图4:B可见,在0℃、-3℃、-5℃胁迫下,根系的PMP随胁迫时间的延长均呈上升趋势,且胁迫温度愈低,PMP上升愈高。0℃胁迫12 h的PMP极显著上升36.49%(P<0.01),之后缓慢上升。-3℃胁迫12、72 h PMP分别比胁迫0、60 h显著上升了36.74%和13.72%(P<0.05)。-5℃胁迫12、24和36 h的PMP分别比胁迫0、12、24 h显著上升44.32%、7.53%和8.46%(P<0.05)。
3 讨论
许多研究表明,低温胁迫下植物细胞会出现质壁分离现象[6],因质壁分离可以引起液泡脱水,从而使液泡缩小以增加原生质浓度来减轻低温伤害[27]。质壁分离程度越高,对细胞结构的破坏程度越大,表明细胞抗低温能力越弱[28]。本研究中枇杷植株在10℃低温锻炼2 d后,根细胞出现质壁分离和液泡缩小现象,而叶肉细胞结构略有变化但未出现质壁分离现象,说明根细胞的抗低温能力弱于叶肉细胞。
低温胁迫下细胞可以通过消耗呼吸底物,增强呼吸作用,提高能量代谢来抵抗低温伤害。电镜下观察表明,低温胁迫后线粒体和嵴数量增多[8]。本研究中,轻度低温(0℃)胁迫下根细胞和叶肉细胞的线粒体和嵴数量均明显增多,这与前人的研究结果一致。随胁迫时间的延长,根细胞和叶肉细胞对低温表现出明显差异,根细胞线粒体双层膜破裂、嵴消失的现象比叶肉细胞早发生12 h,这可能是叶肉细胞中的淀粉粒为逆境呼吸提供了更多的呼吸底物。淀粉是葡萄糖分子聚合而成的长链化合物,逆境下淀粉粒可以重新分解为葡萄糖,作为呼吸底物,参加三羧酸循环。而根细胞比叶肉细胞缺少了淀粉粒,这可能是导致地下部抗寒性低于地上部的一个重要因素。
膜体系的损伤是造成植物受害的根本机制[29-30]。细胞发生冰冻伤害会产生冰晶,造成细胞脱水[8],脱水时的收缩直接造成了质膜的破坏,表现为液泡破裂、原生质体浓缩、叶绿体膨大、线粒体肿胀,类囊体排列不规则,线粒体膜和嵴消失、细胞内出现空泡化等现象[31]。本研究在-3℃和-5℃胁迫下,根细胞和叶肉细胞内均结冰,导致一系列受害现象,叶绿体解体和线粒体的内嵴破坏,都是不可逆的,并最终导致植株死亡[32]。
本研究在透射电镜下观察表明,低温不仅会损伤膜系统,还会对细胞壁造成破坏。细胞壁主要由纤维素、半纤维素和果胶质构成,结构高度复杂[33],细胞壁表面糖蛋白脱落到细胞间隙中或凝集成块进入细胞内部都是导致个体间抗寒性差异的原因[31]。因细胞壁本身没有生命迹象,所以不会因低温而产生直接破坏。而细胞结冰就会对细胞壁造成机械伤害[8]。轻度低温胁迫36 h,叶肉细胞壁无明显受害症状,而根细胞壁明显破坏,且先发生在细胞壁内侧。从细胞壁的破坏程度和发生位置可以推测,轻度低温胁迫引起了根细胞胞间结冰。细胞间因吸水导致体积膨胀,细胞内因缺水导致收缩,是细胞壁外侧光滑而内侧首先损伤的根本原因[8]。
叶片褐变率、根系活力和PMP指标可以直接反映叶片和根的冻害程度。轻度低温胁迫12 h后,根系活力下降26.09%,而叶片褐变率仅升高17.15%,胁迫12~48 h根系PMP值持续升高而叶片PMP值升高不显著,表明0℃下枇杷苗根部表现持续受害,而叶片则表现出较强的适应性,受害症状不明显。这说明地下部较地上部对低温更敏感。
综上所述,枇杷苗叶肉细胞比根细胞对低温具有更强的适应性,一方面是因为不同器官在不同环境下长期的适应性,可能导致地下部根细胞的适应性弱于地上部叶肉细胞;另一方面是与底物贮藏量有关,低温胁迫下细胞通过增强呼吸作用提高抗逆性,而无论是三羧酸循环还是抗氰呼吸在胁迫环境下都需要消耗大量底物,枇杷苗根细胞底物的储备量相对叶肉细胞的少,因此更容易受低温危害。
枇杷苗根尖比叶对低温更敏感,因此从防御策略上,对枇杷园进行生草栽培,或在极端低温到来之前实施地表覆草、覆盖等保温措施,提高地温,并结合喷洒防霜剂和植物生长调节剂类物质[10],来提高枇杷耐寒能力,以期达到更好的防寒效果。因本研究仅是对较不耐寒品种,对耐寒品种地下部与地上部低温胁迫下的反应有待进一步研究。
