HPV-18型晚期基因L1在宫颈脱落细胞中的表达与突变研究
2019-08-05宛传丹赵一琳崔燕红林爱琴卜文婕朱晓蕾
汪 萍,宛传丹,赵一琳,崔燕红,宫 磊,林爱琴,卜文婕,朱晓蕾
(1.皖南医学院 医学生物学教研室,安徽 芜湖 241002;2.常熟市医学检验所 分子生物学实验室,江苏 常熟 215500)
全球子宫颈癌每年新发病例85%以上集中在发展中国家,我国约占12%[1]。宫颈癌及其癌前病变均与人乳头瘤病毒(human papilloma virus,HPV)持续感染直接相关,尤以HPV 16和18型感染最为严重[2]。HPV病毒颗粒的壳蛋白L1由其晚期基因(late gene)编码,是HPV病毒的主要结构蛋白[3]。在病毒整合入宿主染色体后,L1蛋白表达将缺失。因此,L1蛋白的表达情况能直观地反映宫颈组织中HPV病毒感染状态[4-6]。临床检测HPV-18 L1基因表达水平将有助于诊断HPV-18持续感染所造成的宫颈病变程度,目前对HPV-18型感染的宫颈疾病中L1基因表达情况研究较少[7-8]。本文检测分析HPV-18型感染的宫颈脱落细胞中L1基因的蛋白表达阳性率分布,并针对L1基因突变进行测序分析,研究其在宫颈病变诊断中的作用与临床意义。
1 资料与方法
1.1 一般资料 选取2016年8月~2017年8月在常熟市第一人民医院、常熟市第二人民医院、常熟市中医院妇产科门诊就诊的宫颈疾病患者。患者年龄21~65岁。以无菌棉拭子擦去宫颈口分泌物,再用锥形刷在宫颈口轻轻旋转3周获取脱落细胞标本。锥形刷置于专用细胞保存液试管中,尽快送检。经HPV分型检测,只收取单纯HPV-18型感染的脱落细胞。依据患者临床病理诊断分为慢性宫颈炎192例、宫颈上皮内瘤变CIN Ⅰ、CIN Ⅱ共143例、宫颈上皮内瘤变CIN Ⅲ 127例和宫颈癌41例。DNA提取与HPV分型检测采用港龙生物HPV 26型(基因芯片法)试剂盒进行。
1.2 L1基因PCR 以上述所提取并经分型检测为单纯HPV-18型的DNA为模板,用特异性引物进行L1基因扩增PCR反应,引物核苷酸序列及PCR反应参数参考文献[9-10]。PCR产物结果以1.2%琼脂糖凝胶电泳进行验证。
1.3 基因测序与比对 纯化PCR扩增产物后进行Sanger法核苷酸序列测定(ABI 基因测序仪3500Dx)。将基因测序核苷酸结果与基因数据库中HPV-18 L1基因序列(GenBank reference X05015)差异进行比较分析,再利用DNAStar软件中的SeqMan程序分析基因区氨基酸序列变异。
1.4 L1壳蛋白检测 采用自动制片系统进行制片,所制涂片在96%乙醇中固定20 min后进行染色。使用HPV L1细胞蛋白检测试剂盒(购自美国Advanced公司)进行L1蛋白检测分析。L1壳蛋白为核蛋白,细胞核呈红色染色即为阳性染色,只要1个被红染即可诊断L1蛋白阳性表达。
1.5 统计学分析 运用SPSS 18.0软件进行统计学分析。分类资料采用例数或百分数表示,组间比较采用χ2检验,趋势分析采用χ2趋势检验。P<0.05为差异有统计学意义。
2 结果


注:M为DNA标准分子;L1为1690 bp
图1 HPV-18型L1基因扩增片段电泳检测图
表1 不同分组中L1基因扩增阳性率比较[n(%)]
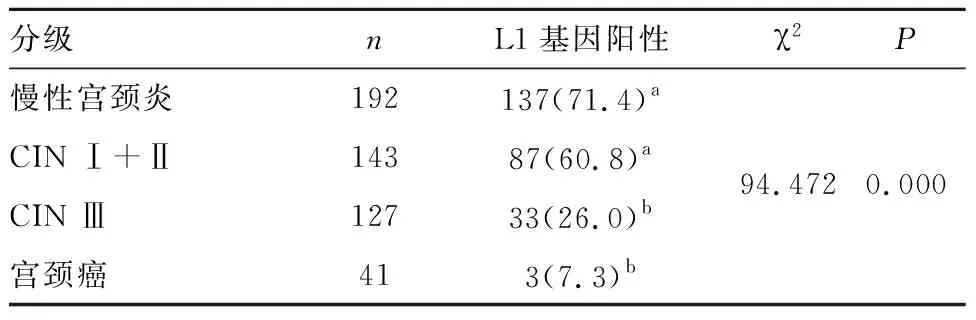
分级nL1基因阳性χ2P慢性宫颈炎192137(71.4)aCIN Ⅰ+Ⅱ14387(60.8)a94.4720.000CIN Ⅲ12733(26.0)b宫颈癌413(7.3)b
注:多组间两两比较,符号不同表示P<0.05。
2.2 基因突变分析 选取宫颈癌组20例进行L1基因序列测定。以突变类型分类,则20例中存在11种类型。对比GenBank中HPV-18 L1基因序列(GenBank reference X05015),通过SeqMan软件分析发现其中4种错义突变,导致氨基酸序列变异。包括第263位点C>G;第413位点C>T;第987位点A>C;第1256位点A>G。其余均为同义突变,并不导致L1壳蛋白氨基酸序列变化。结果见表2。

3 讨论
高危型HR-HPV病毒基因能编码出具有转化功能的癌蛋白[11],能促进宫颈上皮细胞病变。由HPV-16和HPV-18持续感染造成的宫颈癌约占70%[12]。由于HPV病毒在持续感染过程中,其基因具有整合到宿主(人)染色体基因组中的能力,整合后HPV病毒晚期基因L1基因转录表达将逐渐缺失,当L1免疫靶蛋白表达缺失后,HPV病毒感染细胞将不能被免疫系统有效识别,进而促进了上皮细胞恶性病变[13]。
表2 20例宫颈癌患者HPV-18型L1基因测序突变情况

L1基因突变类型1234567891011121314151617181920c.263C>G*√√√√√√√c.413C>T*√√√c.438C>T√√√√√√√c.495A>T√√√√√√√√√c.495A>G√√√√√√√√c.969T>C√√√√c.987A>C*√√√√√c.1071T>C√√√√√√c.1236T>C√√√√√√c.1256A>G*√√√c.1287A>G√√√√√√√√
*表示引起氨基酸序列突变。
表3 病理分级分组中HPV-18型L1蛋白阳性率比较

分级nL1蛋白阳性[n(%)]χ2P慢性宫颈炎192192(100.0)aCIN Ⅰ+Ⅱ143117(81.8)b227.1690.000CIN Ⅲ12744(34.6)c宫颈癌415(12.2)d
注:多组间两两比较,符号不同表示P<0.05。
本研究中,L1蛋白在慢性宫颈炎中阳性率最高,随着病变程度增加,其阳性率呈下降趋势,至宫颈癌变后,脱落细胞标本中已检测不出L1蛋白表达。宫颈病变病理分级越严重,其HPV病毒L1蛋白表达则越少。这与文献[14-15]报道的HPV病毒早期基因(early gene,E基因)表达情况完全相反,E基因mRNA表达阳性率随宫颈病变严重程度而上升。结果提示,HPV-18型晚期基因L1基因扩增阳性率与临床宫颈疾病进展存在密切关系。L1表达的蛋白量与宫颈病变严重程度总体呈负相关趋势。
L1基因表达的蛋白能触发宿主免疫系统反应,因此,L1蛋白可作为人体细胞免疫反应靶蛋白,是HPV疫苗制作的抗原基础。经基因测序分析发现20例宫颈癌变中HPV-18型的晚期基因L1基因序列存在11种突变,同一突变类型出现在多位病例中,并且同一病例也会出现多种突变类型的现象,其中4种突变导致蛋白一级结构氨基酸序列的转换,而其余多数为无义突变,并不引起氨基酸的序列变化。突变位点类型中有9种已有报道[3,9-10],另有2种基因突变(c.969T>C,c.438C>T)本研究首次报道。
L1蛋白表达状态直接反映病毒存在状态以及病变程度,可作为HPV病毒感染的检验指标。基于L1基因表达的HPV检测方法对宫颈疾病的早期筛查以及临床诊断预后发挥着重要的临床意义。研究基因突变形式对疫苗的研制与病毒感染的免疫治疗等有着重要意义。L1基因序列的突变与致癌机制间的关系,目前尚不明确。这些突变对人体免疫系统的识别以及疫苗的预防与治疗作用可能产生潜在的影响,这将是未来宫颈癌早期诊断与治疗的研究方向。
