菌株LYH18发酵条件优化及肌氨酸氧化酶的分离纯化
2019-07-30迟乃玉李美玉张庆芳
迟乃玉,刘 洋,于 爽,希 伦,李美玉,张庆芳*
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
肌氨酸氧化酶(sarcosine oxidase,SOX)EC.1.5.3.1是酶法测定肌酐中的关键酶,可催化肌氨酸中的N-甲基的氧化还原,可偶联肌酐酶和肌酸酶将肌酐降解[1-3]。作为测定血清或尿液中肌酐含量的关键酶之一,被用于诊断肾脏的健康程度[4-6]。为了满足工业用酶的需求,研究学者们从肌氨酸氧化酶的分布、酶学性质以及分子生物学方面进行了大量研究[7-10]。MORI N等[7]研究发现,真菌Cylindrocarpon didymiumM-1可产单聚体SOX,测得该酶分子质量为48 kDa,最适pH值为7.5,最适温度为40℃。刘辉等[8]从菜园土壤中筛选出一株芽孢杆菌(Bacillussp.)BSD-8,纯化后的酶在十二烷基硫酸钠-聚丙酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)中均显示单一条带,为单聚体SOX,分子质量为51 kDa,米氏常数(Km)值为3.1 mmol/L,最适合pH 8.5,在7.0~10.0之间稳定,最适温度为60℃,60℃处理10 min,仍有94%的酶活,是目前热稳定性最好的。SUZUKI N等[9]从棒状杆菌Corynebacteriumsp.U-96中获得由四个亚基组成的SOX,亚基大小分别为10 kDa、21 kDa、44 kDa、110 kDa,酶的米氏常数(Km)值为3.8 mmol/L,最适pH 8.3,最适温度37℃,在45℃处理10 min,酶完全失活。KIM J M等[10]筛选到1株反硝化产碱菌(Alcaligenes denitrificans),SDS-PAGE有两条条带,分别为55 kDa、100 kDa,最适pH 8.0,最适温度为37℃,30℃以下稳定,酶的米氏常数(Km)值为4.2 mmol/L。
在临床试验中,血清肌酐浓度是判断肾功能的重要指标。目前肌酐的测定通常用Jaffé法测定[11]。该方法是基于化学反应基础上的,特异性较差,血清中许多化学物质会干扰测定结果,这使得疾病的诊断变得困难[12]。由于酶催化反应具有比一般化学反应更高的特异性,开发出酶促肌酐的测定方法为近年来的研究热点[13-15]。本实验对海洋来源的产肌氨酸氧化酶的芽孢杆菌(Bacillussp.)LYH18进行研究,对其产酶条件进行优化,并采用十二烷基硫酸钠-聚丙酰胺凝胶电泳(SDS-PAGE)对该酶进行分离纯化,分析其分子质量,以期为肌氨酸氧化酶工业化生产、酶法制备肌氨酸氧化酶工艺以及肌氨酸氧化酶法检测肌酐试剂盒的研究奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
芽孢杆菌(Bacillussp.)LYH18:分离自辽宁省大连渤海湾海域的海泥海水样品,现由大连大学生物工程学院发酵工程实验室保藏。
1.1.3 化学试剂
肌酸(分析纯):大连凯美化工有限公司;蛋白Marker:加拿大Fermentas公司;普通琼脂糖凝胶DNA回收试剂盒:北京TIANGEN生物公司;葡聚糖凝胶G-75:北京索莱宝科技有限公司。其余试剂均为国产分析纯。
1.1.3 培养基
固体LB培养基:胰蛋白胨1%,酵母浸粉0.5%,琼脂2%,NaCl 1%,水1 L;pH 7.0。
种子培养基:肌酸,5.0 g;酵母膏,0.5 g;硫酸镁,0.5 g;磷酸氢二钾,0.5 g;磷酸二氢钾,2 g;海水1 L;pH 7.0。
基础发酵培养基:肌酸,8.0 g;酵母膏,5.0 g;硫酸镁,0.5 g;磷酸氢二钾,0.5 g;磷酸二氢钾,2 g;海水1 L;pH 7.0。
以上培养基均在0.1MPa、121℃高压蒸汽灭菌20min[16]。
1.2 仪器与设备
LDFX-50BI立式压力蒸汽灭菌锅、GelDoc XR+凝胶成像系统、HZP-256全温振荡培养箱:兰州方盛生物科技有限公司;CX21FS3显微镜:日本OLYMPUS公司;P3031移液器:美国吉而逊实验仪器有限公司;APL-204电子天平、pH-3G pH计:陕西鼎盛仪器公司;DYY-6C电泳仪:北京市六一仪器厂。
1.3 方法
1.3.1 菌株培养
菌株活化:在无菌条件下,将芽孢杆菌LYH18接种到固体LB培养基中并在25℃静置培养24 h,三区划线进行分离纯化,4℃条件下储存,以备后续实验使用。
种子培养:在无菌条件下,用接种环挑取一环菌体,接种于装液量为100 mL/250 mL的种子培养基中,25℃、150 r/min条件下培养24 h。
发酵培养:在无菌条件下,将上述种子液按1%的量接种于装液量200 mL的发酵培养基中,25℃、150 r/min条件下培养24 h。
1.3.2 肌氨酸氧化酶粗酶液制备
将通过最适发酵条件培养的发酵液,4℃条件下8 000 r/min离心15 min,收集菌体,用50 mmol/L,pH 7.4的磷酸缓冲液(phosphate buffered saline,PBS)进行吹打冲洗后离心,重复3次,再将其悬浮于两倍体积的缓冲液中。通过超声波200 W破3 s停3 s条件下将细胞破碎,4℃条件下12 000 r/min离心30 min,取上清,得到粗酶液。
1.3.3 肌氨酸氧化酶酶活测定方法[17-19]
将粗酶液0.1 mL加入到0.9 mL的焦磷酸钠缓冲液(含0.1 mol/L肌氨酸)中,于37℃反应10 min,再加入0.25 mL 0.1 mol/L的醋酸终止反应,加入1.5 mL 20%的乙酸铵溶液(含0.04%乙酰丙酮),于37℃反应40 min后,在波长410 nm处测吸光度值(OD410nm值)。
产肌氨酸氧化酶酶活定义:37℃每分钟分解1 μmol肌氨酸的酶量为一个酶活单位(U)。
1.3.4 产酶曲线和生长曲线测定
在基础发酵培养基中,接入1%的菌液进行发酵培养。无菌条件下,在不同时间(0~120 h),对发酵液进行取样,0~60 h,每隔4 h测OD410nm,60~120 h,每隔12 h测OD410nm值,计算酶活,绘制时间-酶活曲线;0~12h,每隔3h测OD600nm值,12~60 h,每隔6 h测OD600nm值,60~120 h,每隔12 h测OD600nm值,绘制菌株生长曲线。
1.3.5 发酵条件优化单因素试验
(1)诱导物对菌株LYH18产肌氨酸氧化酶的影响
在基础发酵培养基中,加入1%不同诱导物(肌酸、肌酐、肌氨酸、氯化胆碱、不加诱导物的为空白对照组),接种1%的菌液在25℃、150 r/min条件下振荡培养72 h。测定粗酶液酶活。相对酶活:以该组最大酶活为100%,其他酶活占其百分比为相对酶活,下同。
(2)不同碳源对菌株LYH18产肌氨酸氧化酶的影响
在发酵培养基中,加入1%不同种类的碳源(肌酸、果糖、柠檬酸钠、乙酸钠、乳糖、葡萄糖),接种1%的菌液在25℃、150r/min条件下振荡培养48h,测定粗酶液酶活。
(3)碳源添加量对菌株LYH18产肌氨酸氧化酶的影响
在发酵培养基中,加入1%不同浓度(0.25%~1.50%,梯度为0.25%)的肌酸,接种1%的菌液在25℃、150 r/min条件下振荡培养72 h,测定粗酶液酶活。
(4)不同氮源对菌株LYH18产肌氨酸氧化酶的影响
在发酵培养基中,加入1%不同种类氮源(牛肉膏、酵母膏、蛋白胨、玉米浆、明胶、酪蛋白),接种1%的菌液在25℃、150 r/min条件下振荡培养72 h,测定酶活。
(5)氮源添加量对菌株LYH18产肌氨酸氧化酶的影响
在发酵培养基中,加入1%不同浓度的最优氮源(0.4%~2.0%,梯度为0.4%),接种1%的菌液在25℃、150 r/min条件下振荡培养72 h,测定酶活。
(6)无机盐对菌株LYH18产肌氨酸氧化酶的影响
将发酵培养基中的KH2PO4、MgSO4·7H2O、K2HPO4添加量分别设为0.030%~0.060%,梯度为0.010%,25℃、150r/min条件下振荡培养72 h,测定粗酶液酶活。
(7)初始pH对菌株芽孢杆菌LYH18产肌氨酸氧化酶的影响
用酸碱指示剂调节发酵培养基至不同的初始pH值(pH 5~10,梯度为0.5),25℃、150 r/min条件下振荡培养72h,测定粗酶液酶活。
(8)培养温度对菌株LYH18产肌氨酸氧化酶的影响
将发酵培养基置于不同温度下(15~35℃,梯度为5℃),25℃、150 r/min条件下振荡培养72 h,测定粗酶液酶活。
(9)装液量对菌株LYH18产肌氨酸氧化酶的影响
设置不同装液量(10mL/100 mL~40 mL/100 mL梯度为10 mL,60 mL/100 mL),按1%接种量接种于发酵培养基中,25℃、150 r/min振荡培养72 h,测定粗酶液酶活。
1.3.6 酶的分离纯化
硫酸铵沉淀:向1.3.2节中制备的粗酶液中缓慢加入硫酸铵,使溶液中硫酸铵饱和度达到20%,4℃静置过夜后,在4℃、8000r/min条件下离心10min,取上清液,备用。在上清液中继续加入硫酸铵,使其饱和度达到80%,4℃静置过夜后8 000 r/min条件下冷冻离心10 min,弃去上清,将沉淀重悬于50 mmol/L磷酸盐缓冲液(phosphate buffer solution,PBS)(pH 7.4),将经过硫酸铵沉淀后的酶液装入透析袋中,用pH 7.4的PBS缓冲液作为交换液进行透析,每隔12 h进行更换一次缓冲液,至无SO42-为止。将透析后的样品加入超滤管,4℃、8 000 r/min条件下离心10 min后保留上清液,备用。
Sephadex G-75凝胶过滤层析:取6 mL透析后的样品加入用PBS(pH 7.4)缓冲液预平衡的Sephadex G-75凝胶过滤层析柱。在0.1MPa柱压、流速0.5mL/min条件下,用3倍柱床体积的PBS缓冲液(pH 7.4)洗脱后,再用含0~1 mol/L氯化钠的PBS缓冲液(pH 7.4)进行线性梯度洗脱,体积流量为1 mL/min,每管收集6 mL,测定每个收集管肌氨酸氧化酶活力和总蛋白含量。在波长280 nm处的紫外光下检测样品。在线测定酶活后,收集合并有酶活洗脱液。
1.3.7 酶的纯度及分子质量测定
通过SDS-PAGE测定肌氨酸氧化酶的分子质量,标准蛋白为兔磷酸化酶B(97.4 kDa)、牛血清白蛋白(66.2 kDa)、兔肌动蛋白(43.0 kDa)、牛碳酸酐酶(31.0 kDa)、胰蛋白酶抑制剂(20.1 kDa)、鸡蛋清溶菌酶(14.4 kDa)。采用12%的分离胶、5%的浓缩胶,电泳2 h结束后,用R250染色液漫过胶,置于摇床,25℃、45 r/min条件下染色1 h,后加脱色液于脱色摇床25℃、45 r/min条件下脱色12 h,期间每3 h更换一次脱色液。
2 结果与分析
2.1 生长曲线和产酶曲线
由图1生长曲线可知,芽孢杆菌LYH18在0~18 h随时间的延长生长量急剧增加,说明该菌适应性很强,迟滞期很短甚至没有,0~18 h为其生长的对数期;18~50 h生长量稳定,为稳定期,此期细菌增殖数与死亡数几乎相等,芽孢和大多数酶亦多在此期形成;50 h后生长量降低,进入衰退期,72 h之后该菌几乎停滞生长。
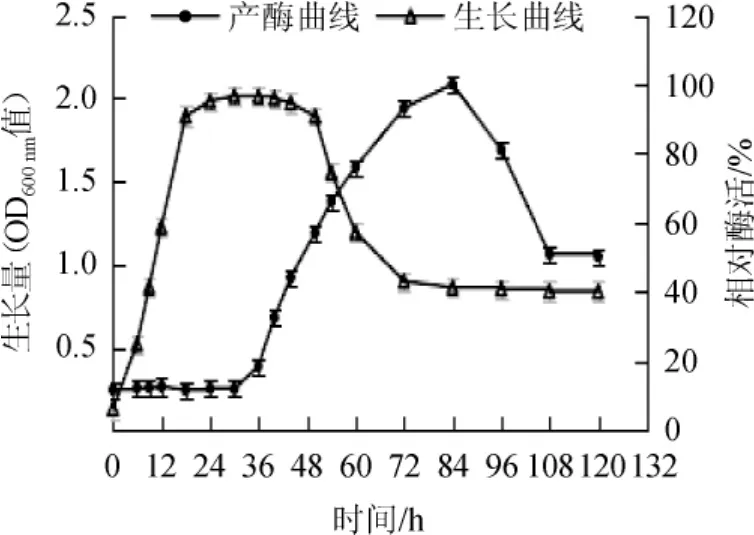
图1 芽孢杆菌LYH18产肌氨酸氧化酶与生长曲线Fig.1 Sarcosine oxidase production and growth curve of BacillusLYH18
由图1产酶曲线可知,该菌株在0~30 h,粗酶液酶活极低,基本为零,因该酶为滞后合成酶,在生长的前期并不产酶;36~84 h酶活随时间增长而增高,说明36 h后即稳定期后期,该菌开始产SOX;在84 h时达到最大值,为1.65 U/mL;在84 h后酶活逐渐降低;该菌在72 h时酶活较高,十分接近最大值,结合生长曲线特性,设定发酵培养时间为72 h。
2.2 发酵条件单因素优化试验结果
2.2.1 诱导物对芽孢杆菌LYH18产酶的影响
SOX是一种诱导酶,在发酵培养时必须加入一定量的诱导物。不同诱导物对芽孢杆菌产酶的影响见图2。

图2 不同诱导物对菌株芽孢杆菌LYH18产肌氨酸氧化酶的影响Fig.2 Effect of different inducers on sarcosine oxidase production by BacillusLYH18
由图2可知,肌酸对酶的诱导作用最强,其次为肌酐,依次为肌酸>肌酐>肌氨酸>氯化胆碱,因此,选用肌酸作为发酵诱导物。进一步查阅氯化胆碱相关资料可知,其虽然可诱导该菌株合成SOX,但并不是SOX底物,不能被SOX分解[20]。
2.2.2 不同碳源对芽孢杆菌LYH18产酶的影响
在培养基中加入1%的不同碳源进行发酵,并测定酶活性,结果见图3。由图3可知,肌酸、乙酸钠、葡萄糖对菌株产酶活性有促进作用,其中肌酸>乙酸钠>葡萄糖;肌酸的促进作用十分显著,在加入1%的肌酸后,SOX活性比对照组显著提高;而果糖、柠檬酸钠、乳糖则对菌株产酶有抑制作用,抑制作用大小为柠檬酸钠>乳糖>果糖。因此,肌酸可作为诱导物且为唯一碳源。
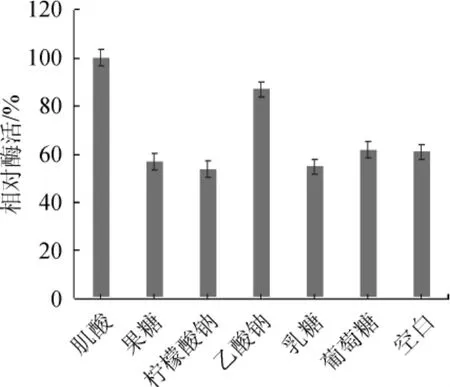
图3 不同碳源对菌株芽孢杆菌LYH18产肌氨酸氧化酶的影响Fig.3 Effect of different carbon sources on sarcosine oxidase production byBacillusLYH18
2.2.3 肌酸加入量对芽孢杆菌LYH18产酶的影响
在培养基中加入不同浓度的肌酸进行发酵,测定其酶活性,结果见图4。由图4可知,在较低浓度下,肌酸对酶的产生具有显着影响。随着肌酸的添加,酶的产生能力增加,至肌酸添加量为1%时达到最大值,肌酸添加量>1.0%之后,对菌株产酶能力有抑制作用。因此,选择最适肌酸添加量为1.0%。
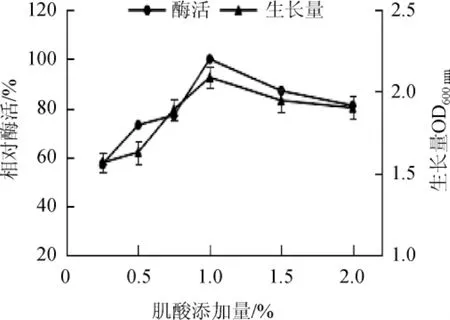
图4 不同肌酸添加量对菌株芽孢杆菌LYH18产肌氨酸氧化酶的影响Fig.4 Effect of different creatine addition on sarcosine oxidase production byBacillusLYH18
2.2.4 不同氮源对芽孢杆菌LYH18产酶的影响
在培养基中加入1%的牛肉膏、酵母膏、蛋白胨、玉米浆、明胶、酪蛋白作为微生物的补充氮源进行发酵培养,粗酶液酶活测定结果见图5。由图5可知在所测定的氮源中,酵母膏和玉米浆对该菌株产SOX有较大促进作用,酵母膏的促进作用尤其明显。因此,选择酵母膏作为该菌产酶的最适氮源[21]。酵母类有机氮源中蛋白质含量高(蛋白质占干菌体总质量50%以上),含有18种氨基酸,种类齐全,维生素和矿物质等含量丰富,是微生物菌体培养与产物发酵的优质有机氮源[22]。
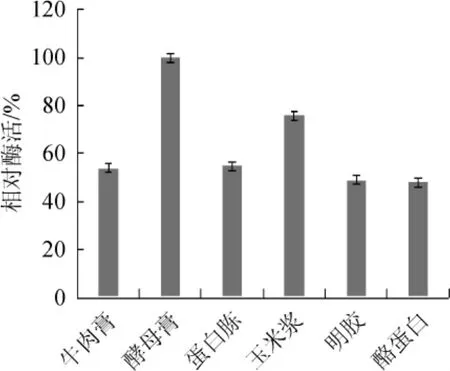
图5 不同氮源对菌株芽孢杆菌LYH18产肌氨酸氧化酶的影响Fig.5 Effects of different nitrogen sources on the sarcosine oxidase production byBacillusLYH18
2.2.5 酵母膏添加量对芽孢杆菌LYH18产酶的影响
以酵母膏为最优氮源,在培养基中加入不同量的酵母膏,粗酶液酶活测定结果见图6。由图6可知,当酵母膏添加量为0.8%时,酶活最高;添加量1.0%、1.2%时,相对酶活均在60%以上;添加量为0.4%、2.0%时,相对酶活不足60%,酵母膏添加量过高或过低均不利于发酵产酶。因此,选择最适酵母膏添加量为0.8%。
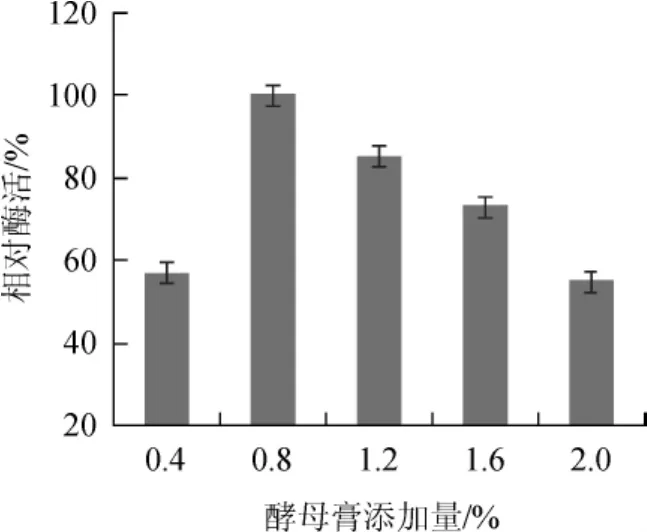
图6 不同酵母膏添加量对菌株芽孢杆菌LYH18产肌氨酸氧化酶的影响Fig.6 Effect of different yeast extracts addition on sarcosine oxidase production byBacillusLYH18
2.2.6 无机盐最适添加量对菌株LYH18发酵产酶的影响
由表1可知,无机盐K2HPO4、MgSO4·7H2O、KH2PO4对发酵产酶均有一定的影响。且当K2HPO4添加量为0.05%时,肌氨酸氧化酶相对酶活最高;MgSO4·7H2O添加量为0.05%时,肌氨酸氧化酶相对酶活最高,而当MgSO4·7H2O添加量>0.05%时,相对酶活逐渐降低;KH2PO4添加量为0.05%时,相对酶活最高,且浓度过高或过低均不利于产酶,分析原因可能无机盐的过量缺乏或累积均会抑制产酶。因此,确定各种无机盐最时添加量为K2HPO40.05%、MgSO4·7H2O 0.05%、KH2PO40.20%。

表1 无机盐添加量对芽孢杆菌LYH18产肌氨酸氧化酶的影响Table 1 Effect of inorganic salt addition on sarcosine oxidaseproduction byBacillusLYH18
2.2.7 培养基初始pH值对菌株LYH18产酶的影响
酶的本质是一种蛋白质,酶不能够在过酸或过碱条件下具有较高活性甚至会失去活性[23]。为研究该菌株产SOX的最适起始pH,以0.5为梯度,在pH 5~10之间选择了11个pH值,测定粗酶液酶活力,结果见图7。由图7可知,初始pH值在5.5~7.0之间,酶活随初始pH值增加而增加,初始pH值7.0时酶活达到最大值;初始pH值在7.5~10.0之间时,酶活随着pH值增加而降低;初始pH值<5.5及>8.5时,酶活极低,趋近于零,说明酸碱环境对该菌株产酶均有明显抑制作用。因此,确定该菌株的最适产酶初始pH值为7.0。

图7 培养基起始pH值对芽孢杆菌LYH18产肌氨酸氧化酶的影响Fig.7 Effect of initial pH of medium on sarcosine oxidase production byBacillusLYH18
2.2.8 培养温度对菌株芽孢杆菌LYH18产酶的影响
一般而言,温度越高,化学反应速率越快,在一定温度范围内,酶的催化作用也是如此。但酶的本质是一种蛋白质,温度太高可以使其发生不可逆转的变性,使其失去酶的催化活性[24]。为研究该菌株产SOX的最适温度,将发酵温度分别控制在(15~35℃,梯度为5℃),发酵培养72 h后,测定酶活,结果见图8。由图8可知,温度在15~25℃时,酶活力随着温度升高而升高;当温度为25℃时,酶活力达到最大值0.45 U/mL;当温度高于25℃之后,酶活力呈下降趋势,酶活在20~30℃能保持75%以上相对酶活。因此,确定该菌株发酵最适温度为25℃。
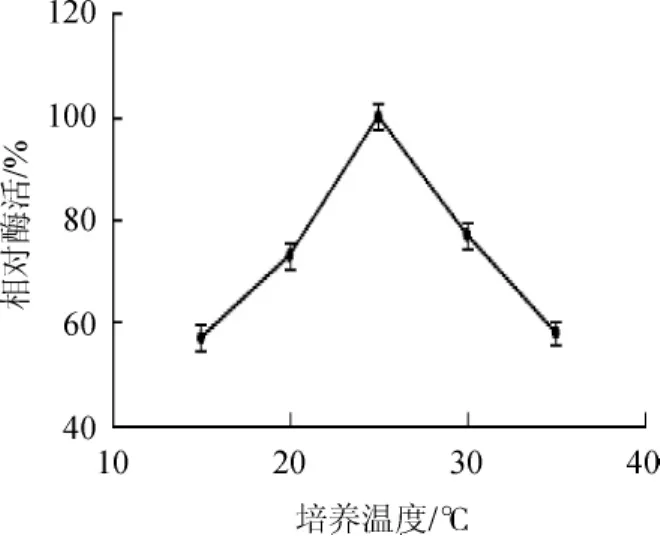
图8 不同培养温度对芽孢杆菌LYH18产肌氨酸氧化酶的影响Fig.8 Effect of different culture temperature on sarcosine oxidase production byBacillusLYH18
2.2.9 装液量对菌株芽孢杆菌LYH18产酶的影响
考察装液量对菌株芽孢杆菌LYH18产酶的影响,测定酶活及生长量,结果见图9。由图9可知,当培养基装液量从10 mL/100 mL增加至40 mL/100 mL时,产酶能力增加了2倍以上,继续提高装液量后,产酶能力迅速降低,分析原因可能是该菌株为好氧菌,较少通气量有利于菌株产酶,但当氧气供应太少会严重影响菌体生长,而最终影响酶的产生[23-24]。因此,最适装液量为40 mL/100 mL。
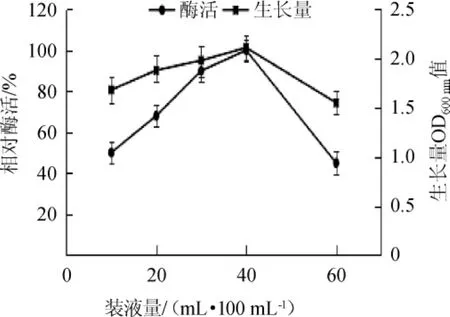
图9 通气量对芽孢杆菌LYH18产肌氨酸氧化酶的影响Fig.9 Effect of ventilation on sarcosine oxidase production by BacillusLYH18
2.3 肌氨酸氧化酶的分离纯化
2.3.1 硫酸铵分级沉淀
硫酸铵沉淀法可用于从大量粗制剂中浓缩和纯化蛋白,利用此法可从粗酶液中分离出较纯的SOX酶液,结果见图10。由图10可知,当硫酸铵盐饱和度为50%时,开始可以检测出SOX活性,随着硫酸铵盐饱和度的增加,酶活性不断增加,当硫酸铵盐饱和度达到70%时,活性最高,因此,确定SOX在硫酸铵盐饱和度为50%~70%时沉淀下来。

图10 硫酸铵对肌氨酸氧化酶的分级沉淀Fig.10 Fractionation precipitation of sarcosine oxidase by ammonium sulfate
2.3.2 凝胶过滤层析
将硫酸铵盐析纯化后的酶液经Sephadex G-75凝胶柱层析后,洗脱曲线见图11。由图11可知,出现7个吸收峰,每个吸收峰代表一种蛋白,说明分离出7种蛋白,对7种蛋白的收集管分别测定酶活,结果可知,仅有37号~56号管的收集液中有SOX活性。

图11 硫酸铵沉淀后肌氨酸氧化酶经Sephadex G-75凝胶过滤层析结果Fig.11 Sephadex G-75 gel filtration chromatography results of sarcosine oxidase after ammonium sulfate precipitation
2.3.3 SDS-PAGE电泳
纯化后的肌氨酸氧化酶的SDS-PAGE凝胶电泳结果见图12。由图12可知,所得纯化SOX显示为一个单一的条带,通过与标准蛋白的比较计算,表示得到了芽孢杆菌LYH18所产电泳纯、分子质量为43 kDa的肌氨酸氧化酶。
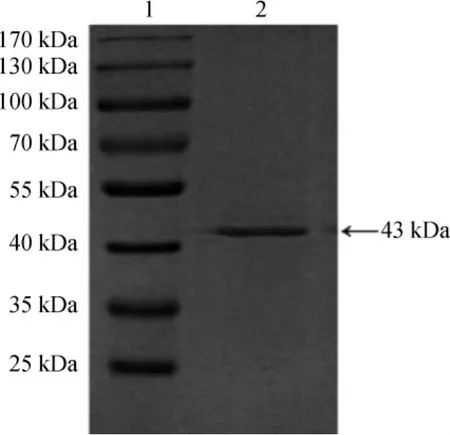
图12 纯化后肌氨酸氧化酶的SDS-PAGE电泳图Fig.12 SDS-PAGE electrophoretogram of purified sarcosine oxidase
3 结论
本实验选择的海洋来源的芽孢杆菌(Bacillussp.)LYH18为革兰氏阳性菌,无致病性,通过对其发酵培养基和发酵条件的单因素优化实验,结果表明,其最适产酶发酵培养基配方为:肌酸添加量1.0%,酵母膏添加量0.8%,MgSO4·7H2O添加量0.05%,KH2PO4添加量0.2%,K2HPO4添加量0.05%,初始pH7.0。最佳发酵条件为:培养温度25℃,通气量40mL/100mL。通过硫酸铵分级沉淀、Sephadex G-75凝胶过滤层析从粗酶液中纯化出电泳纯的肌氨酸氧化酶,纯化后酶活为4.45 U/mL,纯化倍数为2.66倍。SDS-PAGE结果显示,肌氨酸氧化酶的分子质量为43 kDa,为以芽孢杆菌作为“细胞工厂”工业化生产肌氨酸氧化酶及肌酐试剂盒的研究奠定了理论基础。
