基于G-四链体-氯化血红素DNA酶比色法测定银离子和汞离子传感器的构筑
2019-07-27肖志友司恒丹邓兰清居荣梅刘益飞
肖志友,司恒丹,邓兰清,龙 丽,居荣梅,张 鑫,刘益飞
(贵州理工学院 化学工程学院,贵州 贵阳 550003)
银离子在制药、化工、制镜、电子工业中有较多应用[1],其对人体的潜在危害逐渐受到人们的重视,如导致人体巯基酶失活,引起肝肾损害,结合代谢分子中氨基、羰基等[2-6]。汞离子是公认的高毒性重金属离子,其通过火电厂煤燃烧、金矿开采、化石燃料燃烧、固体废弃物焚烧等途径进入人类生存的环境中,并能在人体细胞中累积,从而对人体心脏、肾脏、免疫系统、中枢神经系统等产生损害[5,7-9]。因此,建立简单、灵敏、高选择性测定银离子和汞离子的方法具有重要意义。
G-四链体-氯化血红素DNA酶是一种由富含鸟嘌呤碱基G的DNA序列与氯化血红素(Hemin)结合而形成的具有类似过氧化物酶活性的人工模拟酶[10],该DNA酶能高效催化H2O2氧化反应底物(如2,2′-联氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐,ABTS)产生明显的颜色变化,利用金属离子能促进或阻碍G-四链体-Hemin DNA酶的形成,导致溶液颜色发生改变。相关比色法测定金属离子的传感器已有很多报道,在银离子传感器方面,Li和Kong等[11- 12]利用Ag+通过C-Ag+-C配位键促进G-四链体-Hemin DNA酶的形成建立了比色法测定银离子的传感器,Zhou等[13]利用Ag+与鸟嘌呤碱基G结合阻碍G-四链体-Hemin DNA酶的形成构筑了比色法测定银离子的传感器;在汞离子传感器方面,Lu和Kong等[14-16]利用Hg2+形成T- Hg2+-T配位键抑制或促进该DNA酶的形成,从而建立了比色法定量检测汞离子的传感器。上述传感器虽具有较好的灵敏度和选择性,但仅限于单独测定银离子或汞离子,未见同时对银离子和汞离子产生响应的G-四链体-Hemin DNA酶传感器报道。本研究中,笔者通过选择合适的G-四链体DNA传感序列,利用Ag+和Hg2+阻碍G-四链体-Hemin DNA酶形成,建立了比色法同时测定银离子和汞离子的传感器。
1 实验部分
1.1 仪器与试剂
PE-lambda 35紫外可见分光光度计(珀金埃尔默公司),Chirascan圆二色谱仪(英国应用光物理公司),pHS-3C pH计(上海雷磁仪器厂)。
硝酸银、氯化汞、氯化血红素(Hemin)、硝酸钠、硝酸钾、二甲亚砜(DMSO)(上海国药集团化学试剂有限公司);2,2′-联氮-二(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、磷酸氢二钠、磷酸二氢钠(上海生工生物工程有限公司);30%过氧化氢(成都金山化学试剂有限公司);以上试剂均为分析纯。G-四链体序列(EAD2,5′-CTGGGAGGGAGGGAGGGA-3′)及富含胞嘧啶碱基C的DNA序列购于上海生工生物工程有限公司。
显色工作缓冲液(自制含20.0 mmol/L KNO3、200.0 mmol/L NaNO3、3.0 mmol/L ABTS、20 mmol/L pH 7.5的PBS缓冲溶液);5 mmol/L Hemin储备液用DMSO配制于冰箱-20 ℃保存,使用时用DMSO进一步稀释为Hemin工作液;实验用水均为二次蒸馏水。
1.2 紫外可见吸收光谱及吸光度的测定
室温25 ℃下,在总体积为50.0 μL pH 7.5的20 mmol/L PBS缓冲溶液(含20.0 mmol/L KNO3、100.0 nmol/L EAD2、200.0 mmol/L NaNO3)中,加入不同浓度Ag+保留30 min后,加入100.0 nmol/L Hemin保留25 min。取前述混合溶液5.0 μL于500 μL离心管中,加入490.0 μL显色工作缓冲液、5.0 μL 30 mmol/L H2O2溶液,摇匀,显色25 min。采用PE-lambda 35紫外可见分光光度计扫描溶液在390~450 nm波长范围内的紫外可见吸收光谱,或测其在422 nm波长处的吸光度(A)。
1.3 圆二色光谱的测定
在体积为1 000 μL pH 7.5的20 mmol/L PBS(含20 mmol/L KAc、200 mmol/L NaAc)缓冲溶液中,第1组样品加入3 μmol/L EAD2保留30 min,第2组样品加入3 μmol/L EAD2及52 μmol/L Ag+或Hg2+保留30 min,第3组样品在第1组和第2组样品基础上分别加入6 μmol/L Hemin保留25 min。所有样品溶液使用光径为1.0 mm的石英样品池在Chirascan圆二色谱仪上进行测定。测定参数:扫描速率100 nm/min,带宽1.0 nm,响应时间0.5 s,步长1 nm,扫描次数3次。
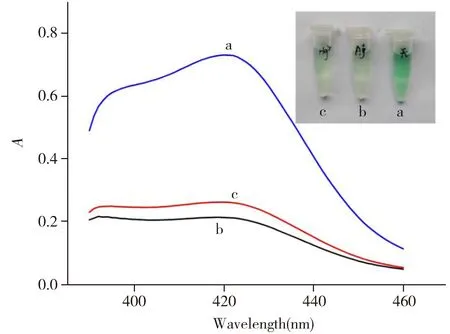
图1 G-四链体DNA酶显色溶液不含银离子与汞离子(a)以及含1 000.0 nmol/L银离子(b)、1 000.0 nmol/L汞离子(c)的紫外可见吸收光谱和颜色变化Fig.1 UV-Vis absorption spectra and color change of the chromogenic solution of G-quadruplex-hemin DNAzymes in the absence of silver ion and mercury ion(a) ,and in the presence of 1 000.0 nmol/L silver ion(b) and 1 000.0 nmol/L mercury ion(c)
2 结果与讨论
2.1 实验的可行性分析
从文献报道[17]的G-四链体DNA序列中,本文选择具有较高过氧化物酶活性的G-四链体DNA序列(EAD2,5′-CTGGGAGGGAGGGAGGGA-3′)作为识别银离子和汞离子的传感器序列。为了检验该方法的可行性,实验对G-四链体DNA酶显色溶液加入金属离子前后颜色的变化及扫描的紫外可见吸收光谱进行了比较。图1a为加金属离子前显色溶液的紫外可见吸收光谱,可观察到在422 nm处有1个很强的吸收峰,对应溶液为绿色;而图1b、c分别为加入1 000.0 nmol/L银、汞离子后显色溶液的紫外可见吸收光谱,可观察到422 nm处吸收峰的强度均明显降低,且溶液基本变为无色,说明该方法可用于比色法测定银、汞离子。
为了进一步考察G-四链体DNA测定金属离子的作用机理,采用圆二色谱对有无金属离子的EAD2溶液进行了研究。如图2所示,无金属离子的G-四链体溶液在263 nm处有1个明显的正圆二色峰,这是形成平行G-四链体结构的典型特征[18-19]。当溶液中加入银离子后(图2A),260 nm处的色谱峰明显减弱,表明银离子可能与鸟嘌呤碱基G螯合而阻碍了G-四链体结构的形成[13];加入汞离子后(图2B),该色谱峰同样明显减弱,表明汞离子可能通过非T-Hg2+-T配位作用破坏G-四链体结构的形成[19]。存在Hemin溶液的圆二色谱变化类似,说明Hemin对银离子或汞离子与G-四链体相互作用的影响不大。
2.2 实验条件的优化
G-四链体-Hemin DNA酶显色溶液的吸光度受多种因素影响,为了获得加入相同量金属离子产生的最大吸光度变化值ΔA[ΔA=A(无Ag+)-A(有Ag+)],本文对影响显色溶液吸光度的实验条件进行了优化。


图3 溶液pH值对体系吸光度的影响Fig.3 Effect of solution pH value on absorbance of the systeminsert:plot of absorbance of the system with or without Ag+ vs.pH value
2.2.1 溶液pH值的影响由于溶液的pH值会影响G-四链体结构的形成及显色溶液的吸光度大小,本实验对溶液的pH值进行了优化。如图3所示,虽然pH 7.0时G-四链体-Hemin DNA酶显色溶液的吸光度变化值(ΔA)最大,但从插图可以看出,此时加入银离子溶液的吸光度约0.5,溶液仍略显绿色;而当pH为7.5时,存在同样量的银离子,溶液的吸光度约为0.2,接近无色。因此,本实验选择pH 7.5为缓冲溶液的最佳pH值。
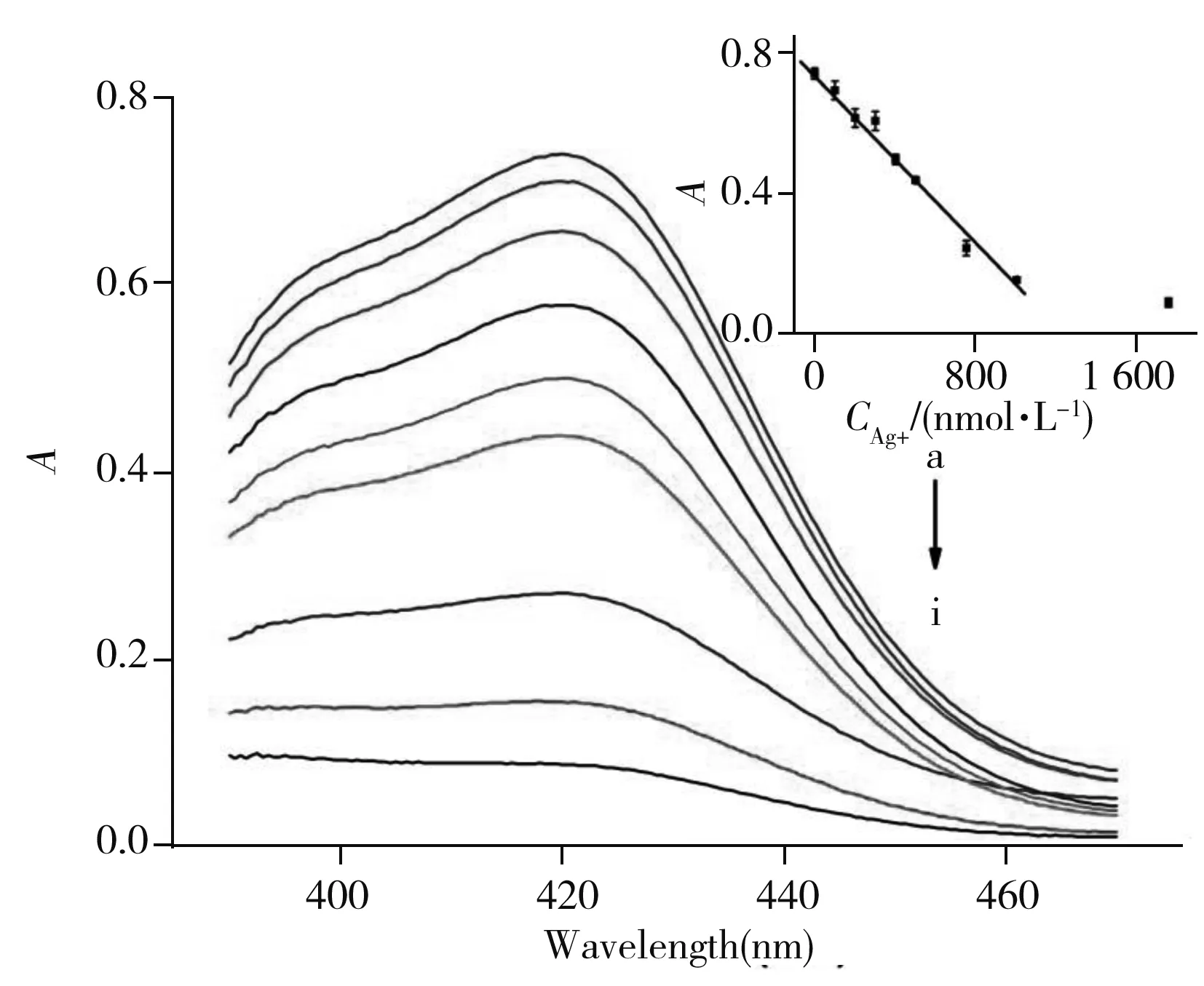
图4 不同浓度Ag+存在下显色溶液的紫外可见吸收光谱Fig.4 UV-Vis absorption spectra of the color solution in the presence of different concentrations of Ag+concentration of Ag+(a-i):0.0,100.0,200.0,300.0,400.0,500.0,750.0,1 000.0,1 750.0 nmol/L;insert:the plot of the assay
2.2.2 保留时间的影响金属离子与G-四链体DNA作用时间的长短会影响DNA酶的形成,从而影响显色溶液吸光度的大小,因此,实验对加银离子混合后的保留时间进行了优化。结果显示,加Ag+后保留时间大于30 min时,体系的吸光度变化值ΔA不再增加。因此,本实验选择30 min作为金属离子与G-四链体DNA的最佳保留时间。
2.2.3 硝酸钠浓度的影响硝酸钠浓度会影响EAD2折叠为G-四链体结构及DNA酶的形成,从而对显色溶液的吸光度产生影响,本实验对NaNO3浓度进行了优化。结果显示,随着NaNO3浓度的增加,加入相同量Ag+引起的吸光度变化值(ΔA)增加,当浓度达到200.0 mmol/L时,ΔA最大,继续增大NaNO3浓度,ΔA反而降低。因此,本实验选择NaNO3的最佳浓度为200.0 mmol/L。
2.3 线性范围与检出限
在最佳实验条件下,考察了加入不同浓度银离子和汞离子时,显色溶液在422 nm处吸光度的变化(图4)。结果显示,溶液的吸光度值(A)与银离子浓度(C,nmol/L)在100.0 ~1 000.0 nmol/L范围内呈良好线性关系(图4插图),线性方程为:A=- 6.272×10-4C+0.755 3,相关系数(r)为0.991 8,检出限(3δ/Slope)为55.9 nmol/L。同样考察了不同浓度汞离子对溶液在422 nm处吸光度的变化情况。结果显示,溶液的吸光度值与汞离子浓度在80.0~800.0 nmol/L范围内呈良好的线性关系,线性方程为:A=- 5.459×10-4C+0.713 1,相关系数(r)为0.992 6,检出限(3δ/Slope)为64.3 nmol/L。

图5 方法的选择性Fig.5 Selectivity of the assay
2.4 方法的选择性
为了考察该方法的选择性,本实验对1 000.0 nmol/L银离子、汞离子及10 种常见其他金属离子(Ba2+、Pb2+、Mg2+、Mn2+、Co2+、Fe3+、Al3+、Zn2+、Cu2+、Ni2+)与G-四链体DNA作用后的溶液在422 nm的吸光度值进行对比。如图5所示,只有银离子和汞离子存在会导致溶液的吸光度明显降低,其他10种常见金属离子对溶液的吸光度几乎无影响。其中汞离子对银离子的测定干扰可通过加入EDTA消除,而银离子对汞离子的测定干扰可通过加入富含胞嘧啶碱基C的DNA(5′-CCACCACCACACACCACCACC-3′)消除。该方法具有较好的选择性,既可用于银离子的测定也可用于汞离子的测定。
2.5 水样中银离子和汞离子的测定
在最佳实验条件下,采用该方法对贵阳市蔡家关雅河河水中的银离子和汞离子含量进行测定,均未检出,进一步进行不同浓度(200.0、750.0 nmol/L)银离子和汞离子的加标回收实验,测定结果见表1。样品的加标回收率为94.8%~99.7%,相对标准偏差(RSD)为2.9%~5.0%。说明该方法用于银离子和汞离子测定具有较好的精密度和重现性,可用于实际样品的测定。

表1 水样中银离子和汞离子的测定Table 1 Determination of Ag+ and Hg2+ in water samples (n=6)
*no data
3 结 论
本文基于G-四链体(5′-CTGGGAGGGAGGGAGGGA-3′)与氯化血红素(Hemin)结合形成G-四链体-Hemin DNA酶后,能高效催化H2O2氧化反应底物(ABTS)使得溶液由无色变绿色,当溶液中存在Ag+或Hg2+时会阻碍该DNA酶的形成,溶液绿色变浅,从而构筑了比色法测定Ag+和Hg2+的传感器。在最佳实验条件下,溶液的吸光度与Ag+和Hg2+的浓度分别在100.0~1 000.0 nmol/L和80.0~800.0 nmol/L范围内具有良好的线性关系,检出限分别为55.9 nmol/L和64.3 nmol/L。该方法具有较好的选择性,采用该方法对实际样品进行测试,结果令人满意。
