硅烷功能化碳点荧光探针检测槲皮素
2019-07-27杜青青张平平陈月丹
杜青青,张平平,谈 琼,陈月丹
(1.齐鲁医药学院 药学院,山东 淄博 255300;2.山东省高校生物医学工程技术重点实验室,山东 淄博 255300)
槲皮素(Quercetin)是最常见的一种生物活性的类黄酮化合物,广泛存在于水果、蔬菜、茶叶和中草药中。槲皮素具有祛痰、降血压血脂、保护心血管等作用,可用于慢性支气管炎、高血压和冠心病患者的临床辅助治疗。研究发现,槲皮素还具有抗炎、抗氧化、抗菌、抗肿瘤等活性[1]。由于其广泛的药理活性,其常被作为各类中药材的有效成分进行质量控制。因此,探索槲皮素的含量测定方法具有重要意义。目前槲皮素含量检测方法主要有高效液相色谱法(HPLC)[2]、毛细管电泳法(CE)[3]、电化学法(DPSV)[4]、荧光光度法(FS)[5-6]等。其中,基于纳米探针的荧光分析法具有简便、快速、成本低等优点,引起了研究人员的广泛关注,而传统的半导体量子点探针易对生物和环境造成有害影响[7],因此,有必要开发环境友好的荧光材料并建立一种简单、高效、灵敏检测槲皮素的分析方法。
2006年,孙亚平等[8]通过激光烧蚀碳靶,经硝酸氧化和聚乙二醇钝化后,获得荧光纳米颗粒,并首次定义为碳点。碳点粒径一般小于10 nm,是继碳纳米管、石墨烯和纳米金刚石后出现的一种新型碳纳米功能材料[9]。相较于有机染料和传统的半导体量子点,碳点不仅保持了碳基材料无毒、生物相容性好等优势,还具有水溶性优异、光稳定性好、易于功能化、价廉易得等特性[10],在分析检测[11-12]、生物成像[13-14]、药物递送[15]等众多领域均表现出发展潜力。设计得到荧光效率高、功能基团丰富的碳点可为槲皮素检测提供新思路。刘春艳[16]课题组最先利用热解法制备了量子产率47%的硅烷(AEAPMS)功能化碳点,通过包覆二氧化硅可将该非水溶性硅烷碳点转变为水溶性纳米材料,用于细胞成像。该课题组[17]进一步研究硅烷碳点自聚及与有机硅烷共聚,获得了具有光限幅性能的透明荧光凝胶玻璃。研究表明,硅烷碳点可用作检测探针。Chen等[18]分别将多种有机硅烷与水混合,300 ℃水热反应得到硅烷碳点,荧光效率可达42.6%,并成功用于温度探针。Zou等[19]根据刘春艳课题组报道的热解法合成硅烷碳点,研究了pH值、温度、干扰物的影响,首次实现了槲皮素的高灵敏、选择性检测,检出限为79 nmol/L。Song等[20]合成了硅烷碳点印迹荧光纳米颗粒,用于玉米中玉米烯酮的检测,检出限为0.02 mg/ L。
本课题组前期以柠檬酸为碳源,硅烷偶联剂KH792为表面包覆剂,一步水热法制备了硅烷功能化碳点[21]。相较于热解法,所得碳点具有荧光效率高(高达69.2%)、表面功能基团丰富、水溶性好的优势,更有利于水溶液中槲皮素的检测和灵敏度的提高。本工作研究了水热硅烷碳点与槲皮素的相互作用,基于槲皮素对该碳点的荧光猝灭作用,建立了一种碳点纳米荧光探针高灵敏检测槲皮素的新方法,检出限低至3.8 nmol/L,并进行了自来水中槲皮素的加标回收实验,相比于文献进一步提高了方法的灵敏度和实用性。同时,初步探讨了槲皮素对该硅烷碳点的荧光猝灭机制。
1 实验部分
1.1 仪器与试剂
JEM-2100F型透射电子显微镜(日本电子株式会社);IR-21型傅立叶红外光谱仪,UV-2250紫外-可见分光光度计(日本岛津仪器公司);F-380型荧光分光光度计(港东科技有限公司);酸度计(梅特勒-托利多有限公司)。
硅烷偶联剂KH792(东莞市山一塑化有限公司);槲皮素(中国药品生物制品检定所);柠檬酸、磷酸、硼酸、冰醋酸、氢氧化钠(国药集团化学试剂有限公司);实验用水均为超纯水。
槲皮素标准溶液:准确称取0.006 g槲皮素,加入10.0 mL无水乙醇溶解后,转移至50 mL容量瓶中定容至刻度,得到400.0 μmol/L的槲皮素溶液,4 ℃保存待用,使用时逐级稀释;pH 7.0伯瑞坦-罗宾森(BR)缓冲溶液。
1.2 实验方法
1.2.1 碳点的合成碳点制备采用本课题组前期报道的合成方法[21]:称取0.5 g柠檬酸,加入10.0 mL水及10.0 mL硅烷偶联剂KH792,待混合均匀后,将所得溶液转移至反应釜中,电热鼓风干燥箱180 ℃反应12 h,反应结束自然冷却至室温,得到澄清黄棕色液体。利用正已烷萃取3次,得最终碳点流体产物。前期研究发现高浓度碳点出现浓度猝灭效应[20],将所得产物用水稀释400倍后待用。
1.2.2 碳点荧光猝灭检测槲皮素在10 mL比色管中依次加入1.0 mL BR缓冲溶液、1.0 mL SiCDs溶液及不同量槲皮素溶液,用水稀释至刻度并摇匀,静置20 min,设定荧光分光光度计参数λex=360 nm,测定体系450 nm处发射峰的荧光强度,计算荧光强度变化ΔF=F0-F。(F0和F分别表示加入槲皮素前后体系的荧光强度)。
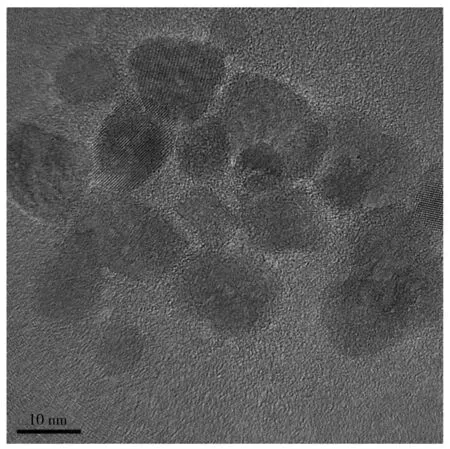
图1 SiCDs的透射电镜图Fig.1 TEM image of SiCDs

图2 SiCDs的红外光谱Fig.2 FTIR spectrum of SiCDs
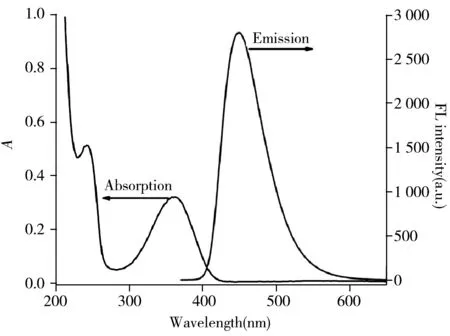
图3 SiCDs的紫外吸收及荧光光谱Fig.3 UV-Vis absorption spectrum and fluorescence emission spectrum of SiCDs
2 结果与讨论
2.1 SiCDs的表征

图4 pH值对作用体系荧光强度的影响Fig.4 Effect of pH value on fluorescence intensity of the system
2.2 槲皮素与SiCDs作用条件的优化
2.2.1 pH值的优化考察了pH值对SiCDs-槲皮素体系荧光强度的影响。如图4所示,在pH 4.0~7.0时,SiCDs自身荧光随pH值的增大而增强,之后趋于稳定。当体系pH 7.0时,ΔF较大,信噪比高,SiCDs与槲皮素在此条件下相互作用较强,且该pH值与生理条件接近,故实验选择pH 7.0为缓冲溶液的最佳pH 值。
2.2.2 槲皮素与SiCDs作用时间的选择考察了pH 7.0时,体系荧光强度随作用时间的变化。实验发现,加入槲皮素5 min后,SiCDs荧光强度降低,20 min后趋于稳定,因此实验选择最佳作用时间为20 min。
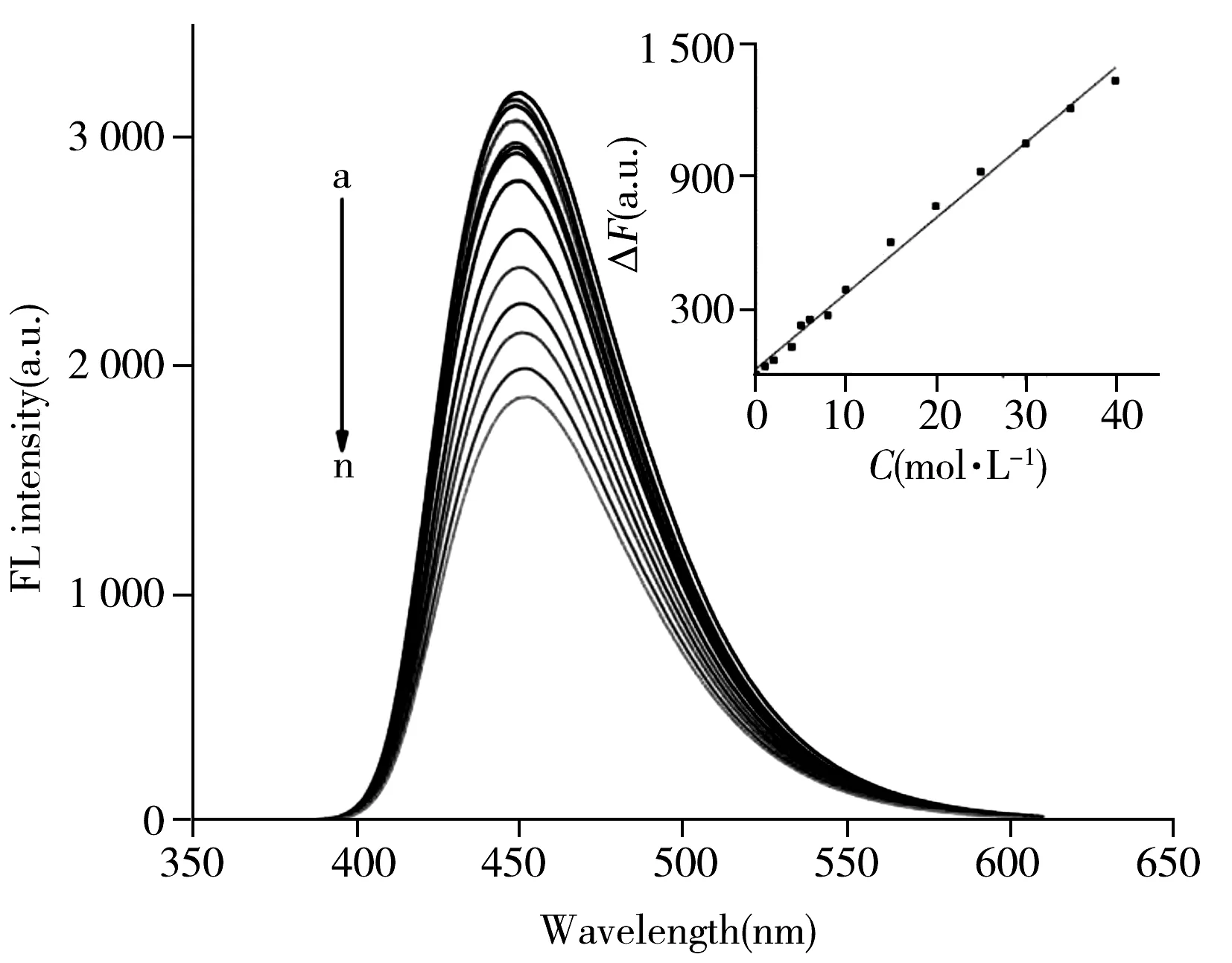
图5 不同浓度槲皮素存在下SiCDs的荧光光谱Fig.5 Fluorescence spectra of SiCDs upon addition of different quercetin concentrationsquercetin concentration(a-n):0,1.0,2.0,4.0,5.0,6.0,8.0,10.0,15.0,20.0,25.0,30.0,35.0,40.0 μmol/L;insert:relationship between fluorescence quenching and quercetin concentration
2.2.3 SiCDs用量的选择考察了SiCDs的不同加入量(0.01、0.1、1.0 mL)对SiCDs-槲皮素体系的影响。结果显示,体系中加入1.0 mL SiCDs时,体系的响应灵敏度最高,因此实验选择SiCDs的最佳用量为1.0 mL。
2.3 槲皮素对SiCDs的荧光响应
2.3.1 标准曲线与检出限在上述优化条件下,研究了槲皮素对SiCDs荧光光谱的影响,并建立了SiCDs荧光强度变化与槲皮素浓度的线性响应关系,结果如图5所示。由图5可见,槲皮素对碳点具有荧光猝灭作用,且随着槲皮素浓度的增大,SiCDs的荧光强度逐渐降低。当槲皮素浓度在1.0~40.0 μmol/L时,SiCDs的荧光猝灭值与槲皮素浓度呈良好线性关系(内插图),线性方程为ΔF=34.418C+24.732(ΔF=F0-F,C为槲皮素的浓度,单位为μmol/L),相关系数r=0.996 7。该方法的检出限(3.3δ/K)为3.8 nmol/L。对25.0 μmol/L槲皮素与SiCDs作用体系进行6次平行测定,所得荧光强度的相对标准偏差(RSD)为1.8%。说明该方法具有较高的灵敏度和精密度,可满足微量分析的要求。
2.3.2 干扰实验考察了常见阳离子和常用辅料淀粉的存在对体系测定槲皮素的影响。实验结果显示,在槲皮素浓度为10.0 μmol/L时,可允许共存10倍浓度的淀粉,50倍浓度的Na+,100倍浓度的Ca2+、Zn2+、Mg2+、K+、Al3+,表明该方法具有较好的选择性。
2.3.3 实际样品的分析为了进一步考察所建立方法的实用性,将该方法用于自来水中槲皮素的测定,并考察了3种不同加标浓度(5.0、10.0、20.0 μmol/L)的回收实验,测得方法的加标回收率为91.5%~92.0%,相对标准偏差(RSD)为0.30%。测定结果表明该方法的RSD和加标回收率均在可以接受的范围内,可用于实际样品的分析。
2.3.4 不同槲皮素检测方法的比较将本方法与文献报道用于检测槲皮素的方法进行比较,结果如表1所示。本方法具有较宽的线性范围和很高的检测灵敏度。
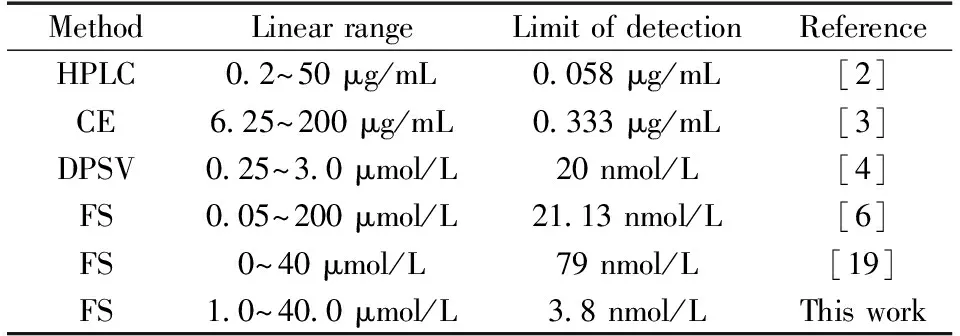
表1 不同槲皮素检测方法的比较Table 1 Comparison of different methods for determination of quercetin
2.4 荧光猝灭机制
为了研究槲皮素对SiCDs的荧光猝灭机制,本实验考察了作用前后紫外吸收光谱的变化。如图6所示,SiCDs在240 nm和360 nm处存在2个特征吸收峰,槲皮素在380 nm处存在特征吸收峰。二者相互作用后,在320 nm左右出现了新的吸收峰,该吸收峰既非SiCDs吸收峰,也不归属于槲皮素吸收峰。分析二者的结构、紫外光谱和碳点红外光谱可知,由于溶剂水的存在,SiCDs在形成过程中除了柠檬酸的羧基与硅烷氨基发生酰胺化反应外,硅烷部分水解,使SiCDs表面修饰了以—NH2为端基的长链基团。由于槲皮素属于弱酸,含有丰富的酚羟基,二者通过静电作用,形成了新的共轭结构,从而导致了吸收光谱的变化和SiCDs的荧光猝灭。而—NH2的存在有利于增强相互作用,进而显著提高了检测灵敏度。根据实验结果初步判断作用机制属于静态猝灭。
为进一步确证猝灭机制,研究了不同温度下槲皮素对SiCDs的荧光猝灭作用。依据Stern-Volmer方程F0/F=1+KSVC处理数据,F0和F分别为碳点与槲皮素作用前后的荧光强度,KSV为猝灭常数,C为槲皮素浓度。图7为分别在25 ℃和45 ℃条件下所得SiCDs荧光强度与槲皮素浓度的关系曲线,均呈现良好的线性关系,相关系数r分别为0.996 9和0.992 0,猝灭常数分别为0.017 8和0.016 1,说明本实验体系只存在1种猝灭方式,且当温度升高时,猝灭常数减小。综上,判断槲皮素对SiCDs的猝灭机制主要为静态猝灭。

图6 SiCDs、槲皮素、碳点-槲皮素的紫外吸收光谱Fig.6 UV-Vis absorption spectra of SiCDs,quercetin and SiCDs-quercetin solution
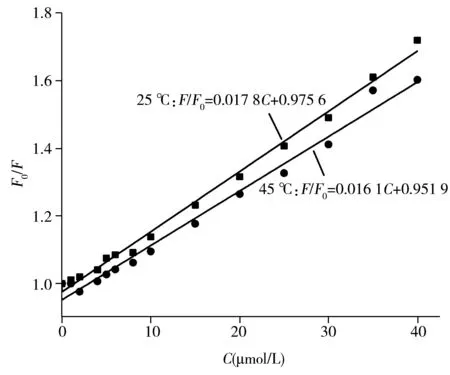
图7 不同温度下槲皮素对SiCDs的猝灭效应Fig.7 Quenching effect of quercetin on SiCDs at different temperatures
3 结 论
本文合成了具有丰富表面基团的水溶性SiCDs,并以SiCDs为荧光探针建立了槲皮素的荧光分析方法,基于作用体系结构和作用效应分析,阐释了荧光猝灭机制为槲皮素酚羟基与SiCDs表面碱性基团静电作用导致静态猝灭。在优化实验条件下,槲皮素浓度在1.0~40.0 μmol/L范围内与SiCDs荧光强度呈良好线性关系。该方法操作简便、灵敏度高,检出限低至3.8 nmol/L,可用于实际样品的检测。
