基于铜掺杂碳纳米点荧光测定炭疽生物标志物
2019-07-27何繁漪杨琼晖朱为梅
华 鹏,黄 玉,周 阳,何繁漪,杨琼晖,朱为梅
(云南省第三人民医院,云南 昆明 650011)
细菌芽孢是产芽孢杆菌在孢内形成的一种休眠体,对环境具有极强耐受性。炭疽芽孢是芽孢杆菌中的一种能致炭疽热的危险病原体,人类可通过食用或者吸入炭疽热芽孢,皮肤接触被感染的动物,或者吸入已被细菌污染的物质而被感染[1-2]。炭疽芽孢杆菌曾作为生化武器严重威胁人类的生命健康,所以准确和灵敏地检测炭疽芽孢对于预防和控制生物攻击及疾病爆发十分重要[3-4]。2,6-吡啶二甲酸(Dipicolinic acid,DPA)是炭疽芽孢中的特有成分,约占芽孢干重的5%~15%,可通过孢子的物理、化学裂解或者萌芽等方式释放。因此,DPA可作为炭疽芽孢杆菌中重要的生物标志物用于炭疽芽孢的检测[5-6]。近年来,炭疽芽孢杆菌的光学测定方法主要是利用镧系金属元素荧光传感对其中的DPA进行检测[7-8],但是,镧系金属元素成本高,当DPA浓度较低时荧光比色不明显。因此,发展低成本且具备高灵敏度、高选择性、低检出限的DPA检测方法仍是研究热点。
荧光碳纳米点(CDs)是一种尺寸小于10 nm,以碳为基本骨架,表面含有大量含氧基团的单分散类球形纳米颗粒[9-10]。与传统有机染料及半导体量子点相比,荧光碳纳米点不仅具有光学性质稳定、易于表面功能化和大规模制备等优势,还具有生物相容性好和细胞毒性低等特性[11-12],在体内外活体生物成像、荧光标记、药物传输、荧光探针等领域有着广泛的应用前景[13-15]。近年来,有大量关于掺杂碳纳米点的合成、性质和应用方面的研究报道,其中,金属掺杂能够在很大程度上改变碳纳米点的电荷密度、光学及物理化学性质,从而拓展其应用范围[16-17]。
本研究以柠檬酸、乙二胺为前体,硫酸铜为金属掺杂剂,采用一步水热法制备了一种稳定的水溶性蓝色发光铜掺杂碳纳米点(Cu-CDs),并基于酸性条件下DPA分子与铜离子产生的强螯合作用,实现了该Cu-CDs对DPA的特异性识别检测。本方法操作简单、灵敏度高、成本低,可用于炭疽生物标志物的测定。
1 实验部分
1.1 仪器与试剂
G9800A荧光分光光度计(美国安捷伦公司),Tecnai G2TF30场发射透射电子显微镜(荷兰FEI公司),X-射线光电子能谱仪(XPS,赛默飞世尔科技公司),TENSOR27型傅立叶红外光谱分析仪(德国Bruker公司),UV-2600紫外-可见分光光度计(日本岛津公司),Scilogex-MX-S漩涡混匀仪(北京开源国创科技有限公司),120 mL聚四氟乙烯(Polytetrafluoroethylene,PTFE)内衬水热反应釜(巩义市予华仪器有限责任公司),电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
2,6-吡啶二甲酸标准品(DPA,纯度>99%)购于Sigma-Aldrich(上海)有限公司;苯甲酸、邻苯二甲酸等有机小分子物质以及六水合三氯化铁(FeCl3·6H2O)等无机盐干扰物均购自上海阿拉丁试剂有限公司;乙二胺、柠檬酸和磷酸氢二钠(Na2HPO4)等试剂购于国药集团化学试剂有限公司。所用化学药品及试剂均为分析纯,实验用水为超纯水。
1.2 实验方法
1.2.1 铜掺杂碳纳米点(Cu-CDs)的制备准确称取3.0 g柠檬酸和2.0 g 硫酸铜溶解于97 mL的超纯水中,超声10 min形成浅蓝色溶液,再加入3 mL乙二胺搅拌均匀,将溶液转移至聚四氟乙烯内衬水热反应釜中,于180 ℃下恒温加热5 h,反应完成后自然冷却至室温,得到褐色溶液。将所得溶液过0.22 μm滤膜以除去大颗粒杂质,然后用截留分子量为3 500 D的透析袋透析处理24 h,得到水溶性铜掺杂碳纳米点(Cu-CDs),并储存于4 ℃下备用。
1.2.2 量子产率的测定将碳纳米点配制成溶液后,测试其紫外-可见吸收光谱及荧光光谱(λex=350 nm)。将荧光强度值I及相应的吸光度A(λem=440 nm)代入公式Φx=ΦR(nx/nR)2(AR/Ax)(Ix/IR)。式中,x为测试样品,R为标准物质;Φ表示荧光量子效率,n表示溶剂的折光率。实验中以硫酸奎宁(荧光量子效率为54%)作为标准物[18]。
1.2.3 测定方法称取适量DPA,用超纯水溶解,配制成不同浓度系列的DPA溶液。将上述制备好的Cu-CDs稀释至2 mg/L,取Cu-CDs稀释液1 mL于5 mL离心管中,加入不同浓度的DPA储备液100 μL,用pH 6.0的磷酸氢二钠-柠檬酸缓冲液(50 mmol/L)定容至3 mL,涡旋混匀,静置2 min,于激发波长λex=348 nm,发射波长λem=442 nm处测定荧光强度IF和试剂空白溶液荧光强度IF0。
2 结果与讨论
2.1 碳量子点的合成与表征
本实验以硫酸铜作为铜掺杂的反应前体,经一步水热法制备了高荧光量子产率的水溶性Cu-CDs。图1A为Cu-CDs的透射电镜图(TEM),从图中可以看出,所制备的碳纳米点呈类球形结构,分散性好,粒径均匀,平均尺寸2~3 nm左右。

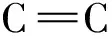


2.2 测定原理
如图3所示,由于Cu-CDs中含有大量的铜掺杂离子,而DPA分子的羧基和吡啶氮是结合铜离子的作用位点,在酸性条件下,该作用位点能与铜离子产生较强的螯合作用。因此,在酸性体系中,当在Cu-CDs溶液中加入DPA之后,Cu-CDs能与DPA分子迅速反应,DPA分子通过与铜离子之间的螯合作用稳定地结合在Cu-CDs表面上。这一螯合体系增强了Cu-CDs的π-π*共轭吸收,同时改变了荧光产生过程中的能级跃迁,在相同的激发波长下,体系荧光发射波长出现红移,因此,随着DPA浓度增大,荧光红移现象逐渐明显,Cu-CDs的蓝色荧光将逐渐减弱[19]。
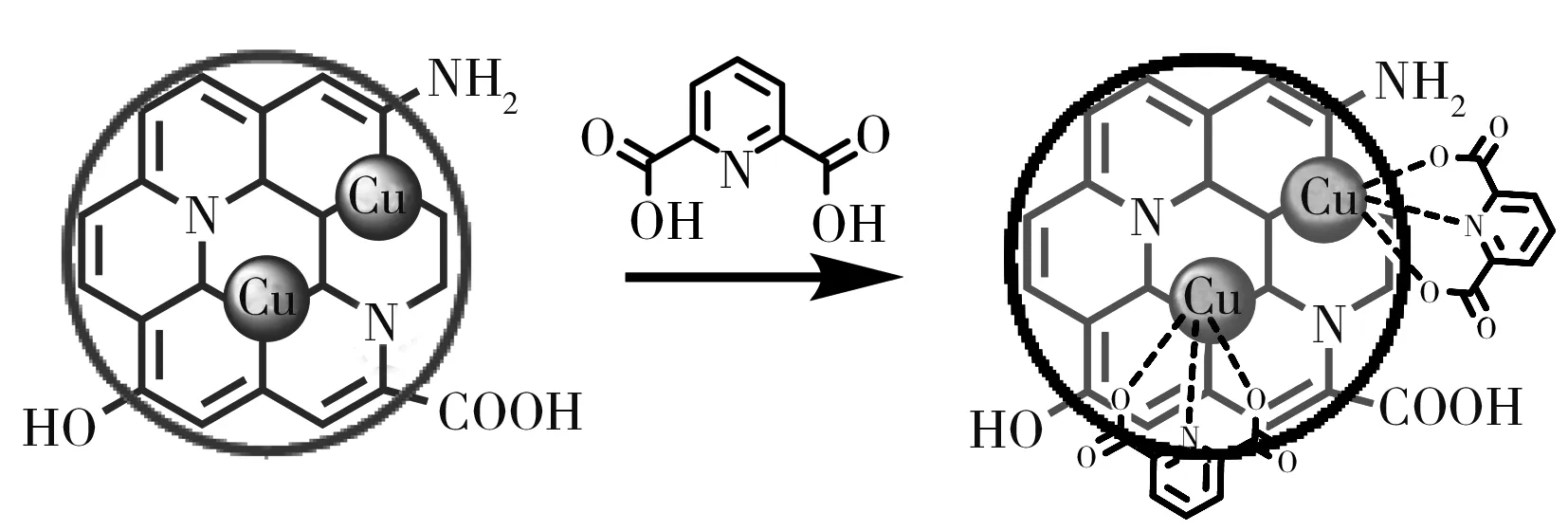
图3 铜掺杂碳纳米点检测DPA的原理示意图Fig.3 Schematic illustration of the Cu-CDs for DPA detection


图4 体系的选择性实验Fig.4 Selectivity of fluorescence system1-15:0.15 μmol/L DPA;6 μmol/L of glucose,vitamin C,citric acid,sucrose,benzoic acid,phthalic acid,isophthalic acid,terephthalic acid,nicotinic acid,phenylalanine,cysteine,tryptophan,serine,the mixture of 0.15 μmol/L DPA with 6 μmol/L of different organic small molecules,respectively
2.3 反应条件的优化
2.3.1 pH值本实验选用50 mmol/L磷酸氢二钠-柠檬酸溶液作为缓冲体系,考察了pH值在2.0~8.0范围内对体系荧光强度的影响。结果发现pH 6.0时对体系荧光强度变化值的影响最大,故本实验选择 pH 6.0为最佳反应pH值。
2.3.2 反应时间研究了反应时间对荧光猝灭体系的影响。连续测定10 min,每隔1 min测定一次体系荧光强度变化值。结果显示,体系荧光强度变化值在1~3 min内逐渐增加,随后趋于稳定,故选择3 min为最佳反应时间。
2.4 体系对DPA的选择性

2.5 体系对DPA的响应
在优化实验条件下,考察了Cu-CDs荧光猝灭程度与DPA浓度之间的关系。由图5A可以看出,随着DPA浓度的增加,Cu-CDs的荧光强度逐渐减弱且光谱逐渐向绿色波长移动。DPA浓度(c)分别在5~100 nmol/L和150~400 nmol/L范围内与Cu-CDs荧光猝灭率(IF0-IF)/IF0(y)呈线性关系,线性回归方程分别为y=0.005 5c+0.001 6和y=0.000 5c+0.572 3,相关系数分别为r2=0.994 1和r2=0.997 6,检出限达2.3 nmol/L(S/N=3)。如图5B所示,当向Cu-CDs溶液中加入不同浓度的DPA时,随着DPA浓度的增加,溶液在365 nm紫外灯下的颜色逐渐由蓝色变为绿色,故该探针可进行比率测定。

2.6 实际样品测定
选取河水、自来水、牛奶以及小牛血清为分析对象,水样先用0.22 μm滤膜过滤,再在15 000 r/min下离心10 min除去悬浮的大颗粒杂质;牛奶经蛋白质等电点沉淀法除去蛋白,取上清液过0.22 μm滤膜;10%的小牛血清无需处理。每个样品平行测定5次,结果如表1所示,其加标回收率为95.2%~105%,RSD为1.3%~3.8%。
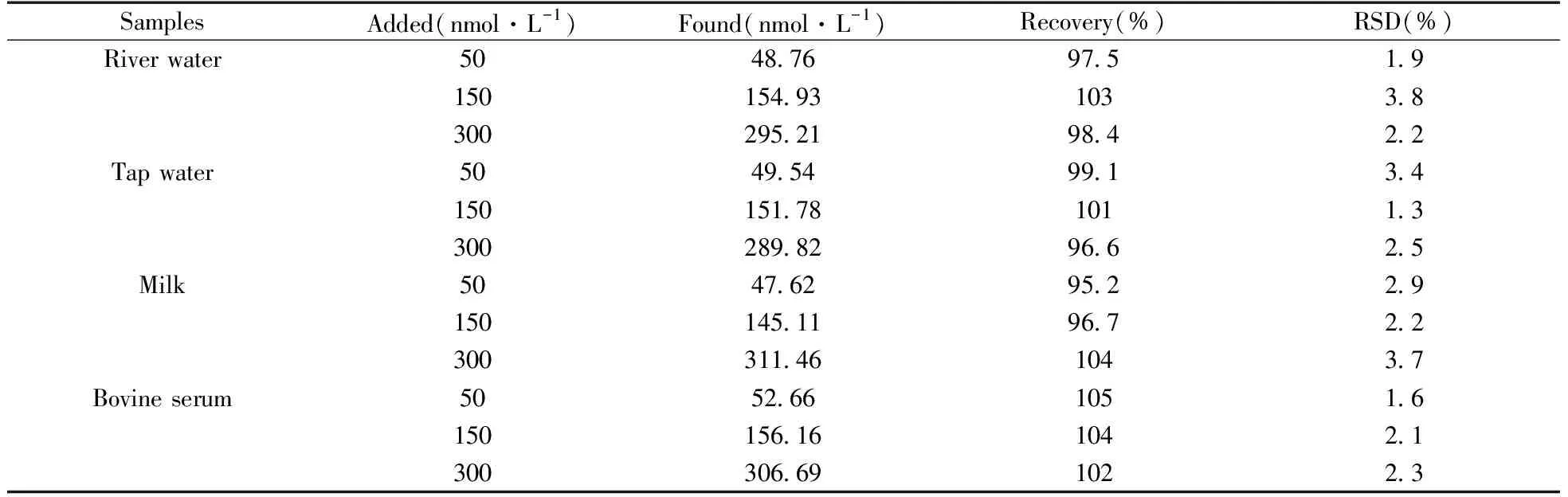
表1 实际样品中DPA含量的测定结果(n=5)Table 1 Analytical results for DPA in real samples by the proposed method(n=5)
3 结 论
本研究制备了一种高稳定性、高荧光量子产率的水溶性铜掺杂碳纳米点(Cu-CDs),基于炭疽芽孢生物标志物2,6-吡啶二甲酸(DPA)与碳纳米点中Cu2+的强螯合作用对Cu-CDs的蓝色荧光猝灭及荧光颜色变化,建立了铜掺杂碳纳米点比率测定炭疽生物标志物的新方法。在最优条件下,方法的检出限达到2.3 nmol/L。该分析方法专属性强、灵敏度高、操作简便,成本较低,具有良好的应用前景。
