表面活性剂与叶酸的相互作用及其对光氧化降解的影响
2019-07-26罗思琪王美娜赵微微王毅琳
罗思琪,王美娜,赵微微,王毅琳,*
1中国科学院化学研究所,胶体界面与化学热力学实验室,北京 1001902中国科学院大学,北京 100049
1 引言
叶酸是一种由喋呤啶、对氨基苯甲酸和谷氨酸组成的水溶性B族维生素,具有许多独特的性质与功能。叶酸参与人体的多项生理活动,包括嘌呤和胸腺嘧啶的合成,DNA和RNA的进一步合成及氨基酸的代谢等。叶酸是一种人体的重要营养物质,孕妇缺乏叶酸会导致胎儿神经管发育不良等多种缺陷1,2。其次,叶酸也可用作抗肿瘤药物靶向释放的受体3-6。此外,叶酸特殊的分子结构使其具有很强的分子间氢键作用、π-π相互作用,并且可以提供静电相互作用的位点,因而其在一定条件下可以自组装形成液晶、凝胶等有序结构,可用于构筑功能材料7-10。
然而,叶酸对光的不稳定性限制了其实际应用。很多文献报道了叶酸的降解条件及其机理11-13,研究表明,叶酸发生的光氧化降解过程分为两个阶段,其中喋呤啶6位的甲酰基氧化成羧酸基团是降解过程的决速步骤。与此同时,人们也通过各种手段来提高叶酸的稳定性。蛋白质是一种能够有效提高叶酸稳定性的物质。Vorobey等14发现人血清蛋白可以代替叶酸被氧化降解,从而降低叶酸的降解速率。Liang和Subirade15证明b-LG复合物也可以作为载体来保护叶酸。许多研究也证实很多蛋白质都能够提高叶酸的稳定性16,17。此外,聚合物胶囊也可以用来提高叶酸的稳定性18。这些物质的共同特点是都能为叶酸提供疏水空间而将叶酸包裹在其中,使叶酸免于暴露在空气中,从而提高叶酸的光稳定性。
表面活性剂胶束已广泛应用于医药制剂中,用以提高有机小分子药物的溶解度、稳定性和生物相容性以及控制药物释放等19-22。被普遍接受的认识是表面活性剂的疏水微区能将不稳定小分子包裹,使其与外界环境隔绝从而提高其稳定性。Treger等23发现阴离子表面活性剂十二烷基硫酸钠(SDS)能高效抑制聚对苯乙烯撑膜(PPV)的光氧化降解,其主要原因是疏水性的提高能够抑制氧气及其他气体的渗入。同样,Carlotti等24发现当淬灭剂Trolox被包裹在胶束的疏水微区时,其光稳定性得以明显提高。我们课题组以及其他一些课题组的工作表明,表面活性剂胶束的疏水微区能让姜黄素与外界碱性环境隔离,从而抑制姜黄素的降解25-27。
表面活性剂与有机小分子的相互作用已经被广泛地研究,有机小分子的加入不仅能够屏蔽表面活性剂极性头基之间的静电排斥,还可以与表面活性剂的烷基链发生疏水相互作用,使得表面活性剂具有更低的临界胶束浓度(CMC)和更高的表面活性,同时可以有效地诱导表面活性剂聚集体的形成和转变28-34。表面活性剂与有机小分子的相互作用与表面活性剂的分子结构有关,表面活性剂极性头基的数目和带电情况以及疏水链的数目都会影响它们之间的相互作用强度。Gemini和寡聚表面活性剂比单链表面活性剂具有更多的静电结合位点和疏水链,通常具有更低的CMC和形成大聚集体的能力,因此在一定条件下能够更好地增溶与包裹有机小分子35-38。由此推测,叶酸与不同电性和寡聚度的表面活性剂的相互作用可能存在较大的差异。
基于上述原因,在本工作中,我们利用表面张力、紫外可见吸收光谱、荧光光谱、等温滴定量热、动态光散射以及核磁共振技术对比研究了四种不同的表面活性剂与叶酸的相互作用,这四种表面活性剂包括十二烷基硫酸钠(SDS),十二烷基三甲基溴化铵(DTAB),连接基团为6个亚甲基的季铵盐型Gemini表面活性剂(12-6-12)以及线性季铵盐三聚表面活性剂(12-3-12-3-12)。叶酸与四种表面活性剂的结构式如图1所示。本文旨在揭示叶酸对表面活性剂的表面活性和聚集行为的影响以及表面活性剂对叶酸光稳定性的影响,以期寻找到能够更加高效增溶和稳定叶酸的表面活性剂体系。
2 实验部分
2.1 试剂与样品制备
十二烷基硫酸钠(SDS),纯度为99.9%,十二烷基三甲基溴化铵(DTAB),纯度为99.9%,和叶酸,纯度为99%,购自Sigma公司。Gemini表面活性剂12-6-12和线性三聚表面活性剂12-3-12-3-12的合成和纯化方法见参考文献35,37。最终产物通过质谱,核磁和元素分析检测。实验用水均为去离子水。所有实验均在pH = 7.0 时进行。所有实验溶液均是由包裹着锡纸的棕色瓶新鲜配置。所有的实验均在暗光条件下进行。
2.2 测试与表征
表面张力实验:本实验采用德国Dataphysics Instruments GmbH公司的DCAT11表面张力仪完成,使用19.90 mm × 0.20 mm的铂铱合金吊片测定单一表面活性剂以及表面活性剂/叶酸混合体系的表面张力。温度控制在(25.00 ± 0.05) °C。每条表面张力曲线至少重复两遍。测量误差为0.2 mN·m-1。
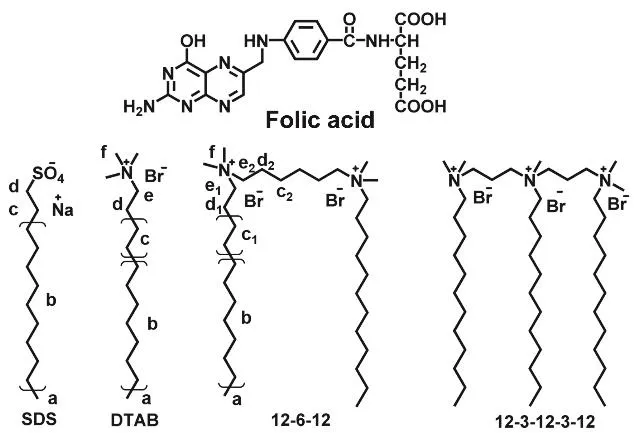
图1 叶酸与4种表面活性剂(SDS、DTAB、12-6-12和12-3-12-3-12)的化学结构式Fig. 1 Chemical structures of folic acid and four surfactants (SDS, DTAB, 12-6-12 and 12-3-12-3-12).
紫外-可见光吸收实验:紫外-可见光吸收光谱使用日本岛津型号为SHIMADZU UV1601PC分光光度计测定。光谱实验均在(25 ± 2) °C,光程为1 mm的石英池中完成。以280 nm处的吸光度作为特征吸收值。
荧光光谱实验:荧光光谱使用日本日立型号为Hitachi F-4500的荧光光谱仪测定。激发波长为350 nm,发射波长测量范围为390到600 nm。激发与发射波长的狭缝宽均为10 nm。荧光光谱实验均在(25 ± 2) °C下进行。
辐射降解实验:样品用10 mm的石英池装着放在辐射光源为波长为365 nm的紫外灯下照射,每20 min用荧光光谱实验来确定降解的浓度,直到荧光强度不再变化,即达到饱和照射时间。辐射降解实验在(25.0 ± 0.1) °C的恒温箱里进行。
动态光散射实验(DLS):动态光散射所用仪器为配备有ALV-5000数字式时间相关器的ALV/SP-125激光光散射仪,采用的入射光源为氦氖激光,功率为22 mW,波长为632.8 nm,散射角为90°,所有样品均经过孔径为0.45 μm的滤膜过滤。光散射数据的相关函数通过Contin法分析处理后得到粒子扩散系数(D)的分布。对于球形粒子,其表观水合半径(Rh)通过Stokes-Einstein方程,Rh= kBT/(6πηD)换算得到,其中kB为玻尔兹曼常数,T为绝对温度,η为溶剂的粘度。实验温度为(25.0 ±0.1) °C。
等温滴定量热实验(ITC):采用了等温滴定微量量热计TAM (2277-201Thermometric AB,Järfälla,Sweden)来研究叶酸与四种表面活性剂的相互作用过程。样品池中初始放置600 μL的表面活性剂溶液,通过Thermometric 612 Lund泵控制的500 μL Hamilton注射器将0.5 mmol·L-1的叶酸溶液或去离子水加到样品池中。相互作用过程中保持90 r·min-1的搅拌速率。滴定的最终结果中扣除了水滴定到相同浓度的表面活性剂溶液中的观察焓变。因此得到的焓变曲线反应了叶酸与表面活性剂的相互作用。所有实验至少重复两次,其误差低于±4%。实验温度为(25.00 ± 0.01) °C。
核磁共振实验:NOESY采用Bruker AV400FTNMR谱仪在600 MHz完成,实验操作及数据处理利用TOPSPIN(Bruker,version 2.1)工作站完成,所有NMR实验都在(25 ± 2) °C下进行(利用Bruker,BVT 3200温控单元控制)。配制叶酸/表面活性剂混合溶液所用的氘代水(D2O)的纯度为99.9%。将待测溶液0.6 mL置于5 mm核磁管中进行实验,以HDO质子的化学位移为内标(4.790)得到相应的化学位移。核磁谱数据中每个数据点的数字精度为0.04 Hz。
3 结果与讨论
3.1 SDS、DTAB、12-6-12和12-3-12-3-12与叶酸混合体系的表面张力与紫外光谱
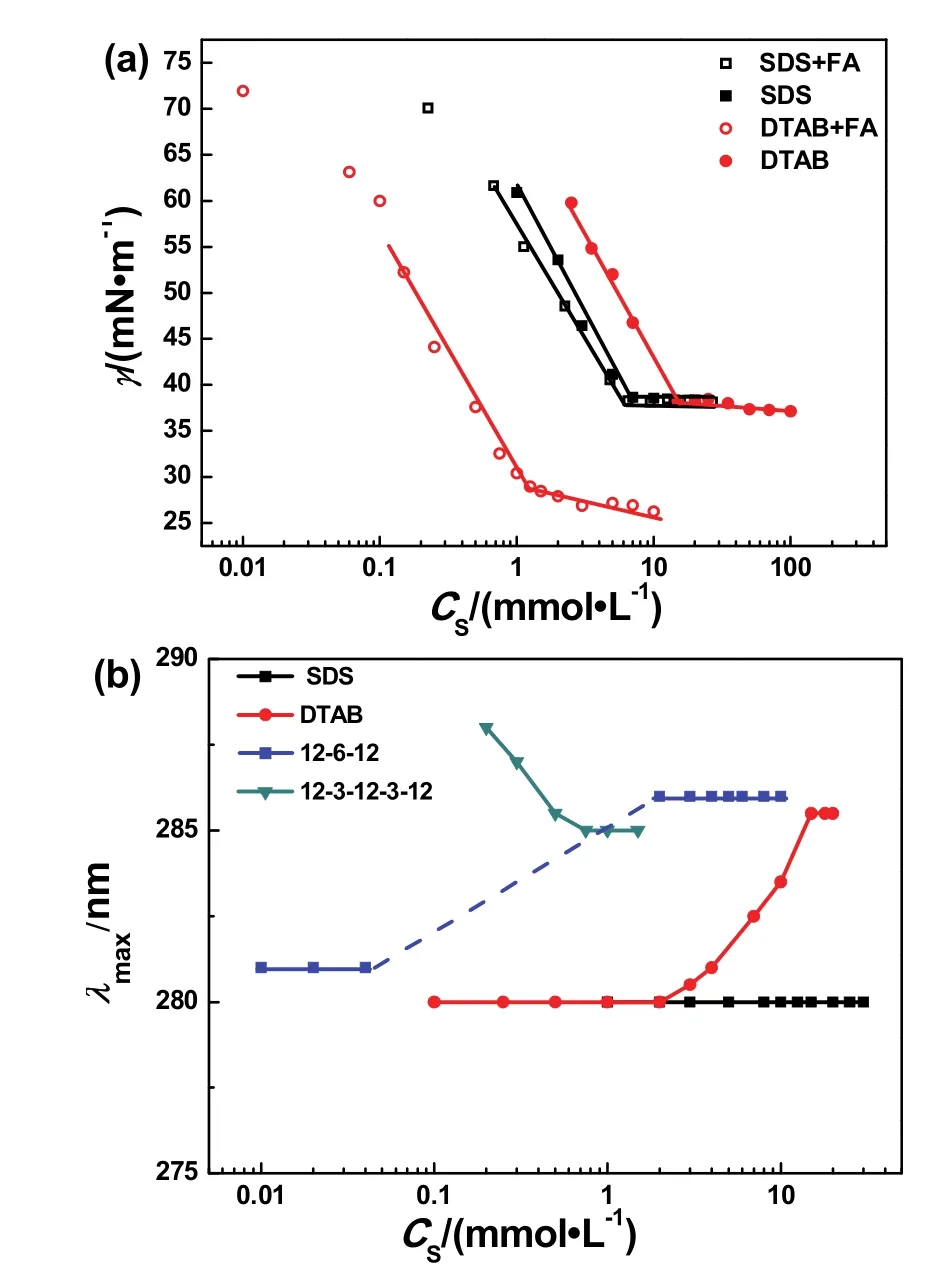
图2 (a) pH 7.0时SDS和DTAB单一组分及与100 μmol·L-1叶酸的混合体系的表面张力随表面活性剂浓度(CS)的变化曲线;(b)叶酸的最大吸收波长(λmax)随表面活性剂浓度的变化曲线Fig.2 (a) Surface tension variations of SDS and DTAB vs the surfactant concentration at pH 7.0 in the presence and absence of 100 μmol·L-1 folic acid. (b) Plots of λmax of folic acid vs the surfactant concentration in the surfactant-folic acid mixture.The dash part of line 12-6-12 in (b) is a region of precipitation, UV absorption spectrum experiments cannot be carried out.
在25.00 °C、pH为7时,表面活性剂本身和在100 μmol·L-1叶酸存在时的表面张力曲线如图2a所示。由于Gemini表面活性剂12-6-12和寡聚表面活性剂12-3-12-3-12静电结合位点多,与叶酸的静电相互作用很强,在低浓度时,表面活性剂的聚集能力不够,叶酸与表面活性剂分子紧密结合形成沉淀,表面张力实验无法进行,只有当它们的浓度高于其CMC时,12-6-12和12-3-12-3-12才能与叶酸形成稳定的溶液,因此,我们无法获得叶酸存在时12-6-12和12-3-12-3-12两个表面活性剂的表面张力曲线。从图2a可以看出,叶酸对SDS和DTAB的CMC和表面张力的影响差异很大。当加入叶酸时,SDS的CMC和CMC时的表面张力(γCMC)几乎保持不变,而DTAB的CMC从15.0 mmol·L-1下降到1.25 mmol·L-1时 , γCMC从 39.5 mN·m-1下 降 到 28.6 mN·m-1,这表明叶酸能够显著提高阳离子表面活性剂DTAB的聚集能力,而对阴离子表面活性剂SDS的聚集能力几乎没有影响。这主要是由表面活性剂的电荷差异造成的,pH为7.0时,叶酸的两个羧酸基团完全去质子化,带负电,因此与DTAB的季铵盐头基之间存在强烈的静电吸引作用,从而可以屏蔽季铵盐头基之间的静电排斥作用,同时,叶酸的喋呤啶部分还与DTAB的疏水链具有较强的疏水相互作用,进一步促进了DTAB的聚集;而SDS和叶酸带有同种电荷,静电相互作用很弱,因而叶酸促进SDS聚集的效果不明显。
图2b表示的是叶酸的最大吸收波长λmax随表面活性剂浓度的变化曲线。叶酸具有两个特征吸收波长,280和350 nm,我们选择280 nm处的吸收波长来研究其随表面活性剂浓度的变化规律。280 nm是喋呤啶和对氨基苯甲酸的特征吸收波长。如图所示,叶酸在SDS存在时,其特征吸收波长不发生变化,这表明叶酸的喋呤啶和对氨基苯甲酸片段所处的微环境没有发生明显变化或叶酸的共轭结构没有变化,而当DTAB、12-6-12和12-3-12-3-12存在时,叶酸的紫外特征吸收波长表现出强烈的对表面活性剂浓度的依赖性。
对于DTAB而言,当其与叶酸作用时,在表面活性剂浓度低于CMC时,叶酸的λmax没有明显变化,表明极少量DTAB的加入对叶酸的分子结构或所处的微观环境没有明显影响;当DTAB浓度大于2.0 mmol·L-1时,叶酸的最大吸收波长λmax开始红移,此浓度大于DTAB与叶酸混合体系的临界聚集浓度,表明只有当表面活性剂分子能够形成聚集体时才会改变叶酸所处的微观环境,此时表面活性剂开始包裹叶酸,该浓度即为表面活性剂开始增溶叶酸的浓度;当浓度大于15.0 mmol·L-1时,λmax红移至285.5 nm,然后λmax不再随表面活性剂浓度的增加发生变化,这意味着二者的相互作用已经达到饱和,叶酸已经被完全包裹在DTAB形成的聚集体中。
对于12-6-12和12-3-12-3-12,在低浓度的某些浓度区间有相分离的产生,因此紫外可见光谱的测量避开了这些发生相分离的浓度区间。当12-6-12浓度低于0.050 mmol·L-1时,叶酸的λmax几乎没有发生变化;当12-6-12的浓度处于0.050和2.0 mmol·L-1之间时,因为沉淀发生,无法测量;当12-6-12的浓度大于2.0 mmol·L-1(此值大于12-6-12自身的CMC)时,叶酸的λmax红移至286 nm,此后一直保持在此值。这个变化规律表明,12-6-12与叶酸的作用与DTAB基本相同,在大于CMC时,12-6-12将叶酸包覆在其聚集体中。对于12-3-12-3-12,叶酸的λmax随表面活性剂浓度的变化规律发生了很大变化:当12-3-12-3-12的浓度低于0.20 mmol·L-1时,由于沉淀发生,无法测量;当12-3-12-3-12的浓度为0.20 mmol·L-1时,叶酸的λmax为287 nm,然后随着12-3-12-3-12浓度的增加,λmax略微蓝移,浓度高于0.75 mmol·L-1时,λmax保持在285 nm。虽然λmax随12-3-12-3-12浓度的增加发生了蓝移,但都大于叶酸自身在水溶液中的λmax值,由于0.20 mmol·L-1大于12-3-12-3-12的CMC39,这表明叶酸包覆于12-3-12-3-12的聚集体中。对于叶酸的最大吸收波长λmax在12-3-12-3-12存在时的特殊变化规律,我们做如下推测:叶酸的最大吸收波长受两个因素影响,一是叶酸所处的微观环境,环境极性的降低有利于λmax红移;二是叶酸分子产生紫外可见吸收的共轭结构,共轭程度降低,会促使λmax蓝移。从分子结构来看,叶酸带2个负电荷,12-3-12-3-12带3个正电荷。叶酸浓度为0.10 mmol·L-1,当12-3-12-3-12浓度为0.20 mmol·L-1、即略高于自身的临界聚集浓度(0.16 mmol·L-1)时,带相反电荷的叶酸与12-3-12-3-12的静电吸引作用很强,同时叶酸的喋嘧啶片段与12-3-12-3-12三条疏水链之间强烈的疏水相互作用会促进烷基链聚集,释放水合水,这一去水合作用又进一步使得带相反电荷的12-3-12-3-12和叶酸混合体系的静电吸引作用加强,这种强烈的静电吸引作用会降低叶酸分子的共轭程度,此时分子结构的改变比微观环境的改变对叶酸最大吸收波长的影响大,因此λmax蓝移。当12-3-12-3-12浓度大于0.75 mmol·L-1时,叶酸与12-3-12-3-12通过静电相互作用的结合已达到饱和,因此λmax随浓度变化而保持不变。而对于DTAB和12-6-12,它们的每一个分子分别带1个和2个正电荷、带1条和2条疏水链,因此,它们与叶酸的静电吸引作用和疏水相互作用都比叶酸与12-3-12-3-12的相互作用弱,进而对叶酸的共轭结构影响较弱,它们对叶酸的最大吸收波长λmax的影响主要来自于形成聚集体之后叶酸所处微环境极性的降低,所以,叶酸的最大吸收波长在DTAB和12-6-12存在时只发生红移。
由以上结果可知,当表面活性剂寡聚度增加时,叶酸的最大吸收波长红移幅度增大,可能的原因是,随着表面活性剂寡聚度的增加,表面活性剂与叶酸的静电吸引作用和疏水相互作用都显著增强,加之,寡聚度的增加,使得表面活性剂自身的聚集能力显著增强,使得叶酸所处的微环境发生了更加显著的变化。进一步的机理研究将在下面的文中阐述。
3.2 SDS、DTAB、12-6-12和12-3-12-3-12与叶酸混合体系的聚集体尺寸
四种表面活性剂在100 μmol·L-1叶酸存在时聚集体的大小随浓度的变化规律如图3所示。SDS在所研究的浓度范围内,始终形成约为2 nm的小聚集体,这表明叶酸的存在不能诱导SDS发生聚集体转变。DTAB在浓度为5.0-7.0 mmol·L-1时形成的是400 nm左右的大聚集体,当浓度大于10.0 mmol·L-1时,聚集体尺寸逐渐变小,浓度为15.0 mmol·L-1时,开始出现小聚集体,之后随着浓度的增加,小聚集体逐渐增加,大聚集体逐渐减少;12-3-12-3-12的聚集体变化规律和DTAB相似,都是在较低浓度时形成大聚集体,在浓度为0.7 mmol·L-1时开始出现小聚集体。DTAB带一个正电荷,12-3-12-3-12带3个正电荷,叶酸带两个负电荷,我们推测,当表面活性剂浓度较低时,表面活性剂分子与叶酸完全结合,表面活性剂极性头基的电荷被中和,头基间的静电排斥减弱,因而极性头基可以紧密排列,此时有利于形成曲率较小、尺寸较大的聚集体;当表面活性剂浓度增加时,叶酸分子的数目不足以与所有的表面活性剂分子结合,表面活性剂分子本身可以自组装形成聚集体。对于DTAB,在浓度远远大于叶酸浓度时,尾链之间的疏水相互作用较12-6-12和12-3-12-3-12弱,而头基之间的静电排斥作用较它们强,因而容易自聚集形成小聚集体;对于12-3-12-3-12,在浓度为0.7 mmol·L-1时,由于叶酸的浓度为0.10 mmol·L-1,因此,与叶酸的电荷计量比为21 : 2,此时12-3-12-3-12与叶酸的静电结合早已达到饱和,由于12-3-12-3-12在浓度刚过CMC时容易形成球形小胶束,所以此时12-3-12-3-12与叶酸混合体系中小聚集体的出现有可能是12-3-12-3-12本身形成的球形胶束。但是,在整个研究范围内12-6-12与叶酸形成的都是100 nm左右的聚集体,借鉴我们课题组之前对于表面活性剂与姜黄素相互作用的研究结果27推测:12-6-12有两个正电荷,而叶酸具有两个负电荷,叶酸分子为了中和更多的电荷以及更好地与12-6-12的疏水链发生疏水相互作用,即更好地插入12-6-12形成的聚集体中,一个叶酸分子有可能分别与两个12-6-12结合,叶酸分子有可能将更多地与12-6-12桥连起来,形成类似于寡聚表面活性剂的复合体,这样12-6-12头基之间的静电排斥能很好地被屏蔽,因而,12-6-12与叶酸形成的都是尺寸较大的聚集体。
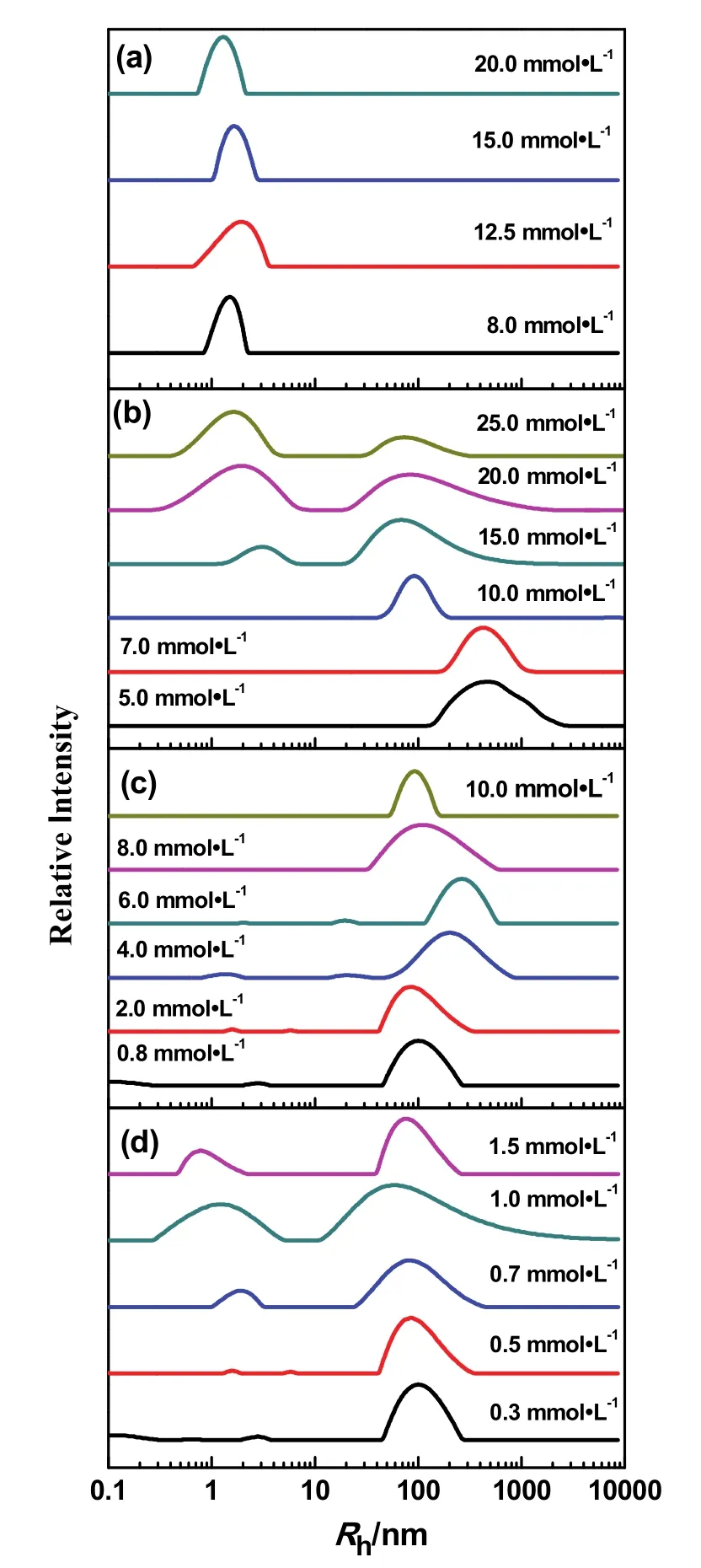
图3 pH 7.0时(a) SDS,(b) DTAB,(c) 12-6-12(d) 12-3-12-3-12在100 μmol·L-1叶酸存在时聚集体尺寸分布随表面活性剂浓度的变化Fig. 3 Size distributions of (a) SDS, (b) DTAB,(c) 12-6-12, (d) 12-3-12-3-12 at different concentration in the presence of 100 μmol·L-1 folic acid at pH 7.0.
3.3 SDS、DTAB、12-6-12和12-3-12-3-12对叶酸稳定性的影响
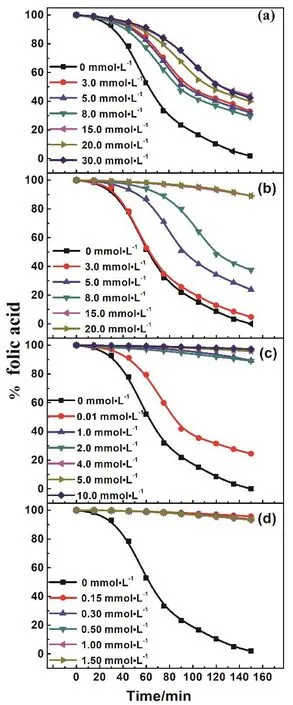
图4 pH 7.0时100 μmol·L-1叶酸在(a) SDS,(b) DTAB,(c) 12-6-12,(d) 12-3-12-3-12存在时剩余量随时间的变化Fig. 4 Decay of 100 μmol·L-1 folic acid in the presence of(a) SDS, (b) DTAB, (c) 12-6-12, (d) 12-3-12-3-12 at pH 7.0.
叶酸在紫外光的照射下会发生光氧化降解,降解是因为对氨基苯甲酸与喋呤啶连接处的仲胺对光不稳定,降解分为两步进行,第一步氨基氧化为醛基,第二步是醛基氧化为羧基。当叶酸没有降解时,谷氨酸片段会产生荧光猝灭效应,因此检测不到荧光信号;而当叶酸降解时,荧光强度会显著增加。产生荧光的片段是喋呤啶片段,因此我们可以通过表征体系的荧光强度变化来确定叶酸的稳定性。图4表示的是在不同浓度的四种表面活性剂存在时,叶酸剩余量与时间的变化曲线。我们将初始的叶酸含量定义为100%,根据荧光强度的比值计算得到随时间增加叶酸的剩余量。从图中可以看出,在没有表面活性剂存在时,叶酸在140 min后几乎完全降解,而在有表面活性剂存在时,叶酸剩余量明显增加,且随着四种表面活性剂浓度的提高剩余量都逐渐增加。但四种表面活性剂对叶酸剩余量的影响差异较大,在所研究的浓度范围内,SDS在15.0 mmol·L-1时,叶酸的剩余量基本保持稳定为43%,而对于三种阳离子表面活性剂DTAB、12-6-12、12-3-12-3-12,最后的剩余量分别为89%、96%和96%,但达到最大剩余量的浓度有较大差异,分别为15.0、4.0以及0.30 mmol·L-1。这表明随着表面活性剂寡聚度的增加,可以使用少量的表面活性剂就能很好地保护叶酸。因为DTAB、12-6-12和12-3-12-3-12本身的聚集能力存在显著差异,12-3-12-3-12的临界胶束浓度很低,在很低的浓度下就能形成聚集体,因而能很好地增溶与包裹叶酸。
3.4 SDS、DTAB、12-6-12和12-3-12-3-12与叶酸的作用机理
我们利用等温滴定量热技术(ITC)研究了叶酸与表面活性剂的相互作用过程40,实验结果如图5所示。为了减少实验误差,得到较强的热量信号,在此实验中,我们提高了叶酸的使用浓度。实验过程是将0.50 mmol·L-1的叶酸水溶液滴定到高浓度的表面活性剂的胶束水溶液中。图中曲线已经扣除叶酸溶液滴定水的热量变化。如图所示,SDS与叶酸的相互作用和其它三种阳离子表面活性剂与叶酸的相互作用显著不同。叶酸逐滴滴入SDS时,呈现出来的是一个逐渐吸热的过程且能量变化很小,这表明叶酸与SDS的相互作用很弱。三种阳离子表面活性剂与叶酸相互作用时的热量变化趋势一致:首先出现的是一个放热过程,此过程归因于叶酸分子与表面活性剂的静电结合;然后随着表面活性剂浓度的增加,放热量逐渐增加;当DTAB、12-6-12、12-3-12-3-12的浓度分别大于2.0、2.5、0.5 mmol·L-1时,放热量逐渐减少时,体系热量变化趋向于0,这意味着相互作用已经结束,或是叶酸已经完全增溶于阳离子表面活性剂胶束中,这也证明对于增溶或包裹同等浓度的叶酸,对于同种类型的表面活性剂,随着表面活性剂寡聚度的增加,所需表面活性剂的浓度降低。
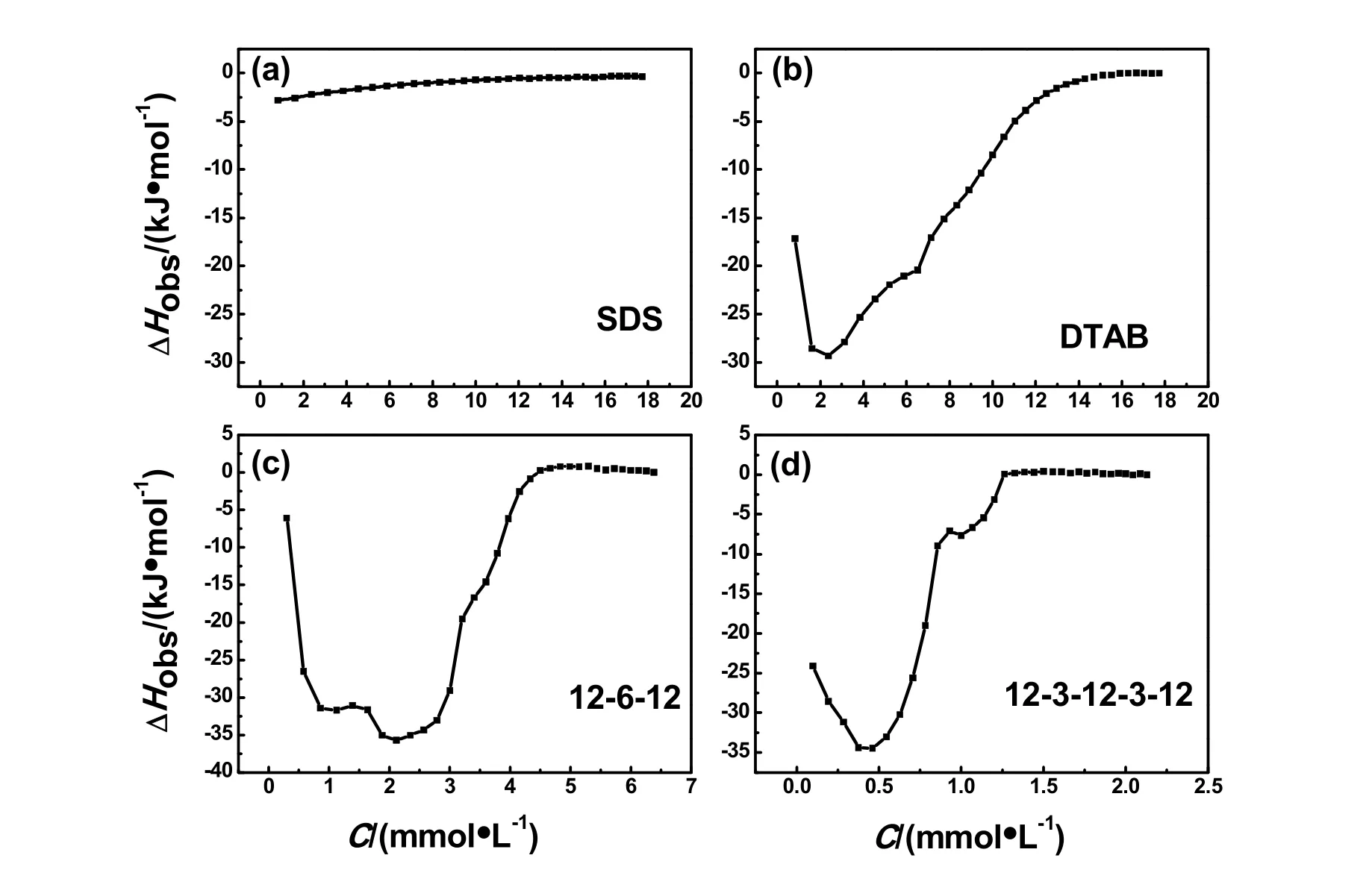
图5 pH 7.0时叶酸溶液滴定(a) SDS,(b) DTAB,(c) 12-6-12,(d) 12-3-12-3-12的ITC曲线Fig. 5 ITC curves of titrating folic acid into (a) SDS, (b) DTAB, (c) 12-6-12, (d) 12-3-12-3-12 at pH 7.0.

图6 (a) SDS,(b) DTAB,(c) 12-6-12在叶酸存在时的NOE光谱Fig. 6 (a) NOE spectra of the (b) SDS (c) DTAB (d) 12-6-12 in the presence of folic acid.
为了进一步研究叶酸与表面活性剂的作用机理,我们利用二维核磁氢谱(NOE)试图了解叶酸与表面活性剂作用时的空间位置。二维NOE增强谱(Nuclear Overhauser Effect Spectroscopy,NOESY)能直接提供质子空间距离的信息。由于核间的Overhauser效应,核间距离小于或者接近0.5 nm的两个质子会出现交叉峰,其强度与质子间距(d)的六次方成反比。NOESY能直观地呈现出分子的微观结构,因此可以判断表面活性剂分子的排列方式。如图6所示,SDS的相关峰很弱,且只存在自相关峰,表明SDS分子在空间上排列得较为松散。黄色部分的相关峰在DTAB和12-6-12当中都存在,a-bc对应了表面活性剂烷基链之间重叠,bc-de处的交叉峰意味着DTAB和12-6-12分子的疏水链排列紧密。显著不同的是,在12-6-12的NOE图谱中,存在绿色部分的abcde-f相关峰,表明12-6-12在形成的聚集体中烷基尾链的末端质子(a)和头基上的质子(e和f)在空间上距离很近,这说明12-6-12分子排列更加紧密疏水链彼此交叉深入。与前两种表面活性剂的聚集体相比,12-6-12表面活性剂在此结构中的排列更加紧密,这种紧密的堆积使得叶酸能够更好地隔绝外部环境,这也就解释了为什么12-6-12抑制叶酸光氧化降解的效率比DTAB高。对于12-3-12-3-12,情况更加不同,由于12-3-12-3-12形成的聚集体中的分子排布非常紧密,核磁信号非常微弱,交叉峰淹没在了噪音中,实验无法得到高质量的图谱。
4 结论
综上所述,本工作研究了pH为7.0时叶酸对四种不同电荷、不同寡聚度的表面活性剂表面活性、胶束化行为、聚集体尺寸的影响以及表面活性剂对叶酸光氧化降解行为的影响。表面张力测试结果表明,叶酸能明显提高阳离子型表面活性剂的表面活性,这体现在显著降低的临界聚集浓度和表面张力上,叶酸却对阴离子型表面活性剂SDS的表面活性几乎没有影响。叶酸与阳离子型表面活性剂之间存在强烈的静电相互作用,可以屏蔽表面活性剂极性头基之间的静电斥力,从而促进表面活性剂的聚集。动态光散射结果表明,叶酸不会诱导SDS发生聚集转变,却会诱导阳离子型表面活性剂首先形成尺寸较大的聚集体,然后向小聚集体转变,在叶酸存在时,12-6-12和12-3-12-3-12与叶酸都形成了较大的聚集体。这些叶酸参与形成的表面活性剂聚集体显著影响了叶酸的光氧化降解行为,其中,阳离子型表面活性剂能够抑制叶酸的光氧化降解,且随着表面活性剂寡聚度的增加,抑制效率增大,而所需表面活性剂的浓度显著降低。我们推测随着阳离子型表面活性剂寡聚度的增加,二者之间静电相互作用的位点增加,疏水相互作用增强。等温滴定量热和NOE的结果表明,叶酸与12-6-12和12-3-12-3-12作用时,由于强烈的静电相互作用和疏水相互作用,表面活性剂分子在聚集体中紧密排列,这样叶酸的不稳定部分能更好地被包裹在聚集体的疏水微区,从而能够与外界环境更好地隔离,得到保护。简而言之,本工作实现了用简单的小型功能分子调控表面活性剂聚集行为,同时又为不稳定小分子选择合适的载体提供了新的思路。
