黑小麦阿拉伯木聚糖酶提工艺优化及抗氧化活性研究
2019-07-24付元芳陈卓昀曾凡航王舒婷韩国全王利娜
付元芳,陈卓昀,曾凡航,王舒婷,韩国全,王利娜,陈 洪*
(1.四川农业大学食品学院,四川雅安 625014;2.四川省成都市食品药品检验研究院,成都 610000)
阿拉伯木聚糖(arabinoxylan,AX)是膳食纤维的主要组成成分。研究表明,AX 具有降低血清胆固醇、降低餐后血糖反应、预防肠道疾病和控制体重等功能,在食品领域有广泛的应用[1-4]。黑小麦作为一种黑色食品,相对于一般小麦而言,含有更为丰富的膳食纤维,是AX 的优质来源,具有较大的研究价值[5-6]。
近年来酶技术在多糖提取方面应用较广泛,然而用酶提取黑小麦中AX 的报道有待增加,酶提后剩余残渣的再次利用更需要进一步加强。由于纤维素酶能够消化细胞壁β-葡聚糖并打破AX 与β-葡聚糖之间的非共价键而释放AX;木聚糖酶作为细胞壁物质的分解酶,可使黑小麦细胞壁发生降解,破坏细胞壁结构从而释放AX。所以本试验选用这两种酶提取黑小麦中AX。由于从细胞壁中彻底提取AX 需要较为剧烈的条件,而酶提条件比较温和。因此,本试验分别使用超声辅助木聚糖酶提取黑小麦中 AX(xylanase extract arabinoxylan,XAX)及纤维素酶提取黑麦中的AX(cellulase extraction arabinoxylan,CAX)。酶提之后分别用碱处理两种酶提渣(XAX-1,CAX-1)。有研究表明[7-9],AX 具有较强的抗氧化性并且不同处理方式对AX 的抗氧化性有影响,因此本研究对所得四种AX 进行抗氧化性研究,旨在提高AX 得率的同时比较不同提取方法对所得样品抗氧化性的影响,为今后的相关研究提供更多可用资料。
1 材料和方法
1.1 试验材料
1.1.1 原料及试剂
黑小麦(黑宝石1 号,宏兵生态农场提供)。
木聚糖酶、纤维素酶、中性蛋白酶、糖化酶:上海瑞永生物技术有限公司;α-淀粉酶:北京奥博星生物技术有限责任公司;NaOH 溶液、无水乙醇、FeCl3等均为分析纯。
1.1.2 仪器设备
LDP-500A 高速多功能摇摆粉碎机(浙江永康红太阳机电有限公司)、JA3003 电子天平(上海浦春计量仪器有限公司)、DZKW-4 电子恒温水浴锅(北京中兴伟业仪器有限公司)、Thermo Sorvall ST 16 ST16R 通用台式离心机(赛默飞世尔科技公司)、Heto PowerDry PL3000 冻干机(赛默飞世尔科技公司)、RE-52AA 旋转蒸发仪(上海亚荣生化仪器厂)、KQ-250KB 超声波清洗器(昆山市超声仪器有限公司)。
1.2 试验方法
1.2.1 原料的预处理
将黑小麦置于烘箱,40 ℃烘12 h,粉碎,过40目筛。将过筛后的黑小麦粉在鼓风干燥箱中110 ℃加热90 min 灭酶。去淀粉(加入4%的α-淀粉酶,60 ℃水浴2 h)、去蛋白(加入1%的中性蛋白酶,40 ℃水浴 1.5 h),60 ℃烘干备用[10]。
1.2.2 提取工艺流程
预处理原料→超声辅助酶法提取→灭酶→离心(4 000 r/min,15 min)→上清液→透析→浓缩→冷冻干燥→AX。
1.2.3 阿拉伯木聚糖得率计算[11]

1.2.4 木聚糖酶提取单因素试验过程
称取5 g 原料,分别考察木聚糖酶用量(10、20、30、40、50 mg)、超声时间(20、40、60、80、100 min)、超声温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)、超声功率(100、125、150、175、200、225、250 W)对 XAX 得率的影响[12]。
1.2.5 响应面优化试验
在单因素试验的基础上,以酶用量、超声时间、超声温度、超声功率为自变量,XAX 得率为响应值,采用 Box-Behnken 响应面设计原理[13],以XAX 得率为指标,采用DX 8.0 分析软件进行设计。因素水平表见表1。
1.3 纤维素酶提取AX
取预处理的黑小麦粉5 g,加入100 mL 含有42 mg 纤维素酶的50 mmol/L 的醋酸钠缓冲液中,在超声温度为50 ℃,超声功率225 W 的条件下提取100 min,灭酶,离心取上清液,透析,浓缩,冷冻干燥,得到 CAX[11]。

表1 响应面分析试验因素水平表Table 1 response surface analysis test factor level table
1.4 残渣碱提AX
木聚糖酶与纤维素酶提取AX 后剩余的残渣在烘箱中60 ℃下干燥12 h,然后参照张晓娜的方法[14]提取AX。木聚糖酶与纤维素酶提取后残渣用碱提取所得分别为XAX-1 和CAX-1。
1.5 阿魏酸含量测定
取5 mg 阿魏酸标品,溶于0.05 mol/L、pH 7 的磷酸盐缓冲液(phosphate buffered saline,PBS),定容至50 mL 得100 μg/mL 阿魏酸标准溶液,后用PBS稀释成 2、4、6、8、10、12 μg/mL 的梯度标准溶液,以PBS 为空白,在290 nm 波长处测吸光度,建立标准曲线,将4 种AX 用PBS 配制成一定质量浓度的溶解液,测阿魏酸含量,每个样品测量3 次取平均值[15]。
1.6 AX的抗氧化性分析
通过测定 XAX、CAX、XAX-1、CAX-1 的·OH清除率[16]、DPPH·自由基清除率[17]、O2-·清除率[18]、还原力[19]及铁离子螯合能力[20]来评价其抗氧化活性。
1.7 数据统计分析
所有试验重复3 次。采用SPSS 21 分析软件对试验数据进行统计分析,以P<0.05 为显著性标准。
2 结果与分析
2.1 单因素试验结果
2.1.1 木聚糖酶用量对XAX 得率的影响
由图1知,随木聚糖酶用量的增加,XAX 得率先升高后降低,当木糖酶的用量为30 mg 时,XAX得率达到最大为2.26%。这是因为木聚糖酶是分离XAX 的关键酶类型,其可以打破木聚糖主链,使XAX 增多,当木聚糖酶量达到一定值时会降解XAX 成单糖,使XAX 得率降低。
2.1.2 超声时间对XAX 得率的影响
由图2可知,随着超声时间的延长,XAX 得率呈先上升后下降的趋势,当超声时间为80 min 时,XAX 得率达到最大值2.74%。可能是超声时间过短,XAX 没有完全溶出,随着时间的延长XAX 不断被溶出,当超声时间过长时,XAX 会在超声剪切力的作用下发生水解,使XAX 得率下降[21]。
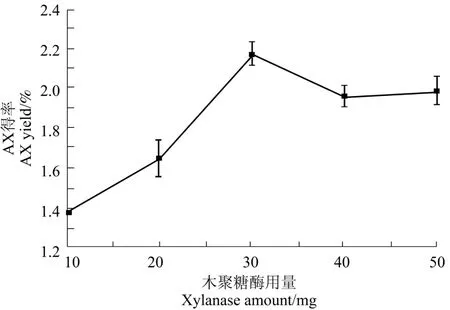
图1 木聚糖酶用量对XAX 得率的影响Figure 1 Effect of the use of xylanase on the extraction of XAX
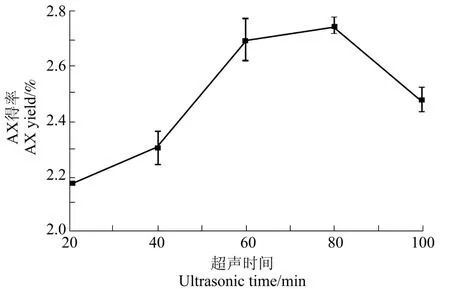
图2 超声时间对XAX 得率的影响Figure 2 Effect of ultrasonic time on extraction of XAX
2.1.3 超声温度对XAX 得率的影响
从图3可知,随着超声温度的升高,XAX 得率先上升后下降,当超声温度为60 ℃时,XAX 得率达到最大值3.66%。可能是随着温度的升高,XAX 分子运动加剧,使得溶质扩散的速率加快,从而使细胞内的XAX 溶出,但当温度过高,酶的活性降低,使 XAX 得率降低[22]。
2.1.4 超声功率对XAX 得率的影响
由图4可知,当超声功率低于175 W 时,XAX得率随超声功率的增大而增加,高于175 W 时,XAX 得率随超声功率的增加而降低。这可能是随着超声波功率的增大,分子扩散速度加快,使得XAX越容易溶出,当超声功率过高时,超声波的空化作用过强,使得提取的XAX 发生降解,导致XAX 得率下降[23],因此超声功率选择175 W。

图3 超声温度对XAX 得率的影响Figure 3 Effect of ultrasonic temperature on extraction of XAX
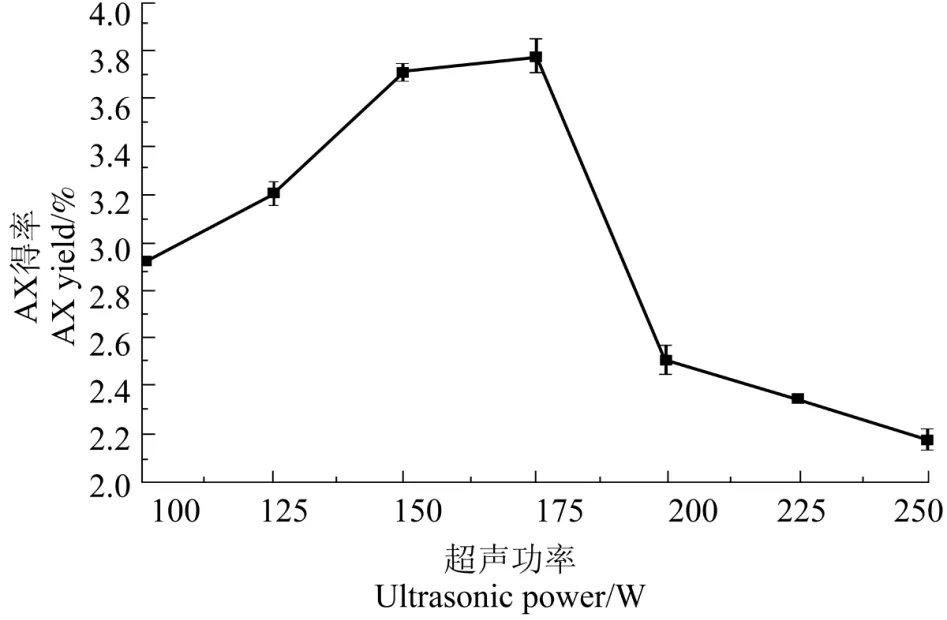
图4 超声功率对XAX 得率的影响Figure 4 Effect of ultrasonic power on extraction of XAX
2.1.5 响应面分析
2.1.5.1 响应面分析方案及结果
以 A、B、C、D 为自变量,以 XAX 得率为响应值(Y),试验方案及结果见表2。
对试验数据进行多项拟合回归,建立回归方程:Y=4.56-0.2A-0.064B+0.037C-0.095D+0.21AB-0.25AC-0.15AD+0.13BC-0.052BD+0.06CD-0.25A2-0.14B2-0.27C2-0.06D2,对模型进行方差分析,结果见表3。
由表3可知,该模型P<0.000 1 为极显著,说明与实际试验拟合程度较好。R2=0.920 4 表明模型响应值的变化有92.04%来自因变量的变化,XAX 得率(Y)实际值与预测值有较高的相关性。失拟项P>0.05,表明失拟项不显著,因此该模型可以预测响应值XAX 得率的实际情况。各个因素对XAX 得率的影响顺序为:木聚糖酶用量>超声功率>超声时间>超声温度。其中 A、AB、AC、A2、B2、C2对 XAX 得率的影响极其显著,D、AD、BC 对XAX 得率的影响显著。
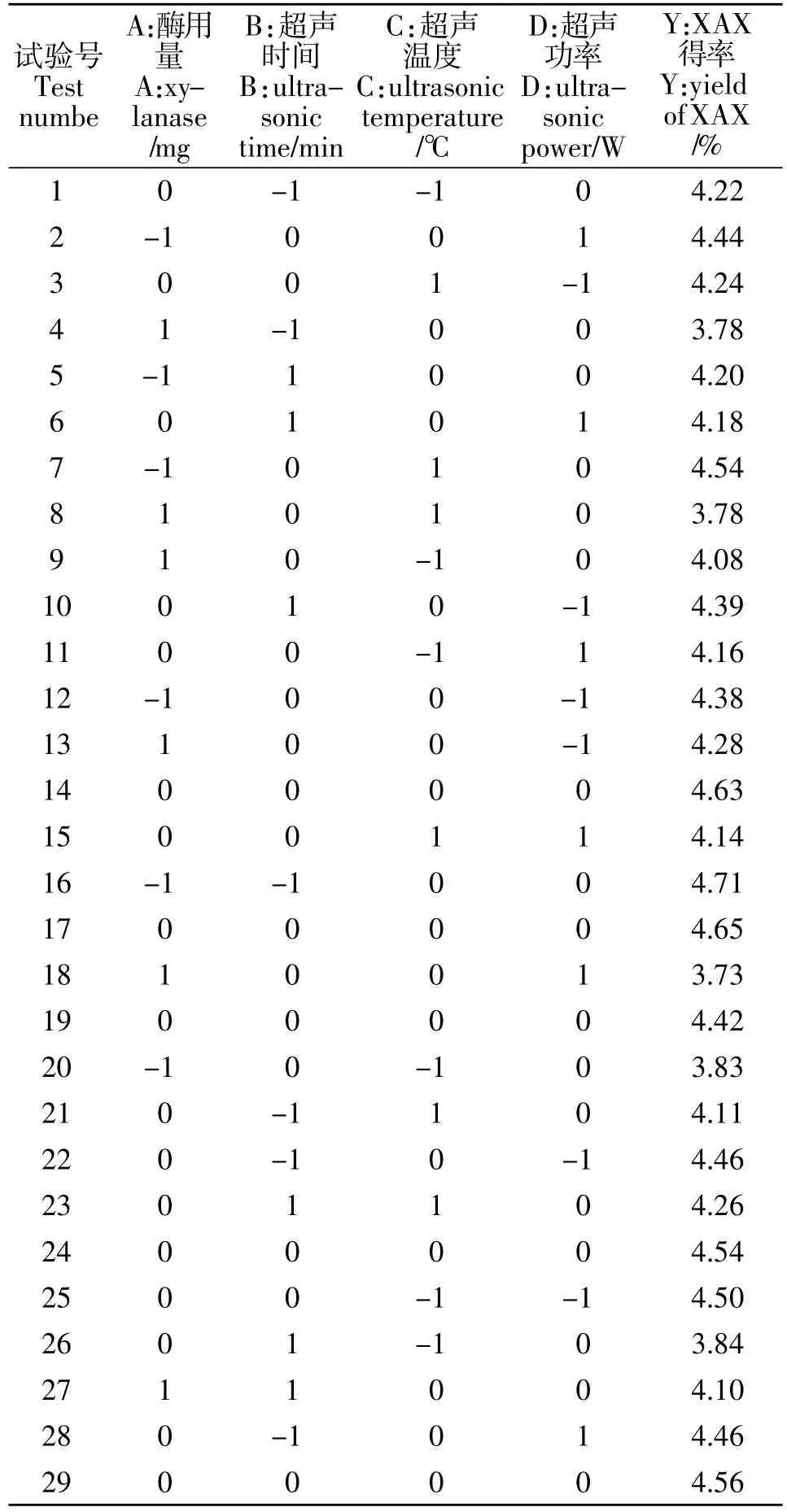
表2 响应面分析方案及结果Table 2 response surface analysis scheme and results
2.1.5.2 交互项解析
图5a-f 为木聚糖酶用量、超声时间、超声温度及超声功率之间两两交互作用对XAX 得率影响的响应面图。图5a 为木聚糖酶用量与超声时间交互作用对XAX 得率的影响,由图可知,当木聚糖酶用量一定时,XAX 得率随着超声时间的延长表现出先增加后降低的趋势,当超声时间一定时,XAX 得率也呈现先升高后降低的趋势,但变化幅度小于酶用量引起的变化,且等高线呈椭圆形,表明木聚糖酶与超声时间交互作用对XAX 得率的影响显著。由图5b 可知,木聚糖酶用量和超声温度的响应曲面陡峭,并且等高线呈椭圆形,表明木聚糖酶用量和超声温度交互作用对XAX 得率有极显著的影响。图5c 为超声温度和超声时间对XAX 得率的影响,可明显看出其响应面图较陡峭,说明超声时间和超声温度的交互作用对XAX 得率有一定的影响。图5d 为木聚糖酶用量与超声功率的交互作用对XAX得率的影响,由图中响应曲面的变化可看出,等高线呈椭圆形,说明木聚糖酶用量大于超声功率交互作用对XAX 得率的影响显著,而木聚糖酶用量对XAX 得率的影响大于超声功率。图5e 为超声功率和超声时间对XAX 得率的影响图,其中响应面图较陡峭,说明超声功率和超声时间的交互作用对XAX 得率有一定的影响,但并不显著。图5f 为超声温度和超声功率的交互作用对XAX 得率的影响,其中响应面图平缓,且等高线呈圆形,说明超声功率和超声温度的交互作用对XAX 得率影响不显著。

表3 回归模型方差分析Table 3 Variance analysis of regression model
2.2 验证试验
为验证模型预测的准确性,对所选的最佳工艺做验证试验,试验重复3 次,结果表明XAX 的组合为木聚糖酶用量39.99 mg、超声时间90.20 min、超声温度56.13 ℃、超声功率150 W 时XAX 得率为4.83%,与预测结果4.41%基本一致。在此条件下,XAX-1 的得率为11.21%。
2.3 纤维素酶提AX得率
纤维素酶提取的CAX 得率为2.33%,酶提渣通过碱提所得CAX-1 得率为15.98%。
2.4 阿魏酸含量测定
以吸光度为纵坐标(Y),阿魏酸质量浓度为横坐标(X),得线性回归方程y=0.213 6x+0.099 4(R2=0.999 5),测得 XAX、CAX、XAX-1、CAX-1 的阿魏酸含量分别(5.34±0.27)、(3.58±0.18)、(3.39±0.16)、(2.57±0.16)μg/mg。由图可知酶提 AX 中 FA 含量高于渣提物中FA 含量,可能是由于碱法制备AX 过程中伴随有脱酯化作用,使得单体FA 含量下降。
2.5 体外抗氧化性分析
2.5.1 AX 对·OH 清除率的影响
由图7可知,4 种 AX 对·OH 清除率随其浓度的增加,呈先降低后上升的趋势,当浓度为2 mg/mL时,CAX-1 对·OH 的清除率清除明显小于XAX、XAX-1、CAX(P<0.01),XAX 对·OH 的清除率清除小于 CAX(P<0.05),而 XAX、XAX-1 的清除率不显著;其对·OH 的清除率清除能力的强弱为CAX>XAX>XAX-1>CAX-1,说明酶提 AX 的·OH 清除率优于碱提残渣所得AX。这可能是酶提所得的阿魏酸含量较高,其上的酚羟基可以提供氢原子结合·OH自由基,此外,酶提组分的取代都较低,木糖的C(O)-2和C(O)-3 位上的羟基较多,可以结合·OH 自由基,提高了·OH 自由基的清除率[24-25]。

图5 两因素交互影响黑小麦AX 得率的响应面图Figure 5 The response surface plot showing the effect of every two factors interaction on the yield of AX

图6 AX 中阿魏酸含量Figure 6 The content of Ferulic acid in AX
2.5.2 AX 对DPPH 自由基清除率的影响
由图8所示,各AX 对DPPH 自由基清除效果与浓度成量效关系。在AX 浓度0~0.4 mg/mL 之间,随其浓度的增加,对DPPH 的自由基清除率显著增加,当 AX 浓度大于 0.4~mg/mL 时,CAX、XAX-1、CAX-1 对DPPH 清除率缓慢,而XAX 浓度大于0.8 mg/mL 时,其对DPPH 清除率缓慢,并且当浓度为 0.4 mg/mL 时,XAX、CAX 对 DPPH 自由基清除率没明显的区别,而 XAX-1、CAX-1 对 DPPH 自由基的清除率显著高于XAX、CAX(P<0.01);其对DPPH 的清除率强弱为 XAX>CAX>XAX-1>CAX-1,说明酶提AX 的DPPH 自由基清除率优于碱提残渣中的 AX。当浓度为 1.2 mg/mL 时 XAX、CAX、XAX-1、CAX-1 的清除率分别为97.71%、90.46%、88.09%、82.17%,说明各AX 对DPPH 自由基有强的清除能力。这可能是阿魏酸中含有酚羟基,对DPPH 自由基提供了H+,形成了DPPH-H,使得DPPH 自由基降低[26]。
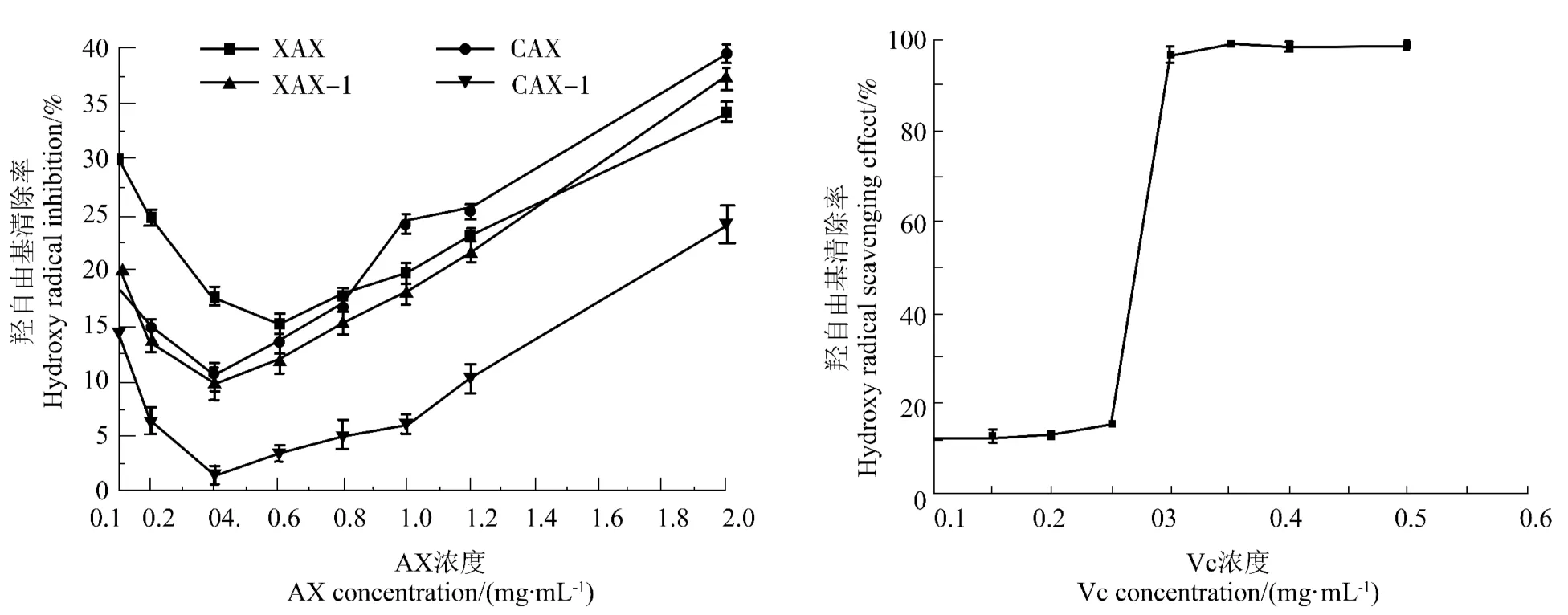
图7 AX 对羟自由基清除率的影响Figure 7 Scavenging effects of AX on hydroxyl radicals

图8 AX 对DPPH 自由基清除率的影响Figure 8 Scavenging effects of AX on DPPH radicals
2.5.3 AX 对O2-·自由基清除率的影响
由图9可知,这4 种AX 对O2-·的清除率与其浓度不呈量效关系,并且对O2-·清除效果较弱。XAX、CAX、XAX-1、CAX-1 对 O2-·的清除大小为XAX-1>XAX>CAX-1>CAX,说明碱提残渣所得 AX的O2-·的清除率大于酶提AX。可能是碱提的AX 相对于酶提的AX,分子量较大,取代度高,其上所含较多的单取代或双取代木糖能够通过空间位阻阻碍分子间交联物的形成,从而使AX 在反应体系中更易分散,充分参加氧化还原反应,使得O2-·自由基的清除率更高[27]。
2.5.4 AX 的还原力测定
由图10知,XAX、CAX、XAX-1、CAX-1 的还原力随着样品浓度的增加,没有明显的变化。可见样品浓度为0.1~1.2 mg/mL 时,各组分的还原力与其浓度不呈量效关系,相对于Vc,各组分的还原力较差。
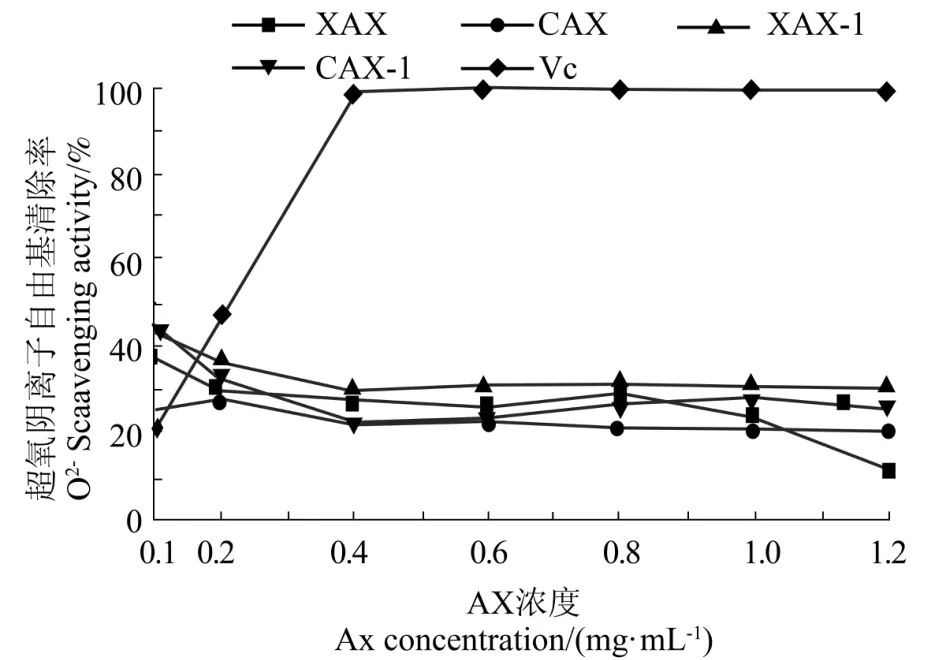
图9 AX 对超氧阴离子自由基清除率的影响Figure 9 The scavenging effect of AX on superoxide radicals
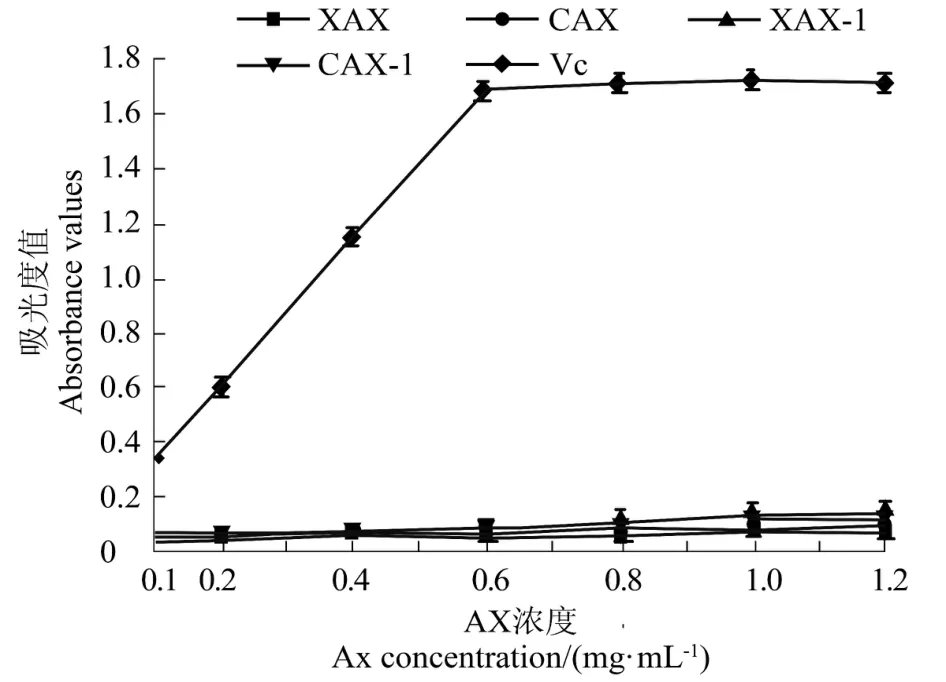
图10 AX 的还原力Figure 10 Reductive ability of AX
2.5.5 AX 对铁离子螯合作用的影响
从图11中可明显看出,4 种AX 对铁离子螯合率随其浓度的增加呈量效关系,其对铁离子螯合率的强弱为 CAX-1>XAX-1>CAX>XAX。浓度在0~1 mg/mL 之间时,AX 对铁离子螯合率随其浓度的增加呈明显上升趋势,之后随浓度的增加,其对铁离子的螯合率影响减小;当浓度为1 mg/mL 时,XAX 对铁离子螯合率明显低于 CAX、XAX-1、CAX-1(P<0.01),而 CAX、XAX-1、CAX-1 对铁离子螯合率不明显;当浓度为2 mg/mL 时,XAX、CAX、XAX-1、CAX-1 对铁离子的螯合率分别为28.27%、46.26%、52.36%、60.85%,说明这 4 种 AX 对铁具有较强的螯合作用并且碱提残渣组分对铁离子的螯合率大于酶提组分。这可能是因为官能基团-O-与AX 金属螯合能力有关,而碱提的取代度比酶提的高,分子量大于酶提,所以-O-较多,因此对铁离子的螯合率更高[28]。
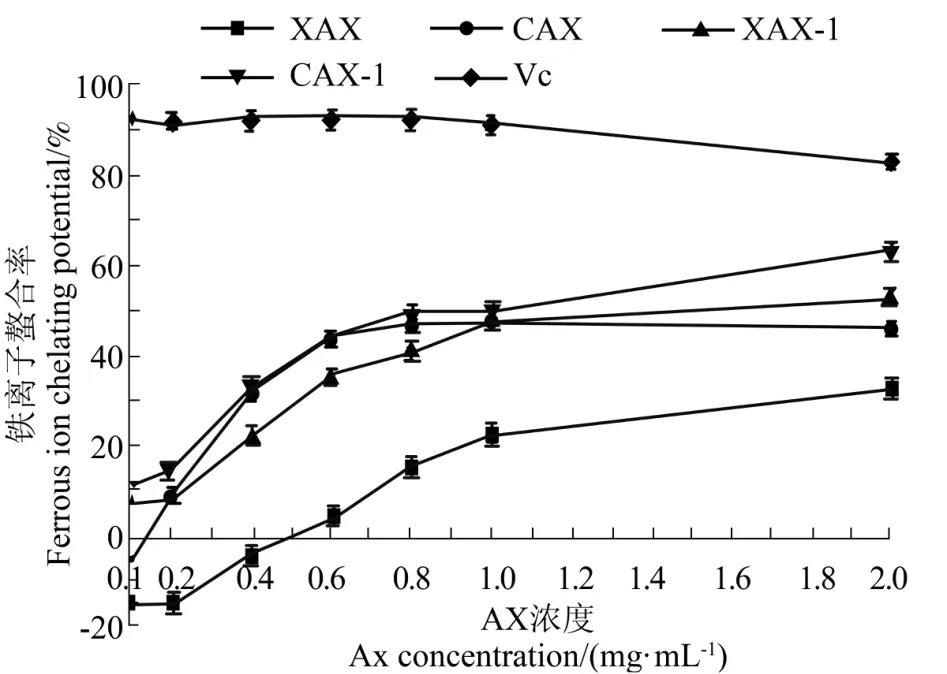
图11 AX 对铁离子螯合率的影响Figure 11 The chelating ability of AX to Fe2+
3 讨论与结论
阿拉伯木聚糖常用的提取方法有水提、酶提和碱提,此外还有机械辅助提取。不同的提取方法其优缺点不同,并且由于原料不同,提取得率也不同。苏东民等[29]为了提高小麦麸皮中WEAX 的得率,采用响应面法对其提取工艺进行了优化,得到了1.467 3%的WEAX,本试验中AX 得率较高,可能是超声波法和所加酶对原料细胞壁有较强的破坏作用,使得AX 溶出较多。木聚糖酶作为分离AX 关键的酶类型,近年来得到了广泛应用。马四平等[30]对小麦麸皮进行了不同的处理,研究了不同处理方式对AX 得率的影响,结果发现当木聚糖酶的添加量为0.16%时,AX 的得率达到最大值为3.654 7%,M.Aguedo 等[31]采用除去淀粉的麸皮为原料,使用枯草芽孢杆菌木聚糖酶处理得到AX 得率为4.3%,其结果低于本试验所得AX,可能是因为所用酶的类型以及所用原料不同所致。张晓娜[14]在小麦麸皮AX的提取及生理活性的研究中,发现超声波处理麦麸的WEAX 得率是直接水提取的3.3 倍,并且加酶超声处理对麦麸的破壁效果优于直接超声处理的效果,加酶超声处理30 min 时WEAX 的得率是直接超声处理的15.5 倍,由此可见超声处理可以提高多糖得率,而超声辅助酶法提取可能会达到更好的效果。有研究表明[32]AX 具有抗氧化特性,田贝贝等[33]对小麦淀粉加工废水中AX 的理化性质及抗氧化活性做了研究。结果表明,源自小麦淀粉废水的AX 具有较强的还原力和DPPH 自由基清除能力,对羟自由基清除作用则相对较弱,Li Y.等[34]用碱性过氧化氢方法从玉米麸皮中提取CAX,然后通过酯化反应将阿魏酸与CAX 进行共价键合,生成阿魏酸阿拉伯木聚糖酯(FA-CAX),并测定了其抗氧化活性,发现更高含量的阿魏酸导致更高的抗氧化活性。本试验采用木聚糖酶提取黑小麦中的AX,并对提取工艺进行了响应面优化设计,与纤维素酶提作对比;之后分别将两种酶提残渣用碱再次提取。结果显示纤维素酶提取CAX 得率为2.33%、碱提残渣为CAX-1(得率15.98%);XAX 反应的最佳工艺条件是木聚糖酶39.99 mg、超声时间90.20 min、超声温度56.13 ℃、超声功率150 W,此时AX 得率为4.83%,碱提残渣所得产物XAX-1(得率11.21%),表明酶提后剩余残渣再次提取可提高AX 得率。通过对 XAX、CAX、XAX-1 和 CAX-1 的抗氧化活性进行分析得出这4 种AX 都具有一定的抗氧化性,且抗氧化性不完全与阿魏酸含量呈正相关,可能由多方面因素影响。
