青稞幼苗期叶片中SBEⅡa基因的克隆及其表达分析
2019-07-24付国勇张永永刘新春李东梅时丽洁王丹丹冯宗云
付国勇,张永永,刘新春,李东梅,蔡 羽,时丽洁,王丹丹,冯宗云
(四川农业大学农学院大麦青稞研究中心,四川成都 611130)
青稞(HordeumvulgareL. var.nudumHook.f.)是禾本科小麦族大麦属的一年或多年生草本植物[1]。青稞作为海拔4 200 m以上农田的唯一种植作物,其高产、稳产对于稳定和促进藏区经济发展具有重要意义。但由于在生长发育中易遭受高温、低温和盐等非生物胁迫,严重影响了青稞的品质和产量。目前,对于高温、低温和盐胁迫的研究主要集中在小麦和水稻灌浆过程中环境对籽粒淀粉形成的影响[2-4],而对作物在幼苗期的非生物胁迫则主要集中在作物叶片生理生化方面[5-7],对叶片中参与了逆境抗性的淀粉基因及其表达情况则鲜有报道。
淀粉不仅是人类摄取能量的主要来源,也是重要的工业原材料[8]。淀粉又分为直链淀粉(amylose)和支链淀粉(amylopectin)。直链淀粉分支较少,是以α-1,4-糖苷键连接而成的高分子聚合体。支链淀粉分支较多,是以α-1,4-糖苷键为主链,在α-1,6-糖苷键部位形成葡聚糖分支后形成的高分子聚合体。淀粉分支酶(starchbranching enzymes,SBEs)主要参与了支链淀粉的合成,研究发现,有SBEⅠ和SBEⅡ两种分支酶,在单子叶植物中SBEⅡ基因存在SBEⅡa和SBEⅡb两种形式,其中SBEⅡb特异性地在胚乳中进行表达,而SBEⅡa在各个组织中都有表达[9]。任 欣等[10]对5个青稞品种的淀粉理化性质进行了研究,发现5种青稞淀粉颗粒大部分呈圆形,小部分呈椭圆形,青稞淀粉颗粒的体积平均粒径和表面积平均粒径之间均存在显著性差异。郑许光等[11]的研究表明,青稞籽粒灌浆期总淀粉、直链淀粉和支链淀粉的合成速率均呈单峰曲线变化,即先增加后降低,且在花后21 d左右达到最大积累速率。邹弈星等[12]通过对122份来自西藏的青稞品种(系)的淀粉特性的分析,发现供试材料的淀粉特性差异较大,直链淀粉含量和峰值黏度间存在极显著的相关性。Tang等[13]对青稞籽粒发育过程中淀粉的合成进行了分析,发现在籽粒发育过程中SuSy、AGPase和SBEⅡa有明显的上调表达。Chen等[14]对西藏青稞籽粒发育时期的籽粒进行转录组分析,发现青稞籽粒中SBEⅠ在花后15 d表达量显著增加,但在其他组织中表达量普遍较低;SBEⅡa在所有组织中的表达较为稳定,只是在花后15 d表达量达到最大;SBEⅡa的只在发育的籽粒中检测到转录,其表达量在花后15 d时达到最大。
鉴于前人对SBE的研究主要集中在SBEⅡb上,但对广泛分布于植物组织中的SBEⅡa却鲜有报道。本研究以杨智敏等[15]测定的胚乳中高支链淀粉品种喜马拉雅2号和低支链淀粉品种康青1号为材料,分析三叶一心期叶片中SBEⅡa基因的序列特征,以及在高温、低温和盐胁迫条件下叶片中该基因的表达特征及酶活性,以期了解SBEⅡa基因在不同环境中的变化情况,为后期培育低淀粉青稞品种提供参考。
1 材料与方法
1.1 材料的培养与胁迫处理
供试材料为青稞品种喜马拉雅2号和康青1号,由四川农业大学农学院大麦青稞研究中心保存。挑选大小均匀一致的喜马拉雅2号和康青1号种子,分别种植于直径20 cm的花盆中,一次性浇足水分。然后将花盆转移至PGX型多段可编程光照培养箱(宁波东南,浙江宁波),培养条件控制在25 ℃,光照强度为6 000 lx,光周期为16 h光照、8 h黑暗。待幼苗长至三叶一心时,分别进行高温、低温和盐胁迫处理,其中高温在37 ℃条件下进行;低温在4 ℃条件下进行;盐胁迫时用蒸馏水将青稞根部泥土和杂质清洗干净,将水分吸干后置于300 mmol·L-1的NaCl溶液中进行处理。在处理后的第2、4、6、8、10、12、24和48 h分别采集叶片,经液氮速冻后,-80 ℃保存备用。
1.2 青稞 SBEⅡa基因的克隆
参照大麦SBEⅡa(GenBank登录号为FN179383.1)序列,利用 Primer premier 5.0 软件设计引物,引物序列均由成都擎科梓熙生物技术有限公司合成。设计三段特异性引物(表1)进行青稞SBEⅡa基因的克隆。
根据RNAplant Plus植物总RNA提取试剂盒(天根,北京)提取青稞叶片的总RNA,随后参照TIANScript cDNA第一链合成试剂盒(天根,北京)说明书以青稞叶片总RNA为模板合成cDNA第一链,最后以反转录得到的cDNA为模板,以SBEⅡa-1F/1R、SBEⅡa-2F/2R和SBEⅡa-3F/3R分别为目的基因的引物(表1),扩增目的基因。扩增体系与程序参考Taq酶说明书(TaKaRa,日本),其中循环数为35,退火温度分别为58 ℃、60 ℃和58 ℃,延伸时间为30 s。利用1%琼脂糖凝胶电泳分离检测PCR产物,并参照普通琼脂糖凝胶DNA回收试剂盒(天根,北京)说明书回收产物。将回收的产物连接至pMD19-T Simple Vector(TaKaRa,日本),反应条件参考说明书。将连接产物转化至E.coliDH5α 菌株,以表1中的分段引物参考扩增程序进行PCR,分别挑选5个独立的阳性克隆,送至成都擎科梓熙生物技术有限公司进行测序。

表1 引物名称及用途Table 1 The primer pairs and their application
1.3 SBEⅡa基因编码蛋白的生物信息学分析
利用DNAstar软件分析SBEⅡa基因序列;利用ExPASy-ProtParam(https://web.expasy.org/protparam/)分析SBEⅡa编码蛋白的理化性质;利用CBS-SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)对该蛋白的信号肽进行预测;利用CBS-TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)对该蛋白的跨膜结构进行预测;使用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)中的Plant-mPloc预测SBEⅡa蛋白进行亚细胞定位。利用DNAMAN8软件和在线软件SMART(http://smart.embl-heidelberg.de/)分析该蛋白在不同物种中的保守结构域;利用MEGA6.06软件构建该蛋白的系统发育树。
1.4 SBEⅡa基因实时荧光定量PCR分析
以青稞组成型基因β-actin为内参基因,设计引物对Q-β-actin-F/R;根据克隆的青稞SBEⅡa基因序列,设计引物对Q-SBEⅡa-F/R(表1)。按照TB GreenTMPremix Ex TaqTM(Tli RNaseH Plus)(TaKaRa,日本)说明书于CFX96-C1000型荧光定量PCR仪(Bio-Rad,美国)上进行qRT-PCR,反应条件参考说明书。相对定量分析的计算方法参照2-△△CT法[16]。上述试验在每次独立试验中每个样品设3次重复,而且这样的独立实验至少重复3次。
1.5 SBEⅡa蛋白酶活性的测定
青稞叶片SBEⅡa蛋白酶活性的测定参照淀粉分支酶(SBE)测试盒(EC 2.4.1.18)(苏州科铭,江苏苏州)的操作步骤进行。
2 结果与分析
2.1 青稞 SBEⅡa基因克隆的结果分析
分别提取喜马拉雅2号和康青1号三叶一心期叶片中的总RNA,并进行琼脂糖凝胶电泳,检测RNA的完整性。随后,分别以两个材料的总RNA反转录得到的cDNA为模板,用三对引物进行PCR扩增,然后用1%的琼脂糖凝胶电泳检测,得到与预期片段相符的条带(图1)。将获得的目的条带切胶回收连接至pMD19-T Simple Vector,转入E.coliDH5α获得阳性克隆后测序,将测得的序列进行拼接,经BlastN比对后发现两个青稞品种SBEⅡa基因的编码区与大麦SBEⅡa基因编码区(FN179383.1)相似度为99%,表明获得了青稞SBEⅡa基因ORF区 序列。
2.2 青稞 SBEⅡa基因编码蛋白的生物信息学 分析
2.2.1 基本理化性质、跨膜结构、信号肽和亚细胞定位预测分析
通过DNAstar软件分析青稞SBEⅡa基因序列,结果表明SBEⅡa基因ORF区全长2 466 bp,共编码821个氨基酸。通过ExPASy-ProtParam分析青稞SBEⅡa蛋白的理化性质,结果表明其分子式为C4157H6266N1126O1234S30,分子量92.7 kDa,等电点pI为5.40。该蛋白负电荷的氨基酸(Asp+Glu)有117个,正电荷氨基酸(Arg+Lys)有85个,含甘氨酸(Gly)数量最多,为74个,占该蛋白所有氨基酸组成的9.0%;而半胱氨酸(Cys)数量最少,只有5个,占比为0.8%。不稳定系数为38.03,属于稳定蛋白。

A:康青1号电泳图;B:喜马拉雅2号电泳图;1:SBEⅡa基因的第一段,大小为853 bp;2:SBEⅡa基因的第二段,大小为919 bp;3:SBEⅡa基因的第三段,大小为1 073 bp;4:SBEⅡa基因的第三段,大小为1 072 bp。M:DL 2000 DNA分子标准质量。
A:Image of gene separation from Kangqing 1;B:Image of gene separation from Himalaya 2;1:The first segment ofSBEⅡagene(853 bp); 2:The second segment ofSBEⅡagene(919 bp);3:The third segment ofSBEⅡagene(1 073 bp);4:The third segment ofSBEⅡagene(1 072 bp).M:Molecular marker DL 2000.
图1SBEⅡa基因分段克隆
Fig.1 Segmented cloning ofSBEⅡagene
利用 CBS-SignalP 4.1人工神经网络方法进行信号肽预测,根据前70个氨基酸的C-score (raw cleavage site score)、S-score (signal peptide score)、Y-score (combined cleavage site score)均为没有大的起伏且都没有超过阈值0.5,可知该蛋白N端极有可能没有任何信号肽,不属于胞外分泌性蛋白。利用TMHMM 2.0进行跨膜结构预测,结果表明该蛋白不具有跨膜结构;利用Cell-PLoc 2.0中Plant-mPloc进行亚细胞定位预测,结果表明该蛋白定位于叶绿体上。
2.2.2 青稞SBEⅡa编码蛋白的保守结构域 分析
根据DNAMAN8软件进行序列比对,SMART软件进行保守结构域的预测,结果(图2)表明,青稞的SBEⅡa蛋白保守域区间为331~686,与α-淀粉酶结构域具有一致性。
2.2.3 SBEⅡa编码蛋白的系统发育分析
采用MEGA6.06软件对SBEⅡa蛋白与其他19种不同物种蛋白质的亲缘关系构建系统发育树(图3),结果表明,构建的系统发育可分为两大类,细江蓠(AAB97471.1)单独归为一类,其余19种植物归为一类;19种植物又可以划分为两大类,其中与青稞SBEⅡa蛋白亲缘关系最近的是大麦(CAX51366.1),其次是粗山羊草(AAK26821.1),与玉米(AAA18571.1)的亲缘关系也较近,而与细江蓠(AAB97471.1)的亲缘关系最远。
2.3 不同逆境条件下 SBEⅡa基因的表达分析
高温处理后(图4),喜马拉雅2号和康青1号叶片中SBEⅡa基因都有一个显著的变化过程,都在处理10 h 时叶片中SBEⅡa基因的表达量都达到最大,喜马拉雅2号在24 h 时叶片中SBEⅡa基因的表达量为最小,康青1号在48 h 时叶片中SBEⅡa基因的表达量为最小。在处理的前10 h 内,喜马拉雅2号叶片中SBEⅡa基因的表达量都高于康青1号,可能是在一定时间的高温环境下喜马拉雅2号叶片中SBEⅡa基因的表达对高温的敏感性和适应性要远高于康青1号;同时喜马拉雅2号叶片中SBEⅡa基因的表达量在10 h 之前随着处理时间的增加基本保持一致,彼此之间的差异较小,而康青1号叶片中SBEⅡa基因的表达则随着处理时间的增加呈现一个逐渐增加的过程,直至达到基因表达量的最大值,这说明SBEⅡa基因的表达存在个体差异性。
低温处理后(图4),喜马拉雅2号和康青1号的叶片中SBEⅡa基因都在处理10 h 时表达量达到最大,但喜马拉雅2号和康青1号叶片中SBEⅡa基因表达量的最小值分别出现在处理2 h和48 h时。整体来看,在低温处理过程中,喜马拉雅2号叶片中SBEⅡa基因表达量要远远高于康青1号,这可能和不同材料对低温的敏感性和适应性差异有关。两者在整个处理过程中基因的表达量都存在明显的变化,但是二者叶片中基因的表达量变化却不存在显著性差异。在处理的2、12、24和48 h二者之间的基因表达量变化不大,基因表达量差异较为明显的处理时间为4 、6 、8 和 10 h,这说明参试材料叶片中SBEⅡa基因对低温的敏感性较强,可能与青稞自身适应高海拔环境有关。
盐胁迫处理后(图4),喜马拉雅2号和康青1号的叶片中SBEⅡa基因在不同时间段的表达量存在差异,其中喜马拉雅2号叶片中SBEⅡa基因的表达对盐胁迫较敏感,在处理4 h 时表达量达到最大值,随后随着处理时间的延长,基因表达量呈现逐渐下降的趋势,但康青1号叶片中SBEⅡa基因的表达对盐胁迫的耐受性较高,在处理8 h时基因表达量才达到峰值,且在 10 h时的基因表达量和8 h时的表达量差异不大,这一结果说明在耐盐性方面康青1号叶片 中SBEⅡa基因的表达耐受性要强于喜马拉雅 2号。

方框内所示为该蛋白的保守域。 The sequence in red boxes is conserved domain of SBEⅡa protein.

图3 SBEⅡa蛋白的系统发育树
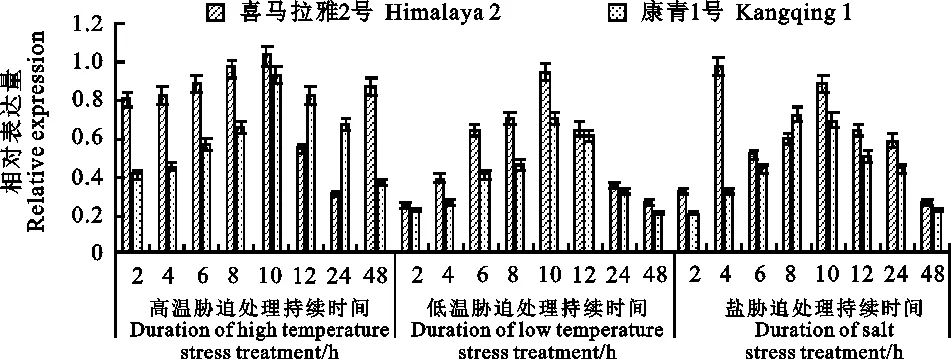
图4 不同处理下两个青稞品种 SBEⅡa基因的定量表达分析
2.4 不同逆境下SBEⅡa蛋白酶活性的测定结果
高温处理后(图5),喜马拉雅2号叶片中SBEⅡa蛋白酶活性普遍高于康青1号,但二者的SBEⅡa蛋白酶活性在高温处理10 h 时均达到最大,48 h 时均最小。整体来看,在一定的时间段内,高温对SBEⅡa蛋白酶活性起到促进作用,而随着时间的延长,其活性反而逐渐降低,但还是保持在一个相对较高的水平。

图5 不同处理下两个青稞品种的SBEⅡa蛋白酶活性
低温处理后(图5),喜马拉雅2号和康青1号叶片SBEⅡa蛋白酶活性均在处理10 h 时达到最大,喜马拉雅2号在处理2 h时最小,康青1号在处理48 h时最小。整体分析表明,两个品种叶片中SBEⅡa蛋白酶活性都随着时间的增加而逐渐增加,在达到一个顶峰后又开始逐渐下降,呈现一种先升后降的变化趋势。
盐胁迫处理后(图5),喜马拉雅2号叶片中SBEⅡa蛋白酶活性在4 h 时达到最大,在48 h 时最小;康青1号叶片中SBEⅡa蛋白酶活性在8 h 时达到最大,在2 h 时最小。根据两个材料蛋白酶活差异的变化可以推测喜马拉雅2号对盐胁迫的敏感性在处理的前期阶段要高于康青1号,而在4 h 后康青1号对盐胁迫的耐受性要高于喜马拉雅 2号。
3 讨 论
淀粉分支酶基因克隆已在豌豆[17]、水稻[18]、玉米[19]、大麦[20]等植物中展开,但是青稞中关于淀粉分支酶的克隆还未见报道。本实验克隆了青稞叶片中SBEⅡa基因并于已经克隆的SBEⅡa基因进行序列比对发现,与大麦SBEⅡa基因的序列相似性最高,其次与小麦的相似性也达到97%,而与其他植物的序列相似性最低为72%。
本研究在克隆得到青稞叶片中SBEⅡa基因的基础上,设置了高温、低温和盐胁迫的环境,利用qRT-PCRPCR技术结合淀粉分支酶活性测定试剂盒对SBEⅡa基因和SBEⅡa蛋白酶活性的变化进行了分析,结果表明不同处理条件下SBEⅡa基因的变化与其蛋白酶活性的变化具有一致性。这与谭彩霞等[21]和王自布[22]等人的研究结果具有一定的一致性,而与杨 毅等[23]人的研究结果有差异,可能是由于选取的材料不同所致。Takeda等[24]发现 SBEⅡa蛋白酶活性的最适pH为7.5,反应的最适温度为25 ℃。故本试验中将青稞实验温度设置为低温4 ℃、高温37 ℃,同时设置300 mmol·L-1的盐胁迫进行处理,结果发现在高温、低温、盐胁迫条件下,两个参试材料叶片中SBEⅡa基因的表达量变化情况和SBEⅡa蛋白酶活性具有相同的变化趋势,即随着处理时间的增加,不同处理条件下SBEⅡa基因表达量的升高与降低和SBEⅡa蛋白酶活性的升高与降低保持一致。同时,参试的两个材料叶片中SBEⅡa基因和SBEⅡa蛋白酶活性的变化在相同的处理时间点上也存在一些差异,在一定程度上反应了对不同环境的耐受性和材料之间的差异性。但是两个材料在不同处理条件下SBEⅡa基因的表达量和SBEⅡa蛋白酶活性没有显著性差异,推测SBEⅡa基因可能在支链淀粉的分支形成过程中起辅助作用,在支链淀粉中不起主导作用,这一结果与前人研究结果一致[25-26]。本实验研究主要集中在不同环境下青稞叶片中SBEⅡa基因和蛋白酶活性的变化,后续可对其在青稞根和籽粒灌浆期中的变化进行研究,以便深入的探究SBEⅡa基因在淀粉合成过程中的作用,为改良淀粉的品质及育种提供参考。
