饲喂不同浓度黄曲霉毒素B1饲料对草鱼幼鱼生长和毒素积累的影响
2019-07-20朱晓鸣王寿昆许伟华刘雨龙陈新华
黄 莹 姚 远 朱晓鸣 王寿昆 许伟华 刘雨龙 陈新华,
(1. 福建农林大学动物科学学院, 福州 350002; 2. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉430072; 3. 福建农林大学海洋研究院, 福建省海洋生物技术重点实验室, 福州 350002)
随着鱼粉资源日趋紧张, 鱼粉价格不断上涨。为了降低饲料生产成本, 水产饲料中多使用植物性蛋白, 如大豆、玉米蛋白粉等, 特别是在热带和亚热带地区, 这些饲料原料和饲料成品在加工、运输、保存过程中管理不当容易造成黄曲霉毒素(AFT)的污染[1]。AFT是霉菌次生代谢过程中产生的一类具有相似结构的有毒产物, 拥有1个糖酸呋喃和1个氧杂萘邻酮(香豆素)结构[2]。黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)是主要产生AFT的真菌, 在潮湿或阴雨天气的情况下, 极易导致上述2种真菌大量繁殖并产生AFT。曲霉菌通过空气、土壤或昆虫等途径传播到农作物和饲料储藏处, 在适宜的环境中繁殖并产生多种AFT, 最常见的有黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)和黄曲霉毒素G2(AFG2), 其中黄曲霉毒素B1(AFB1)具免疫毒性、肝毒性和基因毒性, 可引起多种疾病的发生[3]。
国内外有关AFB1对水产动物影响的研究, 主要集中于尼罗罗非鱼(Oreochromis niloticus)[4-7]、虹鳟(Oncorhynchus mykiss)[8,9]、凡纳滨对虾(Litopenaeus vannamei)[10,11]、斑点叉尾鮰(Ictalurus punctatus)[12]、南亚野鲮(Labeo rohita)[13]等种类。尼罗罗非鱼摄入含AFB1的饲料10周后, 生长减缓,死亡率升高[14]。用含不同浓度的AFB1饲料饲喂异育银鲫(Carassius auratus gibelio)成鱼24周, 各毒素处理组鱼体生长和饲料利用较对照组无显著差异,但对其生殖功能有一定影响[15]。不同水产动物对AFB1的敏感性差别很大, 此外AFB1毒性的大小还受到毒素浓度、暴露时间、年龄、性别等因素的影响[1,4,5,8,9]。AFB1污染不仅会造成水产动物生长性能降低, 免疫抑制, 肝脏能损伤, 而且会积累在水产动物的体组织中, 随食物链在生态系统中进一步传播, 有可能威胁到人类的健康。
草鱼(Ctenopharyngodon idellus)为我国传统的四大家鱼之一, 隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae), 雅罗鱼亚科(Leuciscinae)、草鱼属(Ctenopharyngodon), 为我国养殖产量最大的淡水养殖鱼类, 其配合饲料生产上多选用植物原料作其蛋白源。同时在我国南方渔民多习惯在塘头储存饲料, 而在高温、高湿的环境下, 原料及饲料感染黄曲霉的可能性极大, 这进一步提高了草鱼发生AFT中毒的概率。以往有关AFB1对水产动物的报道多集中于对水生动物急性毒性的研究, 研究方法多采用腹腔注射、灌喂等方式, 关于摄食途径导致亚慢性致毒的研究相对较少[4,13]。但在实际生产中水产动物暴露于AFB1的方式主要是通过摄食被毒素污染的谷物和饲料, 因此, 相对于急性暴露, 研究动物长期摄入含AFB1的饲料, 更接近天然状态的AFB1摄入途径。迄今为止, 有关AFT在水产养殖动物中的代谢机理和毒理学研究尚不完整, 也仅涉及少数品种[5,8,12]。关于草鱼AFB1的亚慢性中毒的研究鲜见报道。AFB1的毒性大小与受试动物的生长阶段相关, 有报道表明鱼苗阶段比成鱼更易发生AFT中毒[16]。本论文采用草鱼幼鱼为实验对象, 研究不同浓度AFB1对草鱼幼鱼的生长、饲料利用、肝胰脏和肾脏组织学以及肌肉毒素残留的影响, 评估饲料中的AFB1对草鱼养殖和食品安全的潜在隐患。
1 材料与方法
1.1 养殖系统
微流水养殖系统由18个圆形塑料(pp)养殖桶(直径80 cm, 高70 cm, 水体体积为180 L/缸)组成, 每缸水流速度0.6 L/min。每天测2次气温和水温, 每2周检测水体溶氧和氨氮。实验期间, 水温为22—28℃; 饲养用水为经曝气的自来水, 保持水体中的溶解氧含量在6 mg/L以上, 氨氮范围为0.2—0.4 mg/L, pH为6.8—7.0。光照周期12L∶12D, 光照周期为8:30到20:30。
1.2 实验饲料及实验设计
设置了不同浓度梯度AFB1(0、10、20、100、1000和5000 μg/kg)的6种等氮等能(32.96%蛋白质,14.55 kJ/g能量)饲料(表 1)。其中, 蛋白源为白鱼粉和酪蛋白。
在各实验组中, 通过酶联免疫法测得饲料中AFB1含量分别为0.8、11.6、20.3、94.9、955.7和4979.2 μg/kg, AFB1浓度的设计参考关于AFB1在水产动物的研究报道[4,5,15]。AFB1纯品购于美国Sigma公司, 将其溶于大豆油制成1000 μg/mL的母液, 按照设计浓度添加相应量到各组饲料中。饲料制成直径3 mm颗粒, 于60℃恒温干燥箱中烘干后置于-20℃冰箱备用。
1.3 实验鱼与饲养实验
实验草鱼幼鱼来自福州市闽侯县南屿汤湖生态养殖场。实验鱼在室内循环水养殖系统中暂养2周后转入实验系统驯养2周, 暂养和驯化阶段均投喂对照组饲料(表 1)。在实验开始时, 实验鱼饥饿24h, 选择健康、规格较为一致的草鱼幼鱼(平均体重2.90 g)360尾, 随机放入18个鱼缸中, 分为6个实验组, 每组3个平行, 每缸20尾, 进行为期84d的饲养实验。暂养期间和实验期间均于每日9:30与16:00分别连续投喂饲料, 达到表观饱食为止。在实验结束时, 将实验鱼饥饿24h, 称量和记录每缸鱼的终末体重。
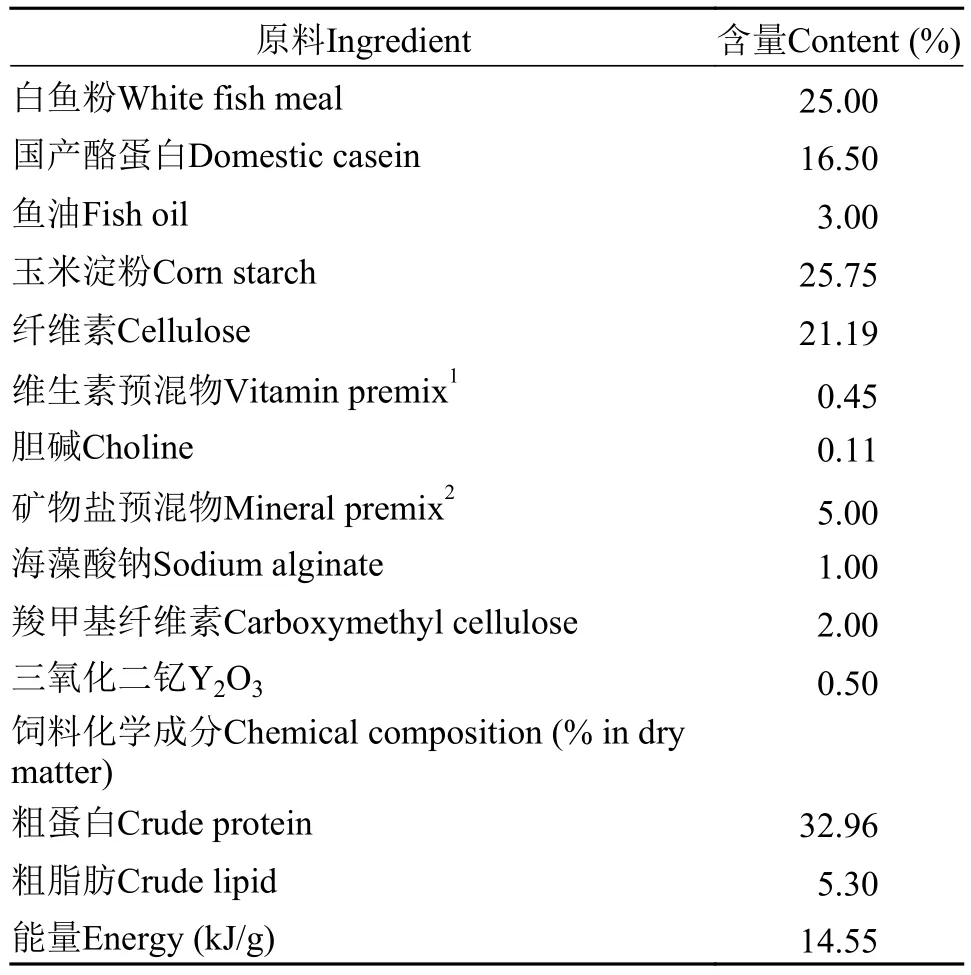
表 1 实验基础饲料配方及化学组成(%干物质)Tab. 1 Diet formulation and chemical composition of experiment diets (% in dry matter)
1.4 实验取样
在实验结束时, 每缸随机取3尾草鱼幼鱼解剖取出肝胰脏和肾脏, 用中性甲醛固定, 采用HE染色做组织切片, 用作组织学观察; 每缸随机取7尾草鱼幼鱼在冰盘上解剖取背部白肌, 冷冻干燥后保存于-20℃用于肌肉AFB1含量测定。
1.5 样品的测定
实验饲料的干物质、粗蛋白、粗脂肪、灰分的测定参照文献[17]的方法测定: 干物质在105℃烘干至恒重, 通过失重法测定; 粗蛋白采用FOSS定氮仪(2300 Kjeltec Analyzer Unit)测定; 粗脂肪采用索氏抽提仪(Soxtec system HT6, Tecator, Hoganas,Sweden)进行测定; 灰分在马福炉中550℃燃烧3h,失重法测定。
血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性的测定均采用南京建成生物工程研究所的测试盒。鱼体肌肉毒素残留采用ELISA法[4,15], 使用北京百灵康源生物公司的测试盒进行测定, 使用酶标仪(THERMO FISHER Multiskan FC)读数。
1.6 数据处理
利用下列公式计算特定生长率、摄食率、饲料效率、肝体比和脏体比:
存活率Survival rate (%)=100%×(剩余尾数/初始尾数)
特定生长率(SGR, %/d)=100%×(LnW2-LnW1)/t
摄食率(FR, %BW/d)=100%×I/[(W1+W2)/2]/t
饲料利用率(FE, %)=100%×(W2-W1)/I
肝体比(HSI)=l00×肝脏重量(g)/鱼体体重(g)
脏体比(VSI)=l00×内脏重量(g)/鱼体体重(g)
式中,W1为平均初始体重(g),W2为平均终末体重(g),t为实验时长(d),I为摄食量(g)。实验数据采用统计软件SPSS Statistics 17.0进行统计分析。实验结果经过一元方差分析(One-way ANOVA)后, 用Duncan’s进行多重比较, 当P<0.05时为差异显著。
2 结果
2.1 饲料中AFB1水平对草鱼幼鱼生长的影响
在整个实验过程中, 各组草鱼幼鱼行为均未表现出异常。各毒素组草鱼幼鱼外部形态和颜色较对照无显著差别。如表 2所示, 各毒素组草鱼幼鱼的存活率均在80%以上, 与对照组无显著差异(P>0.05)。在实验结束时, 各组草鱼幼鱼终末体重无显著差异(P>0.05)。饲料AFB1水平对草鱼幼鱼摄食率(FR)、特定生长率(SGR)、饲料效率(FE)无显著影响(P>0.05)。
2.2 饲料AFB1水平对草鱼幼鱼生理指标的影响
如表 3所示, 饲料AFB1水平对草鱼幼鱼血清谷丙转氨酶、谷草转氨酶、碱性磷酸酶、超氧化物歧化酶和谷胱甘肽过氧化物酶活性均无显著影响(P>0.05)。
2.3 饲料中AFB1水平对草鱼幼鱼内脏指数和组织学的影响
经过为期84d含不同浓度AFB1的饲料饲养后,解剖发现, 草鱼幼鱼皮肤和各组织完整, 未观察到鳍、眼和内脏器官等外部形态的改变。各毒素组幼鱼的肝体比和脏体比与对照组相比无显著差异(P>0.05, 表 4)。
肝脏组织切片观察结果如图 1所示, 摄入不同浓度AFB1的草鱼幼鱼肝细胞均未出现异常, 细胞膜完整, 细胞质均匀、清晰, 细胞核形状较为规则,细胞紧密连接。未见各类炎症细胞, 没有嗜酸性粒细胞聚集现象。图 2为肾脏组织切片观察结果, 经不同AFB1浓度处理的草鱼幼鱼肾脏组织未出现异常, 组织细胞边界清晰, 肾小管与周围组织相连, 未出现萎缩、变形等病理变化, 各毒素组草鱼幼鱼肾脏组织结构与对照组无显著差异。
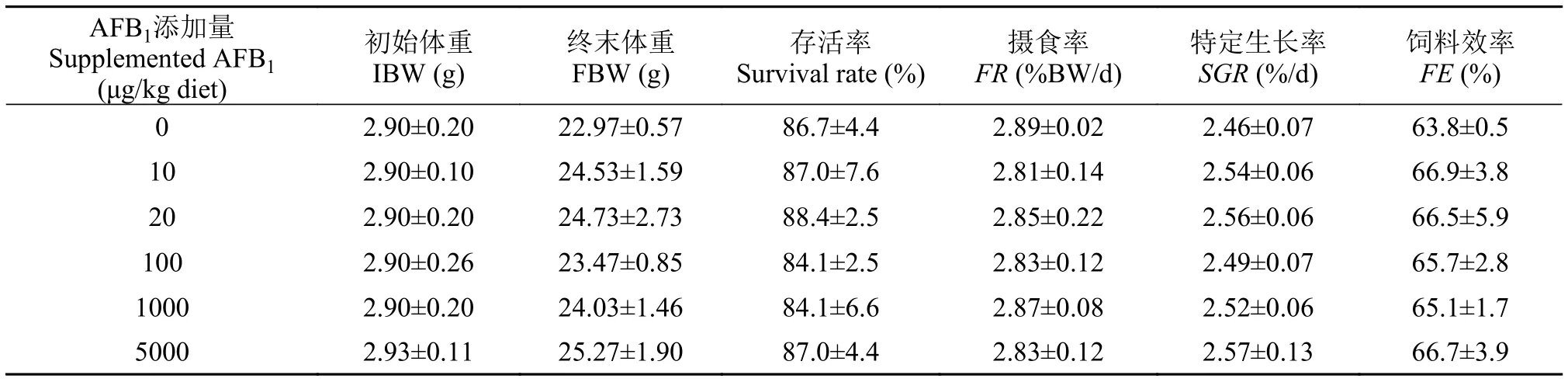
表 2 饲料AFB1水平对草鱼幼鱼初始体重(IBW)、终末体重(FBW)、存活率、摄食率(FR)、特定生长率(SGR)和饲料效率(FE)的影响(平均值±标准误)Tab. 2 Effects of dietary AFB1 on initial body weight (IBW), final body weight (FBW), survival rate, feeding rate (FR), specific growth rate (SGR), feed efficiency (FE) of juvenile grass carp (Mean±SE)
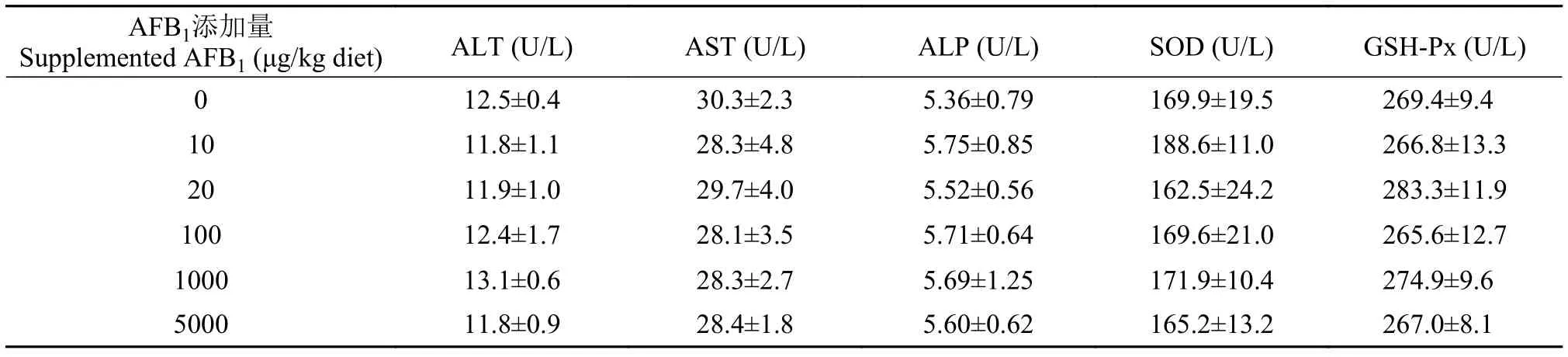
表 3 饲料AFB1水平对草鱼幼鱼血清谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性的影响(平均值±标准误)Tab. 3 Effects of dietary AFB1 on serum activities of glutamic-pyruvic transaminase (ALT), glutamic-oxalacetic transaminase (AST),alkaline phosphatase (ALP), superoxide dismutase (SOD), and glutathione peroxidase (GSH-Px) of juvenile grass carp (Mean± SE)
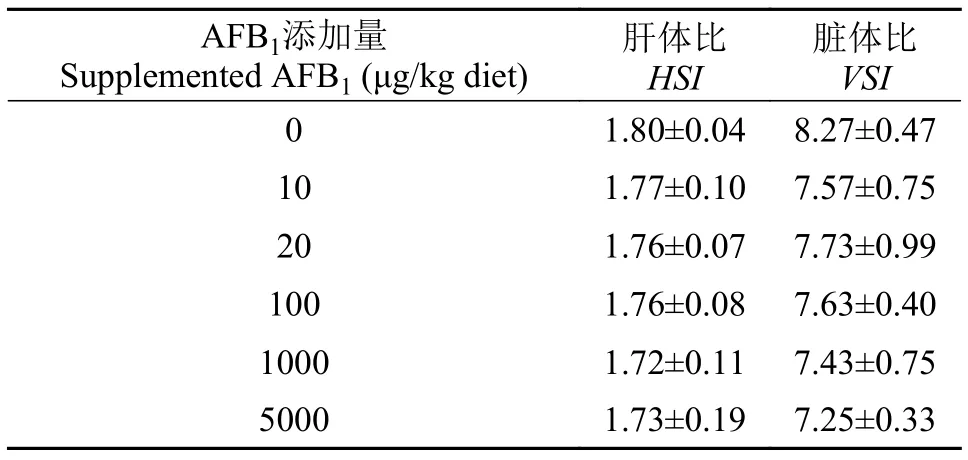
表 4 饲料中AFB1水平对草鱼幼鱼肝体比(HSI)、脏体比(VSI)的影响(平均值±标准误)Tab. 4 Effects of dietary AFB1 on hepatosomatic index (HSI) and viscera index (VSI) of juvenile grass carp (Mean ± SE)
2.4 饲料AFB1水平对草鱼幼鱼肌肉的AFB1积累水平的影响
在实验结束时, 草鱼幼鱼肌肉中AFB1的残留量如表 5所示。摄食AFB1≤1000 μg/kg的草鱼幼鱼肌肉中未检测出AFB1残留, 仅在5000 μg/kg实验组中检测出肌肉中含有(1.21±0.18) μg/kg的AFB1。
3 讨论
3.1 饲料中AFB1水平对草鱼幼鱼存活率和生长的影响
AFB1会引起水产动物行为异常、体表黄化、食欲降低, 长期食用或暴露在AFB1污染中还会表现出致癌、致畸、致突变等基因毒性, 造成动物死亡[4,18-20]。凡纳滨对虾摄入AFB1含量为 1500 μg/kg的饲料后成活率显著下降[21]。罗非鱼摄食AFB1含量为10 mg/kg的饲料对死亡率无显著影响[5]。异育银鲫摄食1000 μg/kg AFB1后存活率与对照组无显著差异[1]。在本实验中, 草鱼幼鱼摄入AFB1达5000 μg/kg的饲料对存活率无显著影响, 形态正常、鱼体健康, 表明草鱼幼鱼对AFB1的耐受性较强。
尼罗罗非鱼[14]、斑节对虾(Penaeus monodonFabricius)[22]摄食AFB1后表现为增重率降低; 沟鲶[19]和杂交鲟(Acipenser ruthenus♀×A. baerii♂)[23]摄食AFB1后摄食率下降。罗非鱼摄食AFB1达245 μg/kg时饲料效率显著降低, 饲料效率降低与饲料中AFB1含量存在剂量效应[4]。在本实验中, 各毒素组草鱼幼鱼摄食率、特定生长率、饲料效率均未显著受到显著影响, 表明不同的鱼类在AFB1的耐受性上差别很大。
3.2 饲料中AFB1水平对草鱼幼鱼肝功能指标和抗氧化能力的影响
肝脏被认为是AFB1的主要作用器官。AFB1在肝脏中首先经细胞色素P450氧化酶代谢转化为黄曲霉毒醇(AFL)等, 而黄曲霉毒醇又转化为AFB1-8,9-环氧化合物(AFBO), 随后与鸟嘌呤结合, 形成一系列的加成物导致可遗传的恶性肿瘤基因[24]。生物体血清中的AST和ALT是医学临床上肝功能检查的最为主要的2种指标, 当肝脏受损, 细胞膜的通透性增大, 存在于肝细胞浆ALT和AST进入血液内, 血清中的ALT和AST的活性升高[1,4,11]。凡纳滨对虾摄入AFB1后ALT和AST活力显著高于对照组[25]。碱性磷酸酶是肝脏中重要的解毒酶, 也是肝脏受损的评价标准之一。斑节对虾摄食AFB1后ALP活性显著升高[22]。在本实验中, 草鱼幼鱼摄入不同浓度AFB1后血清ALT, AST和ALP均无显著变化, 说明摄食AFB1含量≤5000 μg/kg饲料未对草鱼幼鱼肝功能造成损伤。
AFB1经过生物活化步骤转化成的AFBO具有亲电性, 极易攻击酶蛋白分子上亲核的氮、氧和硫等杂原子, 不但使酶蛋白失活, 而且使体内产生的大量自由基和活性氧无法及时清除[26]。肝细胞自由基清除系统受损, 机体的抗氧化能力大大降低,从而引起组织细胞的脂质过氧化, 使细胞内活性氧防卫系统SOD、GSH-Px等活力下降[11]。在本实验中, 摄食AFB1未对草鱼幼鱼的SOD和GSH-Px造成显著影响。
3.3 饲料中AFB1水平对草鱼幼鱼内脏指数和组织学的影响
AFT可引起动物肝脏纤维化、肝小叶中心坏死, 胆囊肿大、胆管上皮组织增生等。摄入AFB1会造成鱼体肝脏肿大, 肝体比显著升高[20]。在本实验中, 草鱼摄食AFB1达5000 μg/kg饲料对肝体比、脏体比无显著影响, 未造成胆囊肿大, 此结果与Huang等[15]对异育银鲫的报道相似。
虹鳟连续12个月摄入80 μg/kg的AFB1后, 肝脏表现为出现大量空泡并伴有炎症反应[27]。在肝脏受损的情况下, 虹鳟的原纤维细胞会转化为成肌纤维细胞, 以应对肝脏的损伤。罗非鱼摄入超过245 μg/kg超过20W后会引起肝脏疾病, 表现为肝形态异常,肝脏空泡化严重, 伴有大量的嗜酸性粒细胞和炎症细胞[4]。凡纳滨对虾摄入AFB1后肝胰腺出现空泡的数量要远多于对照组, 随着AFB1浓度的升高, 肝细胞坏死程度越深, 空泡数量越多[11]。虹鳟摄食0.5 μg AFB1/kg饲料6个月后发现肝癌[8]。在本实验中, 草鱼幼鱼的肝胰脏组织未呈现纤维化病变, 肝脏细胞排列正常、紧密, 未见各类炎症细胞, 表明食用5000 μg/kg以下的AFB1不会对草鱼幼鱼肝胰脏造成病理损伤, 该结果与Han等[28]异育银鲫摄入AFB1后肝胰脏组织结构的影响的报道相似。这些不同的研究结果表明, AFB1诱导肝癌的易感性方面, 生物种间存在着极大的差异。
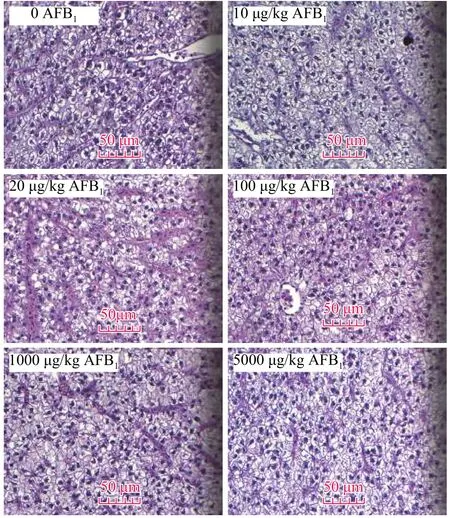
图 1 饲料中AFB1对草鱼幼鱼肝脏组织学的影响(HE, 标尺为50 μm)Fig. 1 Hepatopancreas of juvenile grass carp fed with diets containing AFB1 (HE, Bar = 50 μm)
鲤(Cyprinus carpio)摄食不同浓度(0.5、0.7、1.4 mg/kg) AFB121d, 鲤肾脏上皮组织变性脱落、坏死, 肾小管和肾小囊腔扩张[29]。AFB1急性或者亚急性攻毒均会引起南亚野鲮肾脏肾曲小管上皮细胞变性、坏死, 肾小球萎缩[30]。低浓度(0.05 μg/kg) AFB1饲料饲养白鼠8周, 解剖观察其肾脏组织学变化, 染毒组的小鼠肾脏部分区域的近曲小管出现坏死和脱落现象; 电镜结果表明, 细胞质呈现空泡状态, 缺乏线粒体, 微绒毛间隔稀疏, 远曲小管出现细胞极性的消失和基底外侧内折[31]。在本实验中, 草鱼摄入5000 μg/kg以下的AFB1不会对肾脏组织造成损伤, 表明草鱼可能对AFB1有较强的代谢能力。一些鱼类对AFB1耐受力较强可能是由于AFB1在其体内较快地转化成AFL而非AFBO, 并且迅速被解毒酶作用而生成水溶性物质, 最后通过其胆汁、尿液等排出体外[12]。
3.4 饲料AFB1水平对草鱼幼鱼肌肉的AFB1积累水平的影响

图 2 饲料中AFB1对草鱼幼鱼肾脏组织学的影响(HE, 标尺为50 μm)Fig. 2 Kidney of juvenile grass carp fed with diets containing AFB1 (H&E, Bar = 50 μm)

表 5 饲料中AFB1水平对草鱼幼鱼肌肉AFB1积累(μg/kg湿重)的影响(平均值±标准误)Tab. 5 Effects of dietary AFB1 on AFB1 accumulation (μg/kg wet weight) in muscle of juvenile grass carp (Mean± SE)
(Dicentrarchus labraxL.)饲喂含18 μg/kg AFB1饲料42d后, 其肌肉中的AFB1达到4.25 μg/kg[34]。斑节对虾摄入AFB1第4周肌肉和头胸甲中有残留, 且肌肉中含量多余头胸甲, 而第6周开始AFB1的残留量开始下降, 肌肉中AFB1含量极低, 而头胸甲中的残留量也显著减小[22]。在本研究中, 摄入AFB1浓度在1000 μg/kg以下的草鱼肌肉中未检测出AFB1残留,而5000 μg/kg组的残留量仅为1.21 μg/kg, 低于FDA食品安全标准, 此结果与王静等[11]对凡纳滨对虾的报道相似, 摄入AFB1含量在2000 μg/kg以下的虾体肌肉中未检测出AFB1。
4 结论
草鱼幼鱼摄入AFB1含量达4979.2 μg/kg饲料84d后, 其生长、肝功能指标、内脏指数、肝胰脏和肾脏组织结构均未受到显著影响。肌肉的AFB1残留量低于FDA食品安全限定标准。
