褪黑素引发对盐胁迫敖汉苜蓿种子发芽特性的影响
2019-07-13
(1.中国农业大学草业科学系,草业科学北京市重点实验室, 北京 100193;2.河北省承德市国营鱼儿山牧场, 河北 承德 068359)
种子的萌发和正常生长是决定草地播种建植成功的重要前提。在种子萌发生长期间,对外界环境条件非常敏感,容易受到温度、水分、盐碱等非生物因素胁迫影响,其中盐碱胁迫是影响种子正常发芽的重要因素之一。研究表明,不同浓度水平的盐碱溶液对种子萌发和幼苗生长作用效果不同。在较低浓度的盐碱胁迫时,促进种子萌发。25 mmol·L-1NaCl溶液可促进紫花苜蓿(Medicagosativa)种子发芽与幼苗生长[1]。紫花苜蓿种子萌发受到NaCl溶液胁迫,苜蓿植株的存活率、根长、茎长与盐浓度呈负相关,且当NaCl溶液浓度≤0.1%时,有利于紫花苜蓿的生长[2]。50 mmol·L-1NaCl溶液和25 mmol·L-1Na2CO3溶液均可促进紫花苜蓿种子萌发与幼苗生长,随着盐碱溶液浓度升高,种子萌发和幼苗生长受到显著抑制,并且碱胁迫的抑制作用要强于盐胁迫[3]。蔺吉祥等将2种中性盐NaCl、Na2SO4与2种碱性盐NaHCO3、Na2CO3以不同的摩尔比例混合,结果表明,低浓度盐胁迫对公农1号紫花苜蓿种子发芽有一定的促进作用,种子的发芽率、发芽势等均随着盐浓度的增加不断下降,且碱性盐比例越大下降越明显[4]。随着盐、碱胁迫浓度的增加,黄花苜蓿(M.falcata)种子发芽率和发芽速度降低,且碱性盐的胁迫作用大于中性盐[5]。说明盐溶液的种类与浓度对于种子发芽具有重要作用。
种子引发处理可以提高种子发芽率和种苗的抗逆性,通过引发进行种子生理与生化修复,使其处于预发芽状态,从而提高种子的出苗速度、幼苗生长和产量水平。紫花苜蓿种子在0.8% NaCl胁迫下,水、20% PEG 6000、2% KNO3-KH2PO3和沙引发均能显著提高种子发芽率、发芽指数,促进盐胁迫下种子萌发和幼苗生长[6-7]。邓蓉等采用20% PEG、2% KNO3、2% KNO3-KH2PO4和水对维多利亚、WL 323和亮2紫花苜蓿进行引发试验,结果表明引发处理效果在苜蓿品种间有差异,水引发比PEG处理更有效提高茎长。维多利亚苜蓿的PEG引发效果最明显[8]。闵丹丹以陇东苜蓿和甘农3号紫花苜蓿为试验材料,研究水、PEG-6000、KNO3、CaCl2以及GA3引发处理后的种子在低温、盐和干旱胁迫下的萌发和幼苗生长,结果发现,在NaCl溶液胁迫下,引发对紫花苜蓿种子萌发的影响,随盐浓度、引发方法以及品种而异,并且随盐浓度的增加,引发后种子的萌发率均呈下降的趋势[9]。
褪黑素(MT)是广泛存在于动植物体内的一类重要的吲哚类化合物,研究发现,MT在植物生理调节、增强植物抗逆性方面起着非常重要的作用,可以缓解重金属、盐离子等化学物质、紫外辐射、温度变化等逆境对植物的损害,赋予植物抵抗不良环境的能力[10-12]。通过添加MT可以缓解各逆境对植物的胁迫作用。外源添加MT可以增加黄瓜(Cucumissativus)种子在干旱胁迫下的萌发率[13]。外源MT可以通过调控碳氮平衡和脯氨酸代谢来增强紫花苜蓿对干旱的胁迫响应[14]。但通过引发处理研究MT调控苜蓿种子发芽特性的研究很少,需要探索MT缓解盐胁迫的适宜引发浓度和时间。
紫花苜蓿作为一种适应性强、蛋白质含量高、产量高的豆科牧草,在人工草地建设和草地畜牧业生产中发挥着重要作用。敖汉苜蓿(M.sativacv. Aohan)是适宜旱作栽培的地方品种,抗旱、抗寒性强,具有抗风沙、耐瘠薄的特性。随着我国振兴奶业苜蓿发展行动、粮改饲和草牧业政策的实施,苜蓿种植的规模迅速增长,据全国畜牧总站统计,到2016年紫花苜蓿保留面积437万hm2,在我国草产业和畜牧业发展中具有重要作用。本试验采用混合盐溶液和碱性盐溶液模拟土壤盐胁迫,通过MT引发研究敖汉苜蓿种子耐盐性和提高种子萌发能力的适宜处理方法,对于确保苜蓿草地的成功建植具有重要的理论指导作用和生产价值。
1 材料与方法
1.1试验材料
敖汉苜蓿种子(表1),2015年收获于内蒙古赤峰市敖汉旗。
表1 敖汉苜蓿种子样品信息 单位:%

初始含水量正常种苗不正常种苗死种子硬实种子6.4722818
1.2试验设计与处理
选取均匀一致的敖汉苜蓿种子100粒进行引发处理,MT溶液浓度为50,100μmol·L-1。重复4次,4 ℃黑暗下,分别在15 mL引发溶液中浸泡6 h、12 h。浸泡结束后用蒸馏水快速冲洗种子10次,用滤纸吸干种子表面水分,然后回干至种子原始含水量备用。
盐胁迫处理采用混合盐溶液和碱性盐溶液。将NaCl、Na2SO4、NaHCO3、Na2CO3粉末按照1∶1∶1∶1的摩尔比混合,配制成100 mL混合盐溶液,记为S,每组内设置5个浓度梯度,溶液中总盐浓度依次为0,25,50,100,150 mmol·L-1,分别记为ck,25 S,50 S,100 S,150 S(表2)。NaHCO3、Na2CO3粉末按照1∶1的摩尔比混合,配制成100 mL碱溶液,记为J,每组内设置5个浓度梯度,溶液中总盐浓度依次为0,25,50,100,150 mmol·L-1,分别记为ck,25 J,50 J,100 J,150 J(表3)。
表2 混合盐溶液的盐分组成、摩尔比及pH值
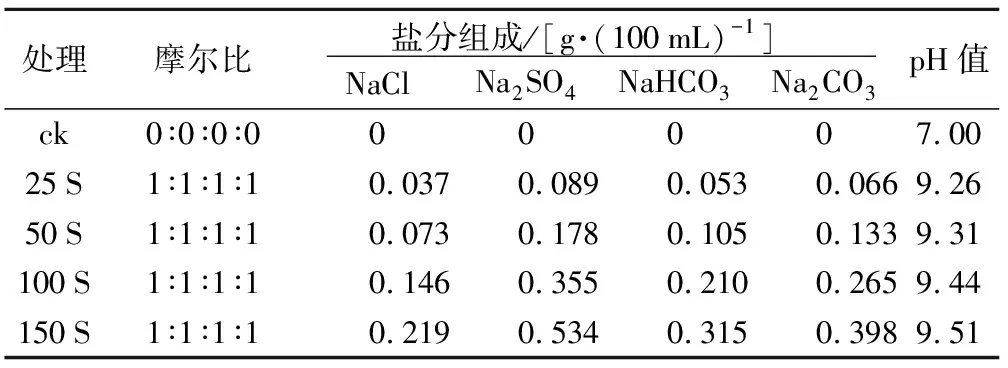
处理摩尔比 盐分组成/[g·(100mL)-1] NaClNa2SO4NaHCO3Na2CO3pH值ck0∶0∶0∶000007.0025S1∶1∶1∶10.0370.0890.0530.0669.2650S1∶1∶1∶10.0730.1780.1050.1339.31100S1∶1∶1∶10.1460.3550.2100.2659.44150S1∶1∶1∶10.2190.5340.3150.3989.51
表3 碱性盐溶液组成、摩尔比及pH值
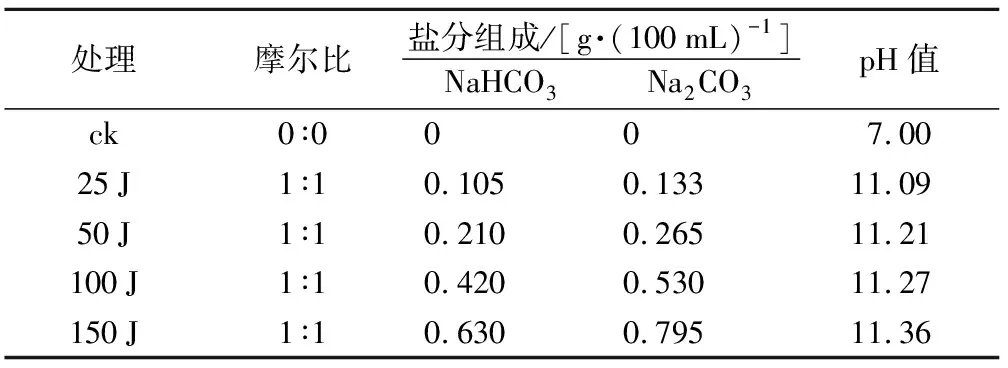
处理摩尔比盐分组成/[g·(100mL)-1]NaHCO3Na2CO3pH值ck0∶0007.0025J1∶10.1050.13311.0950J1∶10.2100.26511.21100J1∶10.4200.53011.27150J1∶10.6300.79511.36
1.3发芽试验
参照牧草种子检验规程GB/T 2930.4—2001,选取均匀饱满一致的紫花苜蓿种子400粒,将其放入铺有3层滤纸的培养皿(规格为11.5 cm×11.5 cm)中,每皿放置100粒,重复4次。将培养皿置于光照培养箱(GXZ-300 A)中,在20 ℃恒温、光照8 h和黑暗16 h条件下培养。试验中,每个培养皿加入15 mL相应盐溶液,并采取称重的方法保持溶液浓度不变。初次计数为第4天,末次计数为第10天,每日记录胚根伸出种皮2 mm的种子数,最终统计正常种苗数、每日新发芽的种子数(胚根伸出种皮至少2 mm),按以下公式计算种子发芽率、平均发芽时间。
发芽率(%)=(发芽期间全部正常种苗数/供试种子总数)×100%;
平均发芽时间(d)=∑nt/n;
其中,n为新发芽种子数(胚根伸出种皮至少2 mm),t为从设置发芽开始的时间(d)。
1.4种苗生长指标测定
发芽10 d结束后,随机选取20株种苗测量长度(cm)和鲜重(g),重复4次。
1.5数据统计分析
试验数据通过使用SPSS 13.0软件进行单因素方差分析(ANOVA)后做平均值多重比较(Duncan),显著水平为0.05。
2 结果与分析
2.1不同盐溶液处理对敖汉苜蓿种子发芽率的影响
不同浓度的盐溶液处理后,随着溶液浓度的升高敖汉苜蓿种子的发芽率呈逐渐下降的趋势(表4)。与对照相比,处理25 S可以显著提高苜蓿种子发芽率,其他处理的种子发芽率均显著降低。当盐溶液浓度超过100 mmol·L-1时,100 S、100 J、150 S、150 J处理种子发芽率降至最低,且处理间差异不显著。
表4 盐溶液处理对敖汉苜蓿种子发芽率的影响

盐处理 发芽率/% ck80b25S83a25J67c50S55d50J12e100S5f100J4f150S5f150J6f
注:同列平均值标注不同字母间差异显著(p<0.05)。
当盐溶液浓度为25 mmol·L-1和50 mmol·L-1时,处理25 J与25 S、50 J与50 S相比,种子发芽率显著下降,高pH值对于种子发芽的抑制效果明显。当盐溶液浓度为100,150 mmol·L-1时,处理100 J与100 S、150 J与150 S相比,种子发芽率差异不显著,且苜蓿种子发芽率不超过6%。高pH值、高盐浓度的显著(p<0.05);“*”代表同样的处理条件下引发时间之间差异显著(p<0.05)。下同。
表5 MT引发对盐胁迫敖汉苜蓿种子发芽的影响
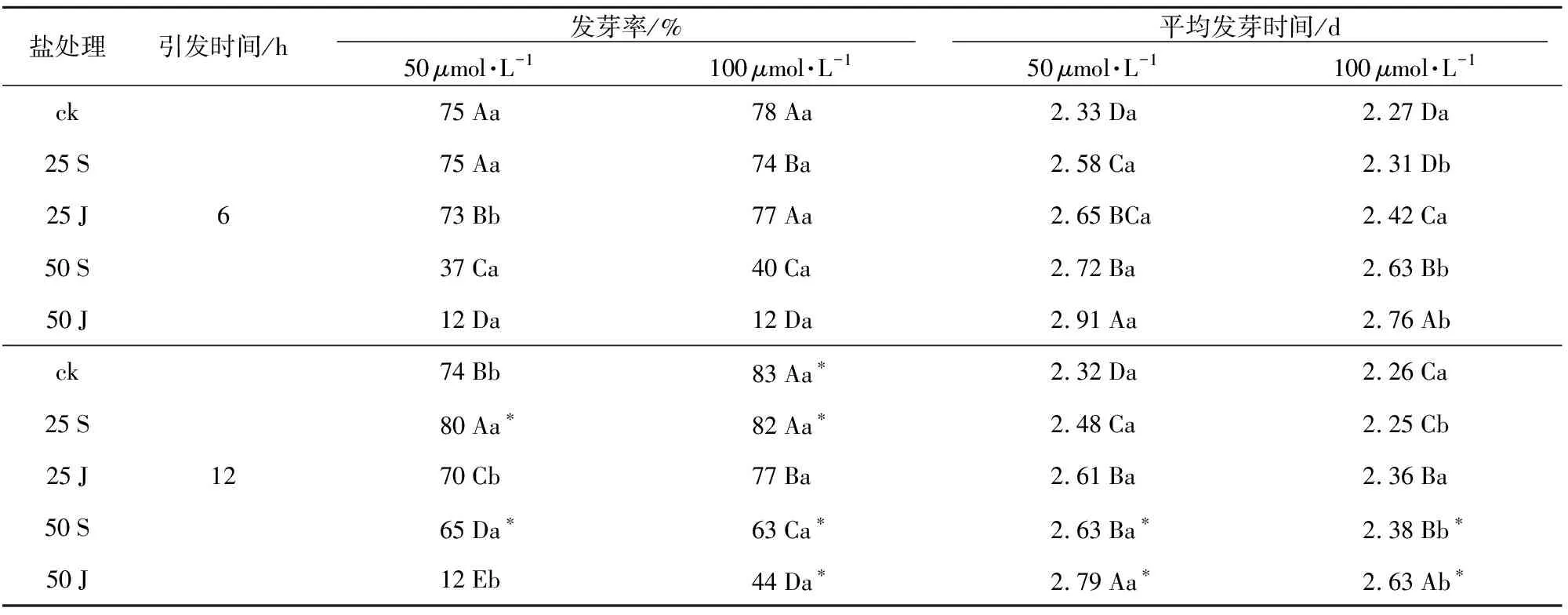
盐处理引发时间/h 发芽率/% 平均发芽时间/d 50μmol·L-1100μmol·L-150μmol·L-1100μmol·L-1ck75Aa78Aa2.33Da2.27Da25S75Aa74Ba2.58Ca2.31Db25J673Bb77Aa2.65BCa2.42Ca50S37Ca40Ca2.72Ba2.63Bb50J12Da12Da2.91Aa2.76Abck74Bb83Aa∗2.32Da2.26Ca25S80Aa∗82Aa∗2.48Ca2.25Cb25J1270Cb77Ba2.61Ba2.36Ba50S65Da∗63Ca∗2.63Ba∗2.38Bb∗50J12Eb44Da∗2.79Aa∗2.63Ab∗
注:同一列不同大写字母表示盐处理间差异显著(p<0.05);同行同一指标(发芽率,平均发芽时间)内不同小写字母表示引发浓度间差异
处理条件均抑制种子的发芽。
2.2MT引发对盐胁迫敖汉苜蓿种子发芽率的影响
通过MT引发,敖汉苜蓿种子经不同盐溶液处理后测定结果(表5)表明,发芽率变化受引发时间和引发浓度的影响。在不同浓度MT引发6 h时,种子发芽率的变化趋势与未引发处理相似。经50μmol·L-1引发后,处理25 S种子发芽率最高,与对照之间差异不显著。100μmol·L-1引发时,处理25 J的发芽率与对照无显著差异,但显著(p<0.05)高于其他处理。处理50 J种子发芽率最低(12%),且显著低于处理50 S的发芽率(40%)。在不同引发浓度中,只有在处理25 J时,100μmol·L-1引发种子发芽率显著高于50μmol·L-1引发,其他盐溶液处理中引发浓度之间发芽率无显著差异。在引发12 h时,种子发芽率的变化与未引发处理相似。处理25 S种子发芽率最高,且显著高于其他胁迫处理后的种子发芽率,处理50 J的种子发芽率最低。但在处理25 J、50 J中,100μmol·L-1引发的种子发芽率显著高于50μmol·L-1引发。
引发6 h和12 h各盐溶液处理种子发芽率结果比较表明(表5),处理25 S和50 S中,与引发6 h相比,引发12 h可以显著提高种子的发芽率。但对于处理50 J,只有在100μmol·L-1MT引发12 h时才能显著提高种子的发芽率。
2.3MT引发对盐胁迫敖汉苜蓿种子平均发芽时间(MGT)的影响
通过MT引发,经盐溶液处理敖汉苜蓿种子呈现规律性变化。MGT测定结果(表5)表明,在不同浓度MT引发6 h时,随着盐浓度的增加,MGT也逐渐延长,处理50 J的种子MGT最长,且与其它盐溶液处理间有显著差异。经50μmol·L-1引发后,处理25 J与25 S间MGT差异不显著;而经100μmol·L-1引发后,处理25 J与25 S间MGT差异显著。此外,在处理25 S、50 S、50 J中,与50μmol·L-1引发相比,经100μmol·L-1引发后MGT均显著降低。在不同浓度MT引发12 h时,MGT的变化规律与MT引发6 h类似。但处理25 J与25 S、50 J与50 S相比,MGT均显著延长。
引发6 h和12 h后各盐溶液处理种子MGT结果(表5)表明,与MT引发6 h相比,只有处理50 S和50 J在引发12 h时可以显著缩短种子的MGT,其他处理间没有显著(p>0.05)差异。
2.4MT引发对盐胁迫敖汉苜蓿种苗长度的影响
通过MT引发,敖汉苜蓿种子经不同盐溶液处理后结果(表6)表明,种苗长度呈现规律性变化。在50μmol·L-1和100μmol·L-1引发6 h时,随着胁迫处理浓度的增加,种苗长度逐渐变短,均在处理50 J时降到最低,且盐溶液处理间种苗长度差异显著(p<0.05)。在对照组和处理25 S、50 J条件下,100μmol·L-1引发的苗长分别显著高于50μmol·L-1引发的苗长。在不同浓度MT引发12 h时,随着盐处理浓度的增加,种苗长度显著变短,均在处理50 J时降到最低。但在对照组和处理25 S条件下,100μmol·L-1引发的苗长分别显著高于50μmol·L-1引发的苗长。
引发6 h和12 h后各盐溶液处理种苗长度结果比较表明(表6),与引发6 h相比,引发12 h后各处理种苗长度均显著增加。
表6 MT引发对盐胁迫敖汉下苜蓿种苗生长的影响
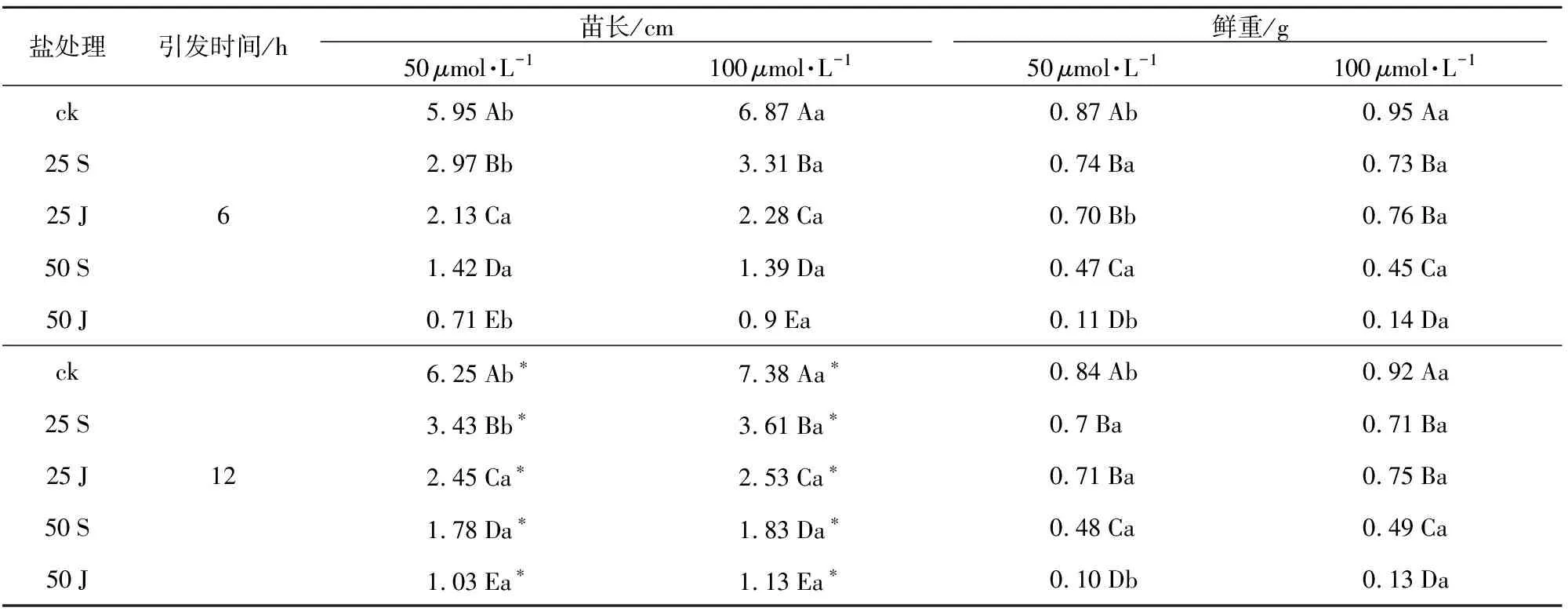
盐处理引发时间/h 苗长/cm 鲜重/g 50μmol·L-1100μmol·L-150μmol·L-1100μmol·L-1ck5.95Ab6.87Aa0.87Ab0.95Aa25S2.97Bb3.31Ba0.74Ba0.73Ba25J62.13Ca2.28Ca0.70Bb0.76Ba50S1.42Da1.39Da0.47Ca0.45Ca50J0.71Eb0.9Ea0.11Db0.14Dack6.25Ab∗7.38Aa∗0.84Ab0.92Aa25S3.43Bb∗3.61Ba∗0.7Ba0.71Ba25J122.45Ca∗2.53Ca∗0.71Ba0.75Ba50S1.78Da∗1.83Da∗0.48Ca0.49Ca50J1.03Ea∗1.13Ea∗0.10Db0.13Da
2.5MT引发对盐胁迫敖汉苜蓿种苗鲜重的影响
通过MT引发,敖汉苜蓿种子经不同盐溶液处理后结果(表6)表明,种苗鲜重呈现规律性变化。在50μmol·L-1和100μmol·L-1引发6 h时,对照种苗鲜重最高,随着胁迫浓度的增加,种苗鲜重逐渐下降,均在处理50 J时降到最低,且盐溶液处理50 S和50 J间种苗鲜重差异显著,但处理25 S和25 J间种苗鲜重差异不显著。在对照和处理25 J、50 J条件下,100μmol·L-1引发的种苗鲜重分别显著高于50μmol·L-1引发的种苗鲜重。在不同浓度引发12 h时,对照种苗鲜重最高,随着盐浓度的增加显著下降,均在处理50 J时降到最低。且盐溶液处理50 S和50 J间种苗鲜重差异显著,但处理25 S和25 J间种苗鲜重差异不显著。在对照组和处理50 J条件下,100μmol·L-1引发的种苗鲜重分别显著高于50μmol·L-1引发的种苗鲜重。
引发6 h和12 h后各盐溶液处理种苗鲜重结果(表6)表明,与引发6 h相比,引发12 h后各处理种苗鲜重均无显著差异。
3 讨 论
随着盐浓度增加,盐碱胁迫会对种子发芽率造成影响[15]。在较低盐浓度情况下,盐溶液可提高苜蓿种子发芽率,但当盐浓度增大超过了种子能够承受的范围,就会抑制种子发芽甚至造成种子死亡。低浓度盐碱胁迫促进菠菜(Spinaciaoleracea)和大豆(Glycinemax)种子发芽[16-17],并且低浓度的盐分促进苜蓿种子发芽与幼苗发育[1,3]。本试验研究也发现相似的结果,在低盐溶液浓度25 mmol·L-1(25 S)时,敖汉苜蓿种子发芽率显著高于对照。随着盐浓度的提高,在高盐浓度100,150 mmol·L-1(100 S、100 J、150 S、150 J)时,苜蓿种子发芽率降至最低,不超过6%。因此,敖汉苜蓿种子可以在小于50 mmol·L-1混合盐溶液中进行发芽。
研究表明,低浓度的盐处理促进紫花苜蓿种子发芽,高浓度抑制发芽,碱性盐胁迫越高对种子活力抑制作用越大[4]。与盐胁迫比较,碱胁迫对苜蓿种子发芽的影响更明显。紫花苜蓿在碱胁迫条件下种子萌发受到影响,生物量积累减少[2]。黄花苜蓿种子随着盐、碱浓度增加发芽率降低,发芽时间增加,且碱胁迫作用更明显[5]。本试验采用混合盐处理,随着盐溶液浓度的增加,相应的溶液pH值也增加,混合盐溶液pH值为9.26~9.51,而碱性混合盐溶液pH值为11.09~11.36。盐浓度25,50 mmol·L-1时,与混合盐(25 S、50 S)处理相比,碱性盐(25 J、50 J)处理显著降低种子的发芽率。说明碱性盐溶液在较低浓度时,也抑制种子发芽,随着溶液浓度逐渐增大,种子发芽抑制作用明显。在多种盐碱胁迫中,Na2CO3对种子发芽的抑制作用十分显著,当Na2CO3浓度为50 mmol·L-1时,种子不能发芽甚至全部死亡[18]。胡宗英认为在不同混合盐碱胁迫情况下,随着碱性盐溶液的浓度增大,Na+与pH值协同作用,当Na2CO3浓度为50 mmol·L-1时紫花苜蓿种子全部死亡[19]。敖汉苜蓿种子发芽结果也说明,在混合盐胁迫中,溶液pH值越高对于种子发芽影响越大,高pH胁迫是种子萌发抑制的主要因子。
种子萌发时期是植物受盐碱胁迫影响最大的时期,种子吸胀期间对于外界环境敏感。通过引发处理可以提高种子的抗逆性和出苗率[20-21]。MT具有自由基清除作用,可以减轻逆境条件下植物受到的氧化伤害。因此,利用MT引发处理研究种子萌发的耐盐性,对于提高种子抗逆性和种子发芽能力具有重要意义。但MT引发浓度和时间条件与植物种类和盐碱溶液有关。敖汉苜蓿种子经100μmol·L-1引发12 h处理后,可以减缓盐胁迫的影响,阻止种子发芽率的下降,其中对50 mmol·L-1混合盐溶液的改善效果明显,并且100μmol·L-1引发比50μmol·L-1引发对碱性混合盐(25 J、50 J)胁迫的抑制作用更有效。张娜等采用NaCl溶液(浓度为0,50,100,150,200 mmol·L-1)、MT溶液(浓度为100,300,500,1 000μmol·L-1)处理杂交狼尾草(PennisetumamericanumxP.purpureum)种子,研究发现,盐胁迫大大降低了杂交狼尾草种子的发芽势,且抑制程度随NaCl浓度增加而增加,150 mmol·L-1和200 mmol·L-1NaCl处理种子发芽势均降到了50%左右。而在150 mmol·L-1NaCl溶液基础上,添加不同浓度的MT溶液,结果显示100,300,500μmol·L-1MT均可程度不同缓解NaCl溶液的萌发抑制作用,但1 000μmol·L-1MT却加剧了种子萌发抑制作用[22]。研究发现,MT能够显著提高盐胁迫下黄瓜种子的发芽率[23]。另外,李爱等利用PEG模拟干旱胁迫,研究比较MT处理紫苏(Perillafrutescens)种子的萌发特性,结果表明,紫苏种子萌发受到干旱的显著抑制,不同浓度的MT处理可以提高种子发芽能力,其中10%PEG+50μmol·L-1处理发芽率、发芽势等指标达到最高[24]。不同浓度MT引发种子的效果不同,100μmol·L-1处理冬小麦(Triticumaestivum)种子,可以提高其抵抗干旱胁迫的能力[25]。通过比较说明,植物种子对于盐碱胁迫的耐受性不同,相应地MT处理的浓度和时间也不完全相同,但适宜的MT浓度对于缓解盐溶液的胁迫具有显著的效果。
平均发芽时间(MGT)是反映种子活力的重要指标之一,其值越大,表明种子活力和田间出苗率越低[26]。在玉米(Zeamays)[27]、燕麦(Avenasativa)[28]、多花黑麦草(Loliummultiflorum)[29]种子研究表明,利用MGT指标可以预测田间出苗和幼苗生长情况。当50,100μmol·L-1引发6 h和12 h时,随着盐胁迫的增强,MGT均呈逐渐延长的趋势,但100μmol·L-1引发或者引发12 h,均可以显著缩短50 mmol·L-1混合盐溶液(50 S、50 J)胁迫种子的MGT。MT引发对于高浓度和高pH混合盐溶液胁迫具有明显的缓解作用。此外,随着混合盐浓度的提高,敖汉苜蓿种子发芽率也表现出类似的变化,100μmol·L-1引发12 h时可以有效缓解盐胁迫对于种子发芽的抑制作用,表现在种子发芽率提高和MGT缩短。
在不同浓度的混合盐溶液胁迫作用下,敖汉苜蓿种苗苗长和鲜重的变化均在50 J降至最小。种苗长度变化对于混合盐浓度和pH值更敏感,高浓度、高pH值均抑制种苗长度。但种苗鲜重仅在高浓度和高pH值时受到明显抑制。不同浓度MT引发对于种苗苗长、鲜重的作用不同,100μmol·L-1引发可以显著促进盐溶液25 S种苗的苗长和50 J种苗的鲜重。MT引发时间对于种苗苗长和鲜重的作用效果不同。MT引发12 h与6 h相比,可以显著促进种苗长度而种苗鲜重无显著变化。研究表明,引发时间不同向日葵(Helianthusannuus)种子的引发效果也不同,引发时间为12 h的发芽率显著高于引发时间为4 h的种子,但是引发时间过长发芽率下降[30]。
4 结 论
4.125 mmol·L-1混合盐溶液(NaCl、Na2SO4、NaHCO3、Na2CO3混合)促进敖汉苜蓿种子发芽,浓度超过100 mmol·L-1混合盐溶液和碱性盐溶液(NaHCO3、Na2CO3混合)抑制种子发芽,且pH>11.0盐溶液抑制作用更明显。
4.2综合各项测定指标,100μmol·L-1引发12 h时可以有效缓解混合盐溶液和高pH盐溶液(pH>11.0)胁迫作用,表现在种子发芽率提高、MGT缩短、种苗长度和鲜重增加。
