熊果苷对膀胱癌EJ-1细胞增殖的影响及其机制研究
2019-07-12郭锦辉高卫芳邓智建
郭锦辉, 高卫芳, 邓智建
(新乡医学院第一附属医院药学部,河南新乡 453100)
膀胱癌在发生发展的任何阶段均能够在几个月内发生快速的肿瘤进展和转移[1]。由于膀胱癌的高复发率,手术或者外部放射治疗一直是治疗的主要手段[2],但其副作用较大[3,4]。目前,中药提取物治疗肿瘤成为研究热点。熊果苷(氢醌-O-β-D-吡喃葡萄糖苷)是从熊果的树皮和叶子中提取的物质[5]。研究表明,熊果苷可抑制哺乳动物黑色素生成的限速酶酪氨酸酶[6],被广泛用于治疗皮肤色素沉着异常症状(如黄褐斑和雀斑),也被用于生产部分皮肤美白化妆品[7,8]。且临床已证实熊果苷在人体内是安全的,没有明显的毒副作用[9]。既往有研究表明,熊果苷具有作为抗肿瘤剂的潜在作用,可有效抑制膀胱癌细胞的转移行为[10]。为进一步探讨熊果苷在膀胱癌治疗中的作用,我们从细胞周期调控角度观察熊果苷对膀胱癌细胞EJ-1增殖的影响,现将研究结果报道如下。
1 材料与方法
1.1 细胞株及培养 人膀胱癌细胞EJ-1获自武汉大学细胞培养物中心。于含体积分数10%胎牛血清的RPMI 1640培养基中37℃、体积分数5%CO2条件下培养。
1.2 药物、试剂与仪器 熊果苷购自美国Sigma公司。四甲基偶氮唑盐(MTT)购自美国Sigma公司;细胞外信号调节激酶(ERK)和磷酸化ERK(p-ERK)抗体购自美国Abcam生物公司;细胞周期蛋白(Cyclin D1)、p21购自美国圣克鲁斯生物技术公司。全波长酶标仪(美国Thermo Scientific公司);流式细胞仪(美国Beckman Coulter公司);Western blot转印仪、电泳凝胶图像分析仪(美国Bio-Rad公司)。
1.3 MTT法测定EJ-1细胞增殖能力 将EJ-1细胞以2×106/孔接种在6孔板中培养24 h后分为6组,除对照组之外,其余各组分别加入10、20、50、100、500 μg/mL熊果苷处理24 h后,每孔加5 mg/mL MTT溶液(用PBS配)20 μL。继续孵育4 h,终止培养。小心吸弃孔内培养上清液,振荡10 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫监测仪上测定各孔吸光度(D)值,记录结果。细胞增殖抑制率(%)=(对照组D值-实验组D值)/对照组D值×100%。再以同样方法,测定100 μg/mL熊果苷作用EJ-1细胞24、48、72、96 h的细胞增殖抑制率。
1.4 流式细胞术检测细胞周期和细胞凋亡 将EJ-1细胞以2×106/孔接种在6孔板中培养24 h后,加入100 μg/mL熊果苷作用细胞24、48、72、96 h后,以胰蛋白酶消化制成单细胞悬浮液;将细胞调至5×105~1×106个细胞/管,并重悬于2 mL冰磷酸盐缓冲液(PBS)中。收集细胞使其在乙醇4℃孵育1h后,除去乙醇,PBS清洗3次。将200μL PBS和2 μL核糖核酸酶溶液(0.25 mg/mL)加入到每个试管中于室温处理30 min。再加入0.5 mL 50 μg/mL的碘化丙啶溶液室温避光染色30 min,通过流式细胞术评估细胞周期变化。细胞增殖指数(PI)按照下列公式计算:PI(%)=(S期+G2期/M期)/(G0期/G1期+S期+G2期/M期)。以亚G1峰比值分析细胞凋亡情况。
1.5 蛋白免疫印迹(Western blot)法检测ERK、p-ERK、Cyclin D1、p21蛋白的表达 将EJ-1细胞(2×105)在60 mm培养皿中培养,使用无血清培养基饥饿24 h,用熊果苷(100 μg/mL)处理96 h。加入细胞裂解物及完整的蛋白酶抑制剂混合物提取蛋白。将样品以12%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移至聚偏二氟乙烯(PVDF)膜,于含有0.5%Tween20的PBS中加入5%脱脂奶粉进行封闭,孵育20 min后,稀释度为 1∶1 000的一抗(ERK、p-ERK、Cyclin D1、p21)4℃孵育过夜,室温充分冲洗后使用二抗孵育2 h,显影,最后用凝胶成像系统检测。实验重复3次。
1.6 统计方法 采用GraphPad Prism软件进行数据分析。实验数据以均数±标准差(-x±s)表示,组间比较采用Student t-检验法。以P<0.05为差异有统计学意义。
2 结果
2.1 不同质量浓度熊果苷对EJ-1细胞增殖的影响 图1结果显示:不同质量浓度(10、20、50、100、500 μg/mL)熊果苷作用 EJ-1细胞24 h后,50、100 μg/mL熊果苷对EJ-1细胞增殖有明显的抑制作用(P<0.05),其中100 μg/mL增殖抑制作用最强。故选取100 μg/mL的熊果苷进行后续实验的检测。
2.2 不同作用时间熊果苷对EJ-1细胞增殖的影响 图2结果显示:以100 μg/mL熊果苷作用EJ-1细胞24、48、72、96 h后,以MTT法测定EJ-1细胞增殖能力。EJ-1细胞增殖抑制率分别为51.3%、71.9%、82.6%、92.8%。表明熊果苷以时间依赖性的方式抑制EJ-1细胞的增殖。
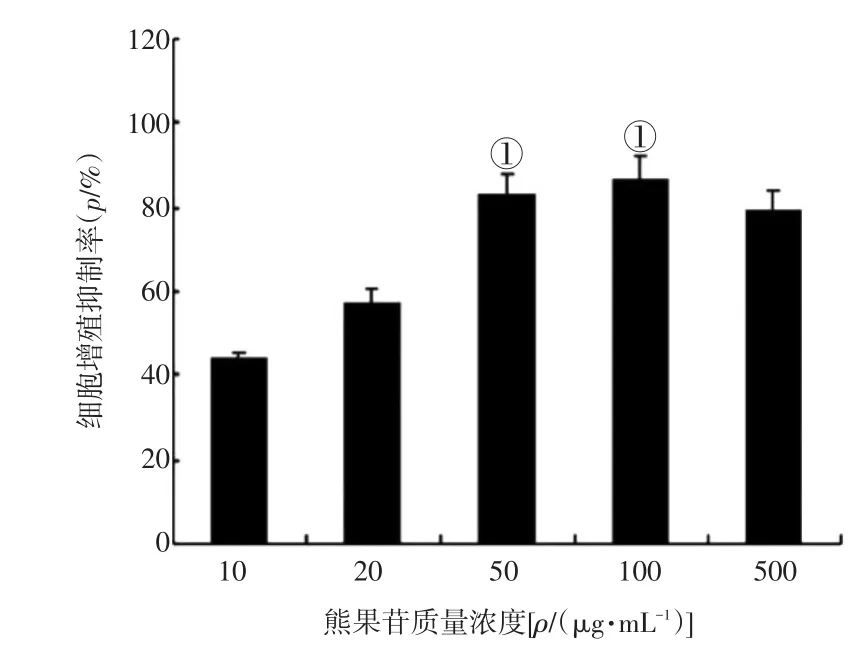
图1 不同质量浓度熊果苷对EJ-1细胞增殖能力的影响Figure 1 The effect of different mass concentrations of arbutin on the proliferation capacity of EJ-1 cells(-x±s)
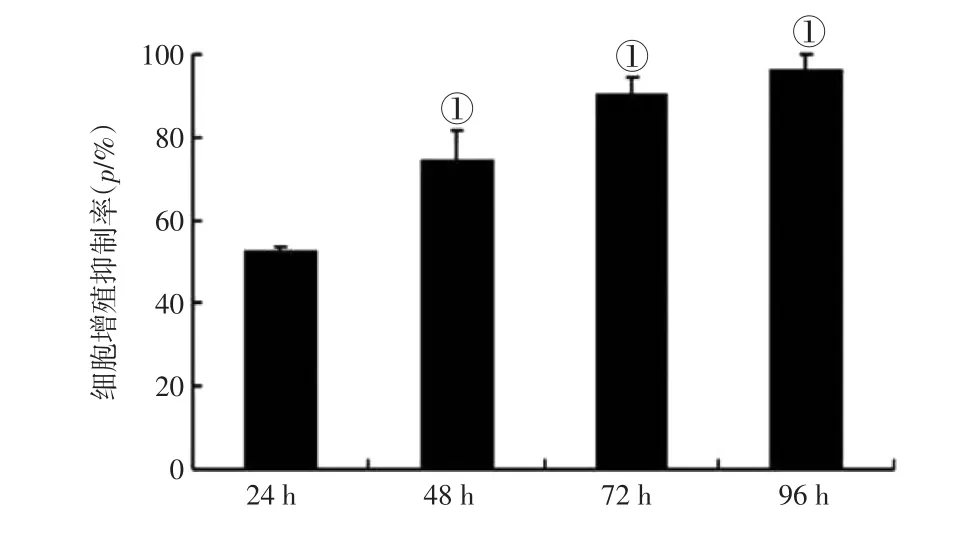
图2 100 μg·mL-1熊果苷不同作用时间对EJ-1细胞增殖能力的影响Figure 2 The effect of arbutin at 100 μg·mL-1on the proliferation capacity of EJ-1 cells at different treatment time (-x±s)
2.3 熊果苷对EJ-1细胞周期及细胞凋亡的影响 采用流式细胞术观察熊果苷对EJ-1细胞周期及细胞凋亡的影响。表1结果显示:随着时间的进展,EJ-1细胞中G0/G1期细胞百分比逐渐升高,G2/M期细胞百分比逐渐降低。熊果苷作用96 h的EJ-1细胞PI明显降低,与处理24~48 h的细胞PI比较,差异有统计学意义(P<0.05)。表明熊果苷可干扰EJ-1细胞的周期进展,具有时间依赖性,将细胞阻滞于G2/M期。同时,随着时间的进展,亚G1峰值逐渐升高,96 h时最为明显(P<0.05)。表明熊果苷可促进EJ-1细胞凋亡,且呈时间依赖性。
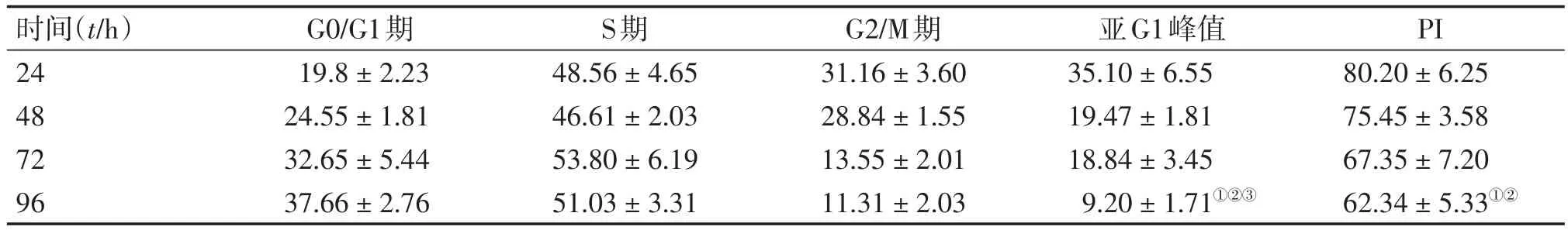
表1 不同作用时间熊果苷对EJ-1细胞周期的影响Table 1 The effect of arbutin on the cell cycle of EJ-1 cells at different treatment time (-x±s,p/%)
2.4 熊果苷对EJ-1细胞p-ERK、ERK、Cyclin D1、p21蛋白的影响 以100 μg/mL熊果苷作用EJ-1细胞0、24、48、72、96 h后,采用Western blot法检测细胞周期相关蛋白p-ERK、ERK、Cyclin D1、p21蛋白的表达水平。图3、表2结果显示:与同组0 h比较,作用24、48、72、96 h后,p-ERK蛋白表达水平均降低(P<0.05),呈逐渐下降后再升高的趋势。ERK蛋白表达水平均降低,但差异无统计学意义(P>0.05)。Cyclin D1蛋白表达水平均升高(P<0.05),呈逐渐升高后再下降的趋势。p21蛋白表达水平随时间延长逐渐升高,于96 h差异有统计学意义(P<0.05)。
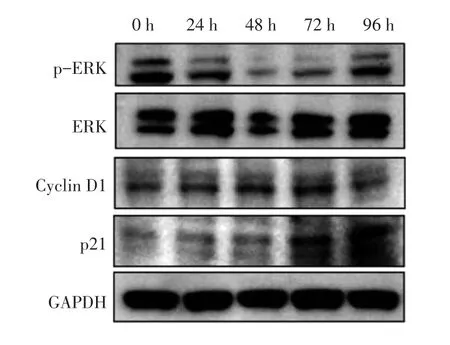
图3 EJ-1细胞p-ERK、ERK、Cyclin D1、p21凝胶电泳图Figure 3 The gel electrophoresis image of p-ERK,ERK,Cyclin D1,and p21 in EJ-1 cells

表2 不同作用时间熊果苷对EJ-1细胞p-ERK、ERK、Cyclin D1、p21蛋白表达的影响Table 2 The effect of arbutin on the expression of p-ERK,ERK,Cyclin D1,and p21 of EJ-1 cells at different treatment time (-x±s,p)
3 讨论
在亚洲,膀胱癌每年有15.3万的新发膀胱癌病例和3.5万人死亡;在我国,2015年新增膀胱癌患者人数估计为2.3万人,死亡人数估计为1.1万人[11,12]。膀胱癌可以分为非肌肉浸润性肿瘤和肌肉浸润性肿瘤2类[13]。尽管70%~80%的患者被诊断为非肌层浸润性肿瘤,但是在这些患者中观察到明显的高复发率(50%~70%),而在复发病例中,15%的膀胱癌患者发展为肌肉浸润性疾病[14,15]。非肌层浸润性膀胱癌患者的5年生存率接近90%,而肌层浸润性膀胱癌患者的5年生存率约为60%[16],近80%的淋巴结转移患者在头5年内死亡[17]。由于多数针对晚期膀胱癌的西医治疗的临床试验效果有限,所以开发更安全有效的治疗药物十分必要。
研究表明,熊果苷可以作为天然分子结合受体与miRNA结合并参与其表达调控过程,影响细胞自身的增殖和凋亡行为[18]。本研究结果显示:100 μg/mL熊果苷对EJ-1细胞增殖的抑制作用最佳,且呈时间依赖性。100 μg/mL熊果苷作用96 h的EJ-1细胞PI下降,与处理24~48 h的细胞PI比较,差异有统计学意义(P<0.05)。亚G1峰值逐渐升高,96 h时最为明显(P<0.05)。表明熊果苷可干扰EJ-1细胞的周期进展,具有时间依赖性,可将细胞阻滞于G2/M期,并促进细胞凋亡。
已知ERK蛋白信号传导途径在细胞增殖中起关键作用[19],参与了细胞周期调控[20]。细胞周期蛋白Cyclin D1是通过G1期的细胞周期进展的限速和关键因子[21]。细胞周期蛋白依赖性激酶抑制剂p21也可以参与细胞周期调控[22]。p21的表达增加可能诱导细胞周期停滞和随后的细胞生长抑制[23]。本研究结果显示:与同组0 h比较,作用24、48、72、96 h后,p-ERK蛋白表达水平均降低(P<0.05),呈逐渐下降后再升高的趋势;ERK蛋白表达水平均降低,但差异无统计学意义(P<0.05);Cyclin D1蛋白表达水平均升高(P<0.05),呈逐渐升高后再下降的趋势;p21蛋白表达水平随时间延长逐渐升高,于96 h差异有统计学意义(P<0.05)。表明熊果苷处理膀胱癌EJ-1细胞后可抑制ERK蛋白的磷酸化进程。由于ERK通路是主要的促有丝分裂信号,因此,熊果苷对ERK信号通路途径的灭活似乎对其抗增殖作用有直接的干扰,其具体作用环节还需进一步研究。
综上所述,我们研究了熊果苷对膀胱癌EJ-1细胞的抗增殖作用及相关机制,研究结果表明熊果苷可抑制膀胱癌EJ-1细胞的增殖,其机制可能与抑制细胞周期相关蛋白ERK和p21蛋白的表达有关。本研究拓展了中药提取物熊果苷的应用价值,也为临床应用熊果苷治疗膀胱癌奠定了基础。
