苜蓿冰结构蛋白对冷冻面团质地的影响
2019-07-10陈凤莲李亚楠范洪臣
曲 敏,孙 玥,陈凤莲,李亚楠,田 野,吴 征,范洪臣
(哈尔滨商业大学食品工程学院,黑龙江省普通高等学校食品科学 与工程重点实验室,黑龙江哈尔滨 150076)
冷冻面团技术是20世纪发展起来的食品加工新技术,解决了传统面食保质期短、易变质的现象[1]。但冷冻面团在冻藏和运输过程中,由于冰晶和重结晶的形成破坏了面筋蛋白结构[2-3]。同时由此产生的水分迁移也导致蛋白质脱水收缩,引起化学键变化及蛋白质变性[4-5]。向冷冻面团中添加乳化剂、凝胶剂等添加剂可适当改善面团的网络结构和抗冻能力[6-7],但这些添加剂只能减少面团中水分活度,减少压力造成的水冻结,而对冰晶的作用很小,对面筋蛋白的保护作用也受到了限制。
冰结构蛋白(Ice structuring proteins,ISPs),又称为抗冻蛋白(Antifreeze proteins,AFPs)或热滞蛋白(Thermal hysteresis proteins,THPs),是生物体为抵御外界寒冷环境而产生的一种蛋白质[8-9]。由于其独特的能力使溶液冰点和熔点分离,非依数性的降低冰点,而对溶液的熔点影响甚微,冰点与熔点之间出现的差值为热滞活性(Thermal hysteresis activity,THA),且ISPs能与冰表面产生不可逆的结合,具有修饰冰晶形态和抑制冰晶重结晶的能力。目前已经在鱼类、昆虫、真菌细菌以及植物中发现了ISPs的存在。尤其是植物ISPs具有低THA、高冰晶形态修饰及抑制重结晶的能力。将其应用于低温冷链食品中,将提高其质量、延长保质期。研究证明了ISPs应用在食品方面的安全性与可行性[10-11]。2006年我国卫生部公布了ISPs为新型添加剂可用于食品冷冻方面。Wang等[12]将ISPs添加于冰淇淋中,显微观察发现冰淇淋中冰晶细小均匀,与未添加组冰晶体积大存在显著差异;Ding等[13]研究了ISPs对冷冻面团持水力和烘焙特性的影响,发现ISPs能够显著加强冷冻面团的持水力并改善其烘焙特性。向冷藏的肉类制品中加入ISPs能有效的抑制冰晶形成,减少了肉制品的营养成分流失[14]。
紫花苜蓿(Medicagosativa),俗称金花菜,是重要的豆科牧草,亦可食用。其鲜品中蛋白含量高达18%以上。苜蓿耐寒能力极强,在-45 ℃极寒条件下返青率仍达到90%。本研究以苜蓿干草为原料提取苜蓿冰结构蛋白(alfalfa ice structuring protein,AISPs),并将其添加到冷冻面团中,检测冷冻面团质构特性、拉伸特性以及微观结构的变化,探究AISPs对冷冻面团的抗冻保护作用。
1 材料与方法
1.1 材料与仪器
“肇东”紫花苜蓿 黑龙江省蓬勃牧草有限公司;北大荒高筋面粉 黑龙江北大荒有限公司;磷酸二氢钠、磷酸氢二钠、硫酸铵、戊二醛、乙醇、叔丁醇 均为分析纯。
FW135多功能粉碎机 天津市泰斯特仪器有限公司;EMS-8B磁力搅拌器 天津欧诺仪器仪表有限公司;Z366高速大容量台式离心机 德国哈默公司;Q2000差示扫描热量仪 美国TA公司;TA-XT2i质构仪 英国Stable Micro System公司;Extensograph拉伸仪 德国Brabender公司;SU8010扫描电镜 日本日立公司;BS224S型电子分析天平 北京赛多利斯仪器系统有限公司;XK01恒温恒湿发酵箱 北京腾威机械有限公司;DM750生物显微镜 瑞士莱卡公司;BCD-206TADZ电冰柜 青岛海尔电器股份有限公司;ES-2030冷冻干燥仪、E-1010离子溅射镀膜仪 日本Hitachi公司。
1.2 实验方法
1.2.1 苜蓿蛋白的提取 参照曲敏等[15]的方法。利用磷酸缓冲溶液法从苜蓿干草中提取AISPs。取苜蓿干草,除去杂质和粗茎后粉碎,过80目筛,备用。以液料比20∶1与磷酸盐缓冲溶液(浓度63 mmol/L、pH7.7)混合,搅拌2 h后,8000 r/min离心15 min,得到蛋白提取液,将其边搅拌边缓慢加入固体硫酸铵至饱和,搅拌20 min,4 ℃放置2 h,8000 r/min离心10 min得到沉淀,将沉淀用浓度63 mmol/L的缓冲溶液溶解后,得到苜蓿蛋白溶液。将其透析脱盐,选取截留分子量为1000 Da的透析袋,将透析袋在pH为7.8的碱性EDTA溶液中煮沸30 min后用蒸馏水洗净。将蛋白液加入透析袋,在4 ℃磷酸盐缓冲溶液(浓度63 mmol/L)中进行脱盐,将透析袋内液在-45 ℃冰箱中冷冻24 h,转置冷冻干燥机干燥12 h,得到苜蓿蛋白粉。
1.2.2 苜蓿蛋白抗冻活性检测 参照曲敏等[15]的方法,使用差热分析仪(differential scanning calorimetry,DSC)进行测定热滞活性:取5 μL 20 mg/mL样品注入坩埚底部,以空坩埚为参比,以1 ℃/min的速率匀速降温至-20 ℃,平衡10 min,使样品完全冷冻且系统稳定,再以1 ℃/min的速率升温至10 ℃,根据样品熔融峰得到样品的熔点Tm和熔融焓ΔHm(即吸热峰面积)。以1 ℃/min的速率降温至-20 ℃,平衡10 min后,再以同样速率升温至保持温度Th。平衡10 min后,再以1 ℃/min降温至-20 ℃。记录降温后部分融化状态再次全部冻结产生的重结冰温度T0和结冰焓ΔHf(即结冰放热峰面积)。改变Th,重复实验,通过DSC曲线得到不同停留温度下的冰晶含量和样品的THA值与分析。
冰核含量和THA计算方法如下:
Φ=1-ΔHf/ΔHM
式(1)
式中:φ为样品中的冰核含量;ΔHf为停留温度停留后继续降温过程中体系的结晶焓;ΔHm为样品熔融焓。
THA=Th-T0
式(2)
式中:THA为样品的热滞活性,Th为停留温度,T0为不同停留温度下体系的开始结晶温度。
1.2.3 苜蓿蛋白溶液冰晶观察 将苜蓿蛋白粉配制成20 mg/mL溶液。分别取30 μL的蒸馏水、苜蓿蛋白溶液、20 mg/mL的NaCl溶液和蔗糖溶液于单洼玻片上冷冻30 min,迅速置于DM750生物显微镜上进行观察,并拍照,待其溶化后再次复冻,依此冻融4次。蒸馏水、NaCl溶液和蔗糖溶液为对照溶液,观察各溶液的冰晶大小及形态。
1.2.4 冷冻面团的制备及质地检测
1.2.4.1 冷冻面团的制备及冻融处理 称取一定量的面粉与AISPs冻干粉充分混合溶于水,制备成AISPs含量为分别为0、0.5%、1.0%、1.5%、2.0%、2.5%的面团(其中0的AISPs为对照组),放入-40 ℃低温冰箱速冻30 min,在将面团移入-18 ℃的冰箱中冷冻备用。一周后取出在恒温恒湿发酵箱内30 ℃、湿度75%条件下完全解冻至面团中心温度达到10 ℃,即为一个冻融周期,即1周次。将上述冷冻面团样品进行0、2、4、6、8、10个周次的冻融处理。
1.2.4.2 冷冻面团质构特性测定 采用P50柱形探头,在质构分析(Texture profile analysis,TPA)模式下分别设定下压前速度:3.00 mm/s,下压中速度:1.00 mm/s,下压后速度:1.00 mm/s,下压距离:4.00 mm,测定不同AISPs添加量、不同冻融周期冷冻面团的质构特性。
1.2.4.3 冷冻面团拉伸性测定 拉伸特性依据GB/T 14615-2006,运用Brabender拉伸仪进行,测定不同AISPs添加量、不同冻融周期冷冻面团的拉伸特性。
1.2.5 冷冻面团SEM结构表征 参照耿浩源速冻饺子皮SEM表征的方法,将冷冻后的面团样品用刀片切成2 mm×5 mm的小片。加入2.5%,pH6.8的戊二醛固定,置于4 ℃的冰箱中固定1.5 h以上。用0.1 mol/L pH6.8的磷酸缓冲液冲洗三次,每次10 min。分别用浓度为50%、70%、90%的乙醇进行脱水各一次,每次12 min,100%的乙醇脱水三次,每次12 min。将乙醇和叔丁醇混合液(100%乙醇∶叔丁醇=1∶1)和纯叔丁醇各进行脱水一次,每次15 min。将样品放入冷冻干燥仪干燥5 h。将干燥后样品粘在扫面电镜样品台上,用离子溅射镀膜仪镀上金属膜,置于扫描电镜下观察样品结构。
1.3 数据处理
试验数据均为平均值,并采用origin画图软件进行分析。
2 结果与分析
2.1 苜蓿蛋白的抗冻活性检测
利用DSC检测苜蓿蛋白的THA,结果见图1和表1。

图1 苜蓿蛋白的DSC热流曲线Fig.1 Heat flow curve of the alfalfa proteins注:曲线a~e分别代表不同停留温度下的 苜蓿蛋白热流曲线,其中曲线a、b、c、d和e的 停留温度分别为-0.5、-0.6、-0.7、-0.8和-0.9 ℃。
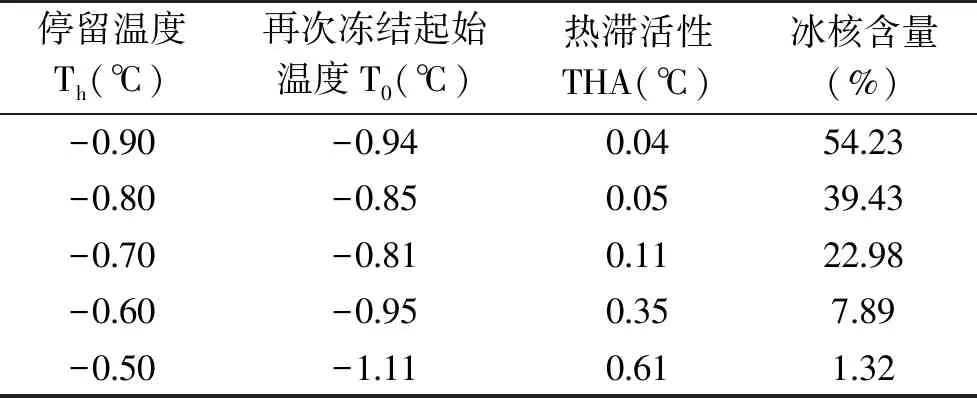
表1 苜蓿蛋白的THA检测结果Table 1 THA results of alfalfa proteins
由表1可以看出,随着停留温度的升高,冰核含量下降。不同停留温度下溶液中冰核含量不同,从而会导致测定的THA发生变化[16-19]。随着冰核含量的减少,THA反而增加。经硫酸铵沉淀的蛋白冰核含量大于39.43%时,DSC曲线没有明显的滞后现象,而随着冰核含量的减少,达到1.32%时,DSC曲线滞后现象明显,此时THA可以达到最大值为0.61 ℃,说明苜蓿干草中含有ISPs。对比其他植物ISPs研究成果,蛋白浓度为20 mg/mL时,从沙冬青中提取的ISPs THA为0.46 ℃,同浓度AISPs的THA高于沙冬青[20];刘尚等[21]从女贞叶中提取的ISPs,结果表明在0.5 mg/mL的浓度下,冰核含量为7%时,THA为0.678 ℃。AISPs的THA虽微小于女贞叶ISPs,但冰核含量也低于女贞叶ISPs。Zachariassen 等[22]认为,THA 与冰核含量呈负相关关系。其中冰核含量大于5%时,ISPs抑制冰晶生长的能力较弱,冰晶大量产生;而冰核含量小于5%,ISPs将发挥显著的效应,降低冰点。由此可见AISPs抑制冰晶生长效果明显,且具有良好的抗冻活性。
2.2 苜蓿蛋白的冰晶观察分析
利用显微镜观察水、NaCl溶液、蔗糖溶液和苜蓿蛋白溶液的冰晶结果见图2。可以看出,水的冰晶形态是较大的圆形;NaCl溶液的冰晶形态体积小、数量多,形态单一,多为棒形。经过4个冻融循环后,冰晶体积稍显变大;蔗糖溶液的冰晶形态也是体积小、数量多、形态单一,为小圆形,且小于NaCl溶液。经过4个冻融循环后,冰晶体积变化不明显;而苜蓿蛋白溶液的冰晶形态丰富,呈现小圆形、棒形、四边形、菱形及梭形等,甚至立体六棱锥形。苜蓿蛋白溶液的冰晶体积小于蔗糖体积。经过4个冻融循环后,冰晶体积稍显变大,但形态更加丰富。龚束芳等[23]研究的偃麦草ISPs的冰晶生长形态为柱状、六棱锥状,王维香[24]观察到沙冬青ISPs的冰晶生长形态为六角形、六棱柱和针状。ISPs的冰晶形态多达六种,其中以梭形和针形最好。而苜蓿蛋白溶液的冰晶即有梭形形态,因此,苜蓿蛋白溶液的冰晶不但体积小,而且形态理想,说明具有很强的修饰冰晶形态能力。苜蓿蛋白的冰晶生长形态与偃麦草ISP和沙冬青ISPs相似,且符合ISPs影响冰晶形态的特性,即ISPs吸附于冰晶表面,抑制冰晶沿A轴方向的生长,形成六边形或六棱锥等形态。NaCl和蔗糖是一种常用的抗冻保护剂,可以降低溶液冰点,有效地抑制溶液冰晶的生长、防止大冰晶的形成。通过与NaCl和蔗糖溶液比对,可见,苜蓿蛋白对冰晶生长的抑制及对冰晶的形态修饰作用显著,具有很好的抑制冰晶活性。结合苜蓿蛋白的DSC检测结果,可以断定磷酸缓冲溶液法提取到的苜蓿蛋白为AISPs。

图2 冰晶修饰形态(40×)Fig.2 Modification of ice crystal morphology(40×)注:A.水的冰晶形态;B~E.分别是20 mg/mL NaCl溶液冻融1~4次的冰晶形态;F~I. 分别是20 mg/mL 蔗糖溶液冻融1~4次的冰晶形态;J~M. 分别是20 mg/mL苜蓿蛋白溶液冻融1~4次的冰晶形态。
2.3 AISPs对冷冻面团质构特性的影响
AISPs对冷冻面团质构特性的影响结果见图3~图8。随着冻融次数的增加,冷冻面团的硬度、黏附性、内聚性、弹性、咀嚼性和回复性等质构特性发生了不同程度的变化。其中,硬度呈上升趋势(2.5%除外),AISPs添加组低于对照(冻融10周除外),与各冻融次数对照相比较,以0.5%添加量硬度降低较明显;AISPs添加组的黏附性均明显高于对照,以添加2%、2.5%的AISPs最显著(p<0.05);内聚性在0~4周次呈上升趋势,6~8周次相对稳定,8周次后呈下降趋势,AISPs添加组多数高于对照;随着冻融周次增加,弹性呈下降趋势,1.5%与2%添加组较稳定,而2.5%组先急速上升后稳定,AISPs添加组多数高于对照;回复性随冻融次数增加均呈现先上升后下降再上升的波浪式变化,以2%添加量变化最明显。咀嚼性表现为不同程度的先增加后降低趋势,AISPs添加组大部分高于对照。总体来看,当AISPs的添加量为2%~2.5%时,对质构特性的改善效果最为显著(p<0.05)。

图3 AISPs对冷冻面团硬度的影响Fig.3 Effects of AISPs on hardness of frozen dough

图4 AISPs对冷冻面团黏附性的影响Fig.4 Effects of AISPs on adhesive of frozen dough

图5 AISPs对冷冻面团内聚性的影响Fig.5 Effects of AISPs on cohesion of frozen dough

图6 AISPs对冷冻面团弹性的影响Fig.6 Effects of AISPs on elasticity of frozen dough

图7 AISPs对冷冻面团咀嚼性的影响Fig.7 Effects of AISPs on chewiness of frozen dough

图8 AISPs对冷冻面团回复性的影响Fig.8 Effects of AISPs on resilience of frozen dough
面团的主要成分是淀粉和面筋蛋白,面筋蛋白主要由麦谷蛋白和麦醇溶蛋白组成。麦谷蛋白的数条亚基通过分子间-S-S-交联形成的聚合物赋予面团弹性。面团中水分的存在状态影响着淀粉和面筋蛋白的结构变化。多次冻融的温度波动导致水分迁移,使面团内的小冰晶体逐渐汇聚成大冰晶,面筋蛋白的氢键被破坏,网络连续性变差,并与淀粉颗粒分开,面团弹性下降[25]。进而引起面筋三维网络结构的稳定性变弱,内聚性发生变化。淀粉线性分子发生重新排列,溶解度减小,影响了面团的硬度[26-28]。淀粉和蛋白质的亲水性发生改变,导致其内部的半结合水流出,使面团表面的水分较大、黏附性增加。
AISPs通过修饰冰晶形态、抑制冰晶的形成和重结晶,改变冷冻面团中水分的存在状态,缓解水分迁移,改善冷冻面团硬度[27-28]。AISPs可将水分有效的锁定在面团表面,引起黏性显著增加[29]。面筋蛋白网络得到较充分保护,和淀粉颗粒结合稳定,赋予了面团良好的弹性和内聚性。随着冻融周期延长,AISPs对冷冻面团的力学特性的缓解效果越明显。因此,在本研究中,添加不同浓度的AISPs冷冻面团的硬度增加明显减缓,弹性和内聚性的稳定增加,黏附性显著增加。说明了添加AISPs有效改善了冷冻面团的质构特性。Zhang等[30]研究了抗冻蛋白对冷冻面团质地特性的影响,结果表明添加抗冻蛋白可维持面包体积和改善面团柔软性、降低硬度。潘振兴[31]研究了ISPs对长期冷冻面团抗冻发酵特性产生影响,结果发现,添加组的面团硬度明显减小。本实验研究结果与以上基本一致。
2.4 AISPs对冷冻面团拉伸特性的影响
AISPs对冷冻面团拉伸特性的影响结果见图9~图14。随冻融次数的增加,各组冷冻面团的拉伸性能发生了不同程度的变化。其中,延伸度变化除添加1.5%外,其余均随AISPs添加量的增加而增大,且均高于对照。最高可达190 mm,接近非冷冻面团状态;拉伸阻力和最大拉伸阻力呈上升趋势,在0~4周次时,对照低于AISPs添加组,6周次后高于添加组,10周次时突然大幅度升高;各组拉伸面积呈规律性增加,AISPs添加组明显优于对照。其中2%和2.5%组的拉伸面积稳定增加;拉伸比例与最大拉伸比例,对照均大于AISPs添加组,且在第10周次突然显著增加,严重脱离各AISPs添加组。各冻融中添加量为2%~2.5%,可使冷冻面团拉伸特性得到明显改善,从经济效益出发,添加2%为宜。

图9 AISPs对冷冻面团延伸度的影响Fig.9 Effects of AISPs on extensibility of frozen dough

图10 AISPs对冷冻面团拉伸阻力的影响Fig.10 Effects of AISPs on the tensile resistance of frozen dough

图11 AISPs对冷冻面团最大拉伸阻力的影响Fig.11 Effects of AISPs on the maximum tensile resistance of frozen dough

图12 AISPs对冷冻面团拉伸面积的影响Fig.12 Effects of AISPs on extensible area of frozen dough

图13 AISPs对冷冻面团拉伸比例的影响Fig.13 Effects of AISPs on extension ratio of frozen dough
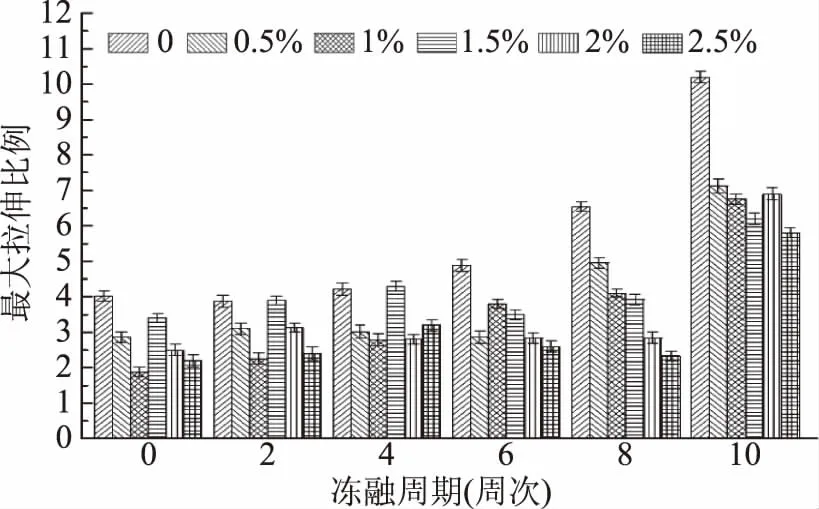
图14 AISPs对冷冻面团最大拉伸比例的影响Fig.14 Effects of AISPs on the max extension ratio of frozen dough
组成面筋蛋白的一个重要成分是麦醇溶蛋白,赋予面团延展性。反复冻融使面团中的水分有足够时间通过粉质结构,冻结成为吉布斯自由能较小的大冰晶结构,导致面筋网络结构和麦醇溶蛋白被破坏,面筋蛋白的拉伸力减小[32]。拉伸力决定了面团的延伸能力,随着冻融次数的增加,冷冻面团的面团弱化、面团松弛,导致延伸度降低。而添加AISPs后随着冻融次数的增加,冷冻面团的拉伸特性出现了不同程度的变化,拉伸阻力、最大拉伸阻力、拉伸比例和最大拉伸比例均小于对照,而延伸度和拉伸面积高于对照。反映了AISPs增加了面筋网络之间的结合能力和内部结构的稳定性,使拉伸时间延长,拉伸曲线越稳定,面团的抗拉伸性能和稳定性变好,内部结构也越细腻,其韧性也增大。说明AISPs改善了冷冻面团的筋力和品质。李楠等[33]研究了不同改良剂对冷冻面团拉伸特性的影响,得出选择合适的添加剂可以改善冷冻面团的拉伸特性,佐证了本研究结果。
2.5 AISPs对冷冻面团超微结构的影响
冷冻面团SEM结构表征结果见图15。经过试验探索发现在冻融1~4周时,ISPs对冷冻面团超微结构影响大,而4~10周变化不明显,随周期延长至10周后,有明显影响。因此选取2、4、10周进行进一步探究。从A1~F1、A2~F2、A3~F3可以看出,随冻融周期的延长,面筋结构不断被破坏,直至严重破坏,并断裂成很多小块,面筋膜变薄且不均匀,几乎不可见连续的面筋网状结构。大部分淀粉颗粒得以暴露,伴随出现大量不规则、质地稀疏的空洞。从A1~F1、A2~F2、A3~F3可以看出,随着AISPs添加量的增加,面筋网络由稀少变增多,淀粉的状态由颗粒大暴露多逐步变得大小颗粒都被面筋蛋白包裹。说明AISPs对冻融中的面筋蛋白和淀粉颗粒具有一定的保护作用。而当AISPs添加量为2%~2.5%时,可以观察到连续清晰的束状面筋网络,少量淀粉颗粒暴露面筋膜外,大空洞较少,面筋网络结构遭到破坏程度最小,可见经过10个周次的冻融后,仍然可以观察到明显的面筋网络结构,这说明AISPs可以显著保护冷冻面团的超微结构,具有抗冻保护效果。

图15 冷冻面团的SEM结构表征Fig.15 Structural characterization of frozen dough by SEM注:A、B、C、D、E和F分别表示冷冻面团中AISPs的添加量为0%、0.5%、1.0%、1.5%、2.0%和2.5%; 1、2、3分别代表冷冻面团冻融周期为2、4、10周次;A1~F1、A2~F2(100×),A3~F3(50×)。
SEM图直观的反映了面筋蛋白以膜状形态存在,构成面筋网络结构,圆形或椭圆形的淀粉颗粒被包裹在面筋膜中,支撑网络结构。其中,不规则深色空洞,分别由冰晶升华后形成的空间,和面团未冷冻加工前裹入空气而产生的气孔[34-35]。可见,冷冻面团在冻融过程中,由于水的结晶和重结晶而产生较大冰晶,冰晶融化升华后在面筋网络上留下不规则空洞,对面筋网络结构造成机械破坏[36]。同时,大冰晶破坏了细胞的结构,造成细胞内水分流失,进一步破坏面筋蛋白与水、淀粉颗粒与水的结合。因而AISPs的添加在一定程度上通过修饰冰晶形态、抑制大冰晶形成,对面筋网络结构和淀粉颗粒产生抗冻保护作用。Goff等[37]研究了冬小麦ISPs对冷冻面筋网络结构的影响,发现添加ISPs的面筋网络中空洞变小,机械破坏降低,与本研究结果一致。冷冻面团的SEM表征结果显示AISPs对冻融中的面筋蛋白和淀粉颗粒具有一定的抗冻保护作用,同时也证实了冻融对面团质构特性及拉伸特性有明显改善作用。
3 结论
AISPs的THA为0.61 ℃。在冻融周期中,AISPs溶液的冰晶体积小、数量多,能够修饰冰晶形态、抑制冰晶生长。说明AISPs具有良好的抗冻活性。在多次冻融中,添加不同浓度的AISPs对冷冻面团质构特性及拉伸特性都产生了影响。随着冻融次数的增加,AISPs添加组的硬度低于对照,内聚性、弹性、粘附性和咀嚼性多数高于对照,回复性呈波浪式变化,且AISPs添加组的质构特性均较稳定。添加各组的延伸度均高于对照,最高达190 mm,接近非冷冻面团状态;拉伸阻力、最大拉伸阻力、拉伸比例与最大拉伸比例低于对照;拉伸面积高于对照。总体看来,添加2%~2.5%可使质构特性和拉伸特性得到明显改善。
SEM表征结果,随冻融周期的延长,面筋网络结构被破坏,大部分淀粉颗粒得以暴露,伴随出现大量不规则、质地稀疏的空洞。随着AISPs添加量的增加,面筋蛋白网络清晰连续,淀粉颗粒被面筋蛋白包裹。说明AISPs对冻融中的面筋蛋白和淀粉颗粒具有一定的抗冻保护作用。
综上,AISPs具有很好的抗冻活性,添加AISPs可以减少冷冻面团内部面筋蛋白质破坏,保护冷冻面团质构和拉伸特性的均一性和稳定性,在反复冻融过程中对冷冻面团起到了良好的抗冻保护作用。
