聚乙二醇定点修饰β-乳球蛋白谷氨酰胺残基条件优化及其对蛋白抗原性的影响
2019-07-09罗舜菁甘克明陆旭丽成娜娜刘成梅
罗舜菁 甘克明 陆旭丽 成娜娜 刘成梅
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
β-乳球蛋白(β-lactoglobulin,β-LG)是乳清蛋白的主要成分,在乳清蛋白中的含量约为43.6~50.0%[1]。天然的β-LG也是牛乳中最主要的过敏原之一[2],对牛乳过敏的患者中约82%的人会对β-LG产生过敏反应[3-4]。消除或降低牛乳致敏性的最有效方法是将过敏原物质从牛乳中分离,将牛乳中β-LG去除后可以模拟人乳,可用于婴幼儿配方奶粉的生产[5]。β-LG具有较高的营养价值及多种功能特性,如溶解性、起泡性和凝胶性等,因而在食品加工中具有较大的应用价值[6],而其强致敏性使其应用范围受到了极大限制[2]。针对从牛乳中分离出的β-LG,为降低其致敏性,进行了大量的研究,其中,化学修饰技术如糖基化[7]、聚乙二醇修饰[8]等是目前研究的热点。
聚乙二醇(polyethylene glycol,PEG)修饰多用于药物蛋白的修饰,以改善蛋白的生物化学特性、降低抗原性等[9]。分子量在1 000 Da以上的PEG无毒,且已被美国食品药品监督管理局批准用于食品、药品和化妆品中[8,10]。目前,应用PEG随机修饰来降低β-LG抗原性的研究[11-12]已有少量报道。然而,PEG随机修饰通常会得到多种PEG修饰产物的混合物,难以分离纯化和表征其性质[13]。此外,PEG随机修饰的修饰位点难以确定,使β-LG的修饰位点与抗原性间关系的研究存在较大困难。在随机修饰条件下,蛋白结构也会发生较大改变[8]。综上所述,应用PEG随机修饰难以对β-LG的抗原性变化机理进行深入探究,因而也难以对其抗原性进行有效调控。酶催化PEG定点修饰技术可在谷氨酰胺转氨酶(transglutaminase,TG酶)的催化下,对蛋白质谷氨酰胺残基(Gln)进行定点修饰[14],得到的修饰产物均一[15],且修饰条件温和,因而对蛋白构象的影响较小。
本研究拟在TG酶催化下用5 kDa mPEG-NH2定点修饰β-LG的Gln残基,通过SDS-PAGE结合凝胶过滤色谱对修饰条件进行优化。经阳离子交换色谱对修饰产物进行分离纯化,用SDS-PAGE和反相高效液相色谱(RP-HPLC)对修饰产物进行鉴定,通过间接竞争ELISA法对修饰前后的蛋白进行抗原性分析,以期开发有效降低β-LG 抗原性的方法,为进一步研究其抗原性变化机理提供指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
牛乳β-乳球蛋白、猪明胶:美国Sigma公司;
单甲氧基聚乙二醇胺(mPEG-NH2):5 kDa,北京键凯科技股份有限公司;
谷氨酰胺转氨酶(TG酶):200 U/g,上海源叶生物科技有限公司;
十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒、三(羟甲基)氨基甲烷(Tris)、甘氨酸(Glycine)、4×上样缓冲液(含β-巯基乙醇)、考马斯亮蓝R250:北京索莱宝科技有限公司;
磷酸氢二钠、磷酸二氢钠、醋酸钠、氯化钠、碳酸钠、碳酸氢钠、柠檬酸、邻苯二胺、无水乙醇、冰醋酸、甲醇:分析纯,天津市大茂化学试剂厂;
三氟乙酸、乙腈:色谱纯,天津市大茂化学试剂厂;
吐温-20、30%过氧化氢、浓硫酸:分析纯,西陇科学股份有限公司。
1.1.2 仪器与设备
垂直电泳仪:Mini-PROTEIN Tetra型,美国伯乐公司;
中高压层析系统:NGC Quest 10 Plus型,美国伯乐公司;
酶标仪:HF2000型,北京华安麦科生物技术有限公司;
电子分析天平:ME104型,梅特勒—托利多仪器(上海)有限公司;
pH计:Five Easy Plus型,梅特勒—托利多仪器(上海)有限公司;
高速冷冻离心机:Heraeus Multifuge X1R型,美国Thermo公司;
数显恒温水浴锅:HH-2型,江苏金坛市荣华仪器制造有限公司;
超纯水系统:Simplicity UV型,美国Millipore公司;
高效液相色谱仪:Agilent 1100型,美国安捷伦科技有限公司。
1.2 方法
1.2.1 mPEG-NH2定点修饰β-LG谷氨酰胺残基 根据Mero等[9]的方法,修改如下:将β-LG溶解在一定pH值且含有一定量乙醇的0.1 mol/L磷酸盐缓冲液中,使其浓度为1.0 mg/mL。依次按一定量β-LG与PEG摩尔比及TG酶与β-LG质量比(E/S)加入5 kDa的mPEG-NH2和TG酶,搅拌均匀后,在一定温度下反应12 h,用冰醋酸调pH至4.5终止反应。
1.2.2 单因素试验
(1) TG酶与β-LG质量比:按1.2.1方法,β-LG与PEG摩尔比1∶10,缓冲液中乙醇添加量25%(体积分数),反应pH 7.0,反应温度25 ℃,考察TG酶与β-LG质量比(5∶1,3∶1,1∶1,1∶3)对修饰率的影响。
(2) 反应pH:按1.2.1方法,TG酶与β-LG质量比1∶1,β-LG与PEG摩尔比1∶10,缓冲液中乙醇添加量25%(体积分数),反应温度25 ℃,考察反应pH(5.0,6.0,7.0,8.0)对修饰率的影响。
(3)β-LG与PEG摩尔比:按1.2.1方法,TG酶与β-LG质量比1∶1,反应pH 7.0,缓冲液中乙醇添加量25%(体积分数),反应温度25 ℃,考察β-LG与PEG摩尔比(1∶5,1∶10,1∶15,1∶20)对修饰率的影响。
(4) 缓冲液中乙醇添加量:按1.2.1方法,TG酶与β-LG质量比1∶1,β-LG与PEG摩尔比1∶10,反应pH 7.0,反应温度25 ℃,考察缓冲液中乙醇添加量(0%,15%,25%,35%)(体积分数)对修饰率的影响。
(5) 反应温度:按1.2.1方法,TG酶与β-LG质量比1∶1,β-LG与PEG摩尔比1∶10,反应pH 7.0,缓冲液中乙醇添加量25%(体积分数),考察反应温度(4,25,37 ℃)对修饰率的影响。
1.2.3 SDS-PAGE分析 参考Laemmli[16]的方法,用5%的浓缩胶和12%的分离胶进行电泳。
1.2.4 凝胶过滤色谱分析 参考薛晓莹[17]的方法,不同反应条件下β-LG的PEG修饰产物的修饰率经Superdex 200凝胶色谱柱进行测定。按式(1)计算。
(1)
式中:
R——修饰产物的修饰率,%;
A1——β-LG的PEG修饰产物的峰面积,cm2;
A——总蛋白峰面积,cm2。
1.2.5β-LG的PEG修饰产物的纯化 参考Yu等[18]的方法并稍作改动,用SP Sepharose Fast Flow阳离子交换柱对修饰产物进行分离纯化。用pH 4.0,0.04 mol/L醋酸钠初始缓冲液(洗脱液A)和含1.0 mol/L NaCl的0.04 mol/L,pH 4.0醋酸钠缓冲液(洗脱液B),以流速2 mL/min 进行梯度洗脱,洗脱梯度为0%~100%洗脱液B。在280 nm下测定各洗脱液的吸光值。收集各洗脱峰,经SDS-PAGE分析确定各洗脱峰的成分。然后收集PEG修饰产物的洗脱峰,用截留分子量10 kDa的Amicon Ultra-15超滤离心管于4 ℃下以4 990 r/min离心20 min,浓缩得到样品。
1.2.6 反相高效液相色谱(RP-HPLC)分析 参考李慧等[19]和玉莹等[20]的方法,用Waters SunFire C18色谱柱(5 μm,250 mm×4.6 mm)对β-LG及其修饰产物进行分析。
1.2.7 抗原性分析 参考蔡小飞等[1]和Kleber等[21]的方法,采用间接竞争ELISA法测定PEG修饰前后β-LG的抗原性。抗原性降低率按式(2)计算[1]。
(2)
式中:
P——抗原性降低率,%;
Ai——待测样品在490 nm处测得的吸光度;
A1——β-LG在490 nm处测得的吸光度;
A0——空白对照组在490 nm处测得的吸光度。
1.3 数据处理
采用Excel 2007进行数据整理,用Origin 8.0软件作图。所有数据为3次重复试验的平均值。
2 结果与分析
2.1 单因素试验
2.1.1 TG酶与β-LG质量比(E/S)及反应pH值对修饰率的影响 由图1(a)中泳道2~5可知,4种E/S下的反应液在电泳图中均只含有2个条带,分别在18,28 kDa附近,β-LG标准品的条带在18 kDa附近。因此,推测28 kDa 附近条带为其PEG修饰产物。比较28 kDa附近条带可知,随着E/S的增大,PEG修饰产物的量逐渐增加。修饰率测定结果如图1(b)所示,随着E/S的增大,其修饰率逐渐增大,在E/S为3∶1时达到最大。由于E/S增大时反应液中TG酶浓度增大,使酶与底物的接触面积增大,从而使修饰率增大;当E/S为3∶1时,酶浓度接近饱和,继续增大E/S其修饰率不再明显增加。
由图1(a)中泳道7~10可知,随着pH值的增大,PEG修饰产物的量呈先增大后减小的趋势,且在pH 6.0,7.0时均较大。修饰率测定结果与电泳结果一致,如图1(c) 所示,在pH 7.0时其修饰率最大,可能与TG酶的最适pH有关,在pH 6.0~7.0范围内其反应活性最强。
综上可知,5 kDa mPEG-NH2定点修饰β-LG的最佳TG酶与β-LG质量比为3∶1,最佳反应pH为7.0。
2.1.2β-LG与PEG摩尔比及乙醇添加量对修饰率的影响 由图2(a)、(b)可知,随着PEG添加量的增加,其修饰率呈先增大后减小的趋势,在β-LG与PEG摩尔比为1∶15 时最大。由于PEG添加量的增加使β-LG与PEG的接触面积增大,有利于修饰反应的进行;而当添加量过高时,反应液中过多的PEG会阻碍β-LG与TG酶的接触,从而使修饰率降低。
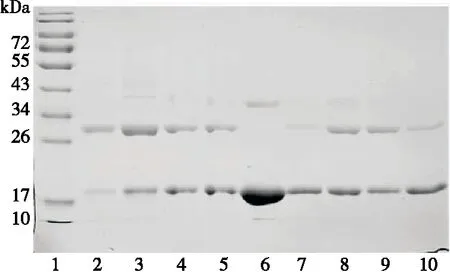
1. 蛋白Marker 2~5. 分别表示E/S为5∶1,3∶1,1∶1,1∶3时的反应液 6.β-LG 7~10. 分别表示pH为5.0,6.0,7.0,8.0时的反应液

图1 E/S及反应pH值对修饰率的影响
由图2(a)、(c)可知,随着乙醇添加量的增加,其修饰率呈先增大后减小的趋势,在乙醇添加量为25%时最大;而当乙醇添加量为35%时几乎无PEG修饰产物生成,生成大量沉淀,说明当乙醇添加量为35%时,缓冲液中乙醇浓度过高,使蛋白聚集沉淀,从而阻碍了反应的进行。

1. 蛋白Marker 2.β-LG 3~6. 分别表示β-LG与PEG摩尔比为1∶5,1∶10,1∶15,1∶20时的反应液 7~10. 分别表示乙醇添加量(体积分数)为0%,15%,25%,35%时的反应液

图2 β-LG与PEG摩尔比及乙醇添加量对
Figure 2 Effects of molar ratio ofβ-LG to PEG and ethanol addition amount on modification rate
综上可知,5 kDa mPEG-NH2定点修饰β-LG的最佳β-LG与PEG摩尔比为1∶15,最佳乙醇添加量为25%(体积分数)。
2.1.3 反应温度对修饰率的影响 由图3(a)、(b)可知,反应温度对修饰反应的影响较大,在3个温度下PEG修饰产物的修饰率分别为14.08%,27.56%,4.36%,在25 ℃ 时其修饰率最高。因此,确定其最佳反应温度为25 ℃。
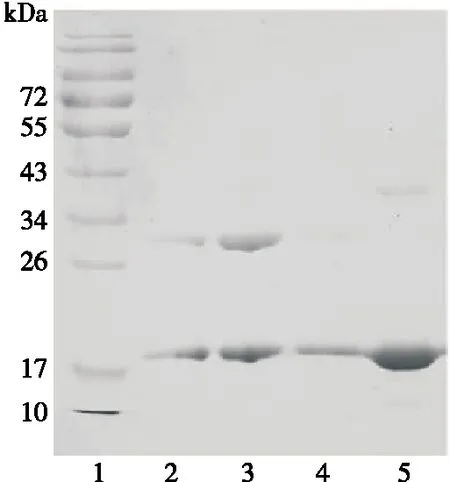
1. 蛋白Marker 2~4. 分别为4,25,37 ℃时的反应液 5. β-LG
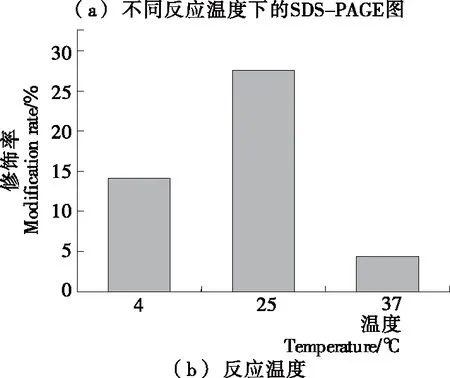
图3 反应温度对修饰率的影响
综上可知,PEG定点修饰β-LG的最优条件为反应pH 7.0,反应温度25 ℃,β-LG与PEG摩尔比1∶15,TG酶与β-LG质量比3∶1,缓冲液中乙醇添加量25%(体积分数),该修饰条件下其PEG修饰产物的修饰率为60.17%。
2.2 β-LG的PEG修饰产物的纯化
如图4所示,经0.0~1.0 mol/L NaCl盐离子梯度洗脱后,反应混合液主要出现两个洗脱峰F1和F2。PEG与蛋白结合后会屏蔽蛋白表面的电荷,从而使蛋白与层析介质的结合强度减弱,因此PEG修饰产物会先于未修饰的蛋白而被洗脱下来[22]。据此推测,洗脱峰F1,F2分别为β-LG的PEG修饰产物和未修饰的β-LG。
分别收集两个洗脱峰经SDS-PAGE分析,由图5可知,洗脱峰F1在28 kDa左右有1个明显的条带,而洗脱峰F2在18 kDa左右有1个明显的条带,表明F1、F2两个洗脱峰分别对应β-LG的PEG修饰产物和未修饰的β-LG,与上述推测结果一致。此外,有研究[23]表明,在溶液中,PEG分子的每个乙氧基单元会与2~3个水分子结合,使PEG修饰产物的水化半径明显增大,因而PEG修饰产物的表观分子量通常是未修饰蛋白的分子量与2~3倍的PEG实际分子量之和。在图5中,β-LG的分子量在18 kDa左右,而其PEG修饰产物的分子量在28 kDa左右,刚好约为1个β-LG分子的分子量与2倍PEG分子量之和。据此推测,所得的产物为PEG单修饰产物,即1个PEG分子与1个β-LG分子结合。

图4 β-LG的PEG修饰混合物的阳离子交换色谱图

1. 蛋白Marker 2. 修饰混合物 3与5. 洗脱峰F1 4与6. 洗脱峰F2 7.β-LG
图5 阳离子交换色谱纯化得到的各洗脱峰SDS-PAGE图
Figure 5 SDS-PAGE analysis of elution peaks obtained by purification
2.3 反相高效液相色谱(RP-HPLC)分析
如图6所示,经乙腈和水梯度洗脱后,β-LG分别在31.3,32.7 min出现两个洗脱峰。牛乳中β-LG主要存在A、B两种遗传变异体,有研究[20,24]表明,通过RP-HPLC可将两种变异体分离开。因此,图6中β-LG的两个洗脱峰可能分别为其A、B两种遗传变异体。经阳离子交换色谱纯化得到的PEG修饰产物,其色谱峰无明显变化,除两种遗传变异体的洗脱峰外,无其他洗脱峰出现,表明在该修饰条件下PEG修饰位点固定,得到的修饰产物均一,无其他位置异构体生成。

图6 β-LG及其PEG修饰产物的反相高效液相色谱图
2.4 PEG修饰前后β-LG的抗原性变化
如图7所示,经PEG定点修饰后β-LG的抗原性显著降低,其降低率约为59.04%。由于在PEG修饰过程中添加了25%乙醇,为了探究25%乙醇是否会对β-LG的抗原性产生影响,以经25%乙醇处理过的β-LG为另一对照组对其抗原性进行测定,结果表明25%乙醇对β-LG的抗原性影响不大,其抗原性降低率仅为10.67%。上述试验结果表明,酶催化PEG定点修饰导致β-LG抗原性降低,其主要原因是连接在蛋白上的PEG链发挥了某种作用,而修饰条件对其抗原性影响不大。Mu等[25]研究表明,连接在蛋白上的PEG链能在蛋白表面形成一层独特的水化层,因而造成对蛋白的空间屏蔽作用。有研究[26-27]表明,β-LG的抗原性与线性表位和构象表位有关。肽段AA41~60,AA102~124,AA149~162是β-LG的主要抗原表位,分别能被92%,97%,89%的人血清识别[28]。因此,连接在β-LG分子上的大分子PEG链覆盖在蛋白表面,可能会掩盖表面的一些线性表位和构象表位,阻碍其与特异性抗体的结合,因而使β-LG的抗原性显著降低。

1. β-LG 2. 经25%乙醇处理过的β-LG 3. PEG修饰产物
Figure 7 Effect of site specific PEGylation at β-lactoglobulin glutamine residues on antigenicity
3 结论
本研究运用酶催化PEG定点修饰技术对β-LG的Gln残基进行定点修饰,通过SDS-PAGE结合凝胶过滤色谱分析确定最佳修饰条件为反应pH 7.0,反应温度25 ℃,β-LG与PEG摩尔比1∶15,TG酶与β-LG质量比3∶1,缓冲液中乙醇添加量25%(体积分数),在该修饰条件下其PEG修饰产物的修饰率为60.17%。最佳修饰条件下的修饰混合物经阳离子交换色谱纯化后,得到了均一的PEG单修饰产物。经PEG修饰后β-LG的抗原性显著降低,降低率可达59.04%。本试验仅对酶催化PEG定点修饰前后β-LG的抗原性变化情况进行了初步探究,后续可通过蛋白结构分析及PEG修饰位点分析等手段对其抗原性变化机理进行深入研究,为实现β-LG抗原性的有效调控打下基础。此外,酶催化PEG定点修饰对β-LG 的功能特性如乳化性、起泡性、凝胶性等的影响也有待研究。
