预热处理大豆蛋白对鲤鱼肌原纤维蛋白凝胶和流变学特性的影响
2019-07-05杜洪振孙钦秀孔保华
杜洪振,陈 倩,杨 振,孙钦秀,孔保华*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
对于鱼肉加工制品,特别是鱼糜类制品,产品的质构特性被认为是最重要的品质特性之一。鲤鱼由于其生长快、产量高、价格低、且味道鲜美而广受欢迎。其中鱼肉中的肌原纤维蛋白(myofibrillar isolate protein,MPI)在鱼糜制品中起到凝胶和结合水的作用,决定了鱼肉制品的品质特性。近年来,非肉蛋白质广泛应用于肉制品中,以提高肉制品的产量和质地,改善肉制品的乳化稳定性和热诱导凝胶特性。大豆分离蛋白(soy protein isolate,SPI)是一种广泛用于肉制品中的蛋白质添加剂,常用作乳化剂、保湿剂和填料/黏合剂,以改善碎肉和乳化肉制品的功能特性[1-2]。
SPI在加工肉制品中作为功能性添加剂的用途,在很大程度上由其与肌肉蛋白质(特别是肌球蛋白)的相互作用和相容性决定。据报道,SPI中的7S和11S组分起主要凝胶作用,但是一般来说天然的SPI直接加入肉糜类制品中会降低肉糜的凝胶特性,这主要与SPI中蛋白质的变性温度有关。大豆蛋白中的7S和11S组分的变性温度分别在73~82 ℃和76~96 ℃之间[3-5],而肌肉中的主要蛋白质MPI变性温度大约在67~72 ℃之间[6]。因此,当天然SPI加入肉糜制品中加热时,MPI会先发生变性形成凝胶,而此时SPI尚未到达变性温度,会夺取肌肉中的水分,从而造成蛋白凝胶结构疏松,弹性较差等问题。Peng等[7]研究发现天然大豆蛋白和肌球蛋白之间没有发生相互作用,且β-伴大豆球蛋白的存在抑制了肌球蛋白重链在50 ℃和100 ℃之间的聚集[8]。有研究[9-10]进一步证实大豆蛋白中7S球蛋白在MPI凝胶中的拮抗作用,其中β-伴大豆球蛋白的存在能够阻碍肌球蛋白重链的自聚集。另一方面高浓度的天然SPI也不利于MPI凝胶的形成[11]。因此,改善SPI的天然结构以增强其在肉制品中的功能性变得十分必要。
为克服天然SPI与肉蛋白之间相互作用存在的缺陷,可以通过对天然SPI改性以改变其功能特性。卢岩[12]将SPI添加到MPI中发现,随着SPI添加量的增加,添加天然SPI的蛋白凝胶强度显著减小,而添加经过羟基自由基氧化后的SPI蛋白凝胶强度显著增大。耿蕊[13]和Niu Haili等[14]在极端酸性(pH 1.5)条件下结合适当加热(60 ℃)处理SPI 5 h,并将改性后的SPI与MPI复配制成凝胶,结果表明添加经过改性后的SPI蛋白凝胶强度显著增大,而添加天然SPI的蛋白凝胶强度显著降低。同样,Jiang Jiang等[15]在极端酸性(pH 1.5)或碱性(pH 12)条件下处理SPI并添加到MPI中,结果显示添加改性的SPI在加热时能提高MPI的胶凝能力。
本实验研究SPI在经过不同时间预热处理后与MPI复配,通过测定凝胶强度、白度、持水性、流变特性以及热稳定性的变化,研究不同预热处理时间的SPI与MPI作用效果,为提高鱼糜类制品的凝胶特性提供一定的理论支持。
1 材料与方法
1.1 材料与试剂
新鲜鲤鱼(平均质量1.5 kg)购于哈尔滨市好又多超市,保藏运至实验室,宰杀去皮及内脏后,4 ℃放置4 h,取鱼背部肌肉提取MPI。
SPI 临沂山生物制品有限公司;牛血清蛋白美国Sigma公司;哌嗪-N,N-双(2-乙磺酸)(piperazine-N,N’-bis(2-ethanesulfonic acid),PIPES) 源叶生物科技有限公司;氯化钠、氢氧化钠、五水硫酸铜、磷酸氢二钠、磷酸二氢钠(均为分析纯) 国药集团化学试剂沈阳有限公司。
1.2 仪器与设备
T18 basic型高速匀浆机 德国IKA公司;TA-XT plus型质构分析仪 英国Stable Micro System公司;ZE6000色差计 日本色电工业株式会社;GL-21M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;TU-1800紫外-可见光分光光度计 北京普析通用仪器有限公司;722-2000分光光度计 山东高密彩虹仪器有限公司;DK-S24型电热恒温水浴锅 上海森信实验仪器有限公司;MAL1038384流变仪 英国马尔文仪器有限公司;Q20差示扫描量热(differential scanning calorimeter,DSC)仪 美国TA公司。
1.3 方法
1.3.1 鲤鱼MPI提取及处理
根据Chin等[16]的方法并稍加修改,提取MPI。先将鱼肉切碎并立刻称取200 g,加入800 mL的蛋白提取液(20 mmol/L pH 7.5的冰磷酸盐缓冲溶液),用匀浆机匀浆4 次,每次30 s,间隔10 s,得到的匀浆液在4 ℃、9 500×g离心15 min后,除去上清液。沉淀物中再加入800 mL的4 ℃ NaCl溶液(0.1 mol/L),重复以上步骤洗涤离心3 次。最后一次匀浆离心前用4 层纱布过滤,所得滤液在4 ℃、9 500×g离心15 min,沉淀即为鲤鱼MPI。MPI浓度采用双缩脲法测定,以牛血清蛋白做标准曲线。
1.3.2 实验设计
将提取的MPI(蛋白质质量分数大约为7%)悬浮在含有0.6 mol/L NaCl(pH 6.25)的50 mmol/L PIPES缓冲液中,使溶液中的最终蛋白质量浓度为40 mg/mL。用蒸馏水将SPI配制成40 mg/mL,置于水浴锅中加热待温度达到90 ℃,分别保持30 min和180 min,然后在室温冷却备用。将经过不同时间热处理的SPI溶液分别与MPI溶液以不同体积比(0∶1、1∶1、1∶2、1∶3、1∶4)混合均匀,所有混合溶液的总蛋白质量浓度均为40 mg/mL。
1.3.3 凝胶的制备
将20 mL搅拌均匀的蛋白溶液置于30 mm×50 mm磨口玻璃称量瓶中,80 ℃水浴锅中加热30 min,取出迅速置于冰水中冷却,然后放置在4 ℃冰箱中贮藏12 h。制备好的凝胶每次测定前在室温(20~25 ℃)平衡30 min,然后用于测定凝胶持水性、白度和质构。
1.3.4 凝胶硬度和弹性的测定
根据Buamard等[17]的方法进行凝胶质构测定。测试时将样品置于测定平台上固定好,室温条件下利用TA-XT plus型质构分析仪进行测量。探头型号选择P/0.5(直径为12 mm),下压得到的穿透力即为蛋白的凝胶强度。选用的物性仪测定参数如下:测试前速率3.0 mm/s;测试速率0.3 mm/s;触发力5 g;测试后速率3.0 mm/s;穿刺距离10.0 mm。每个样品进行3 次平行实验,取平均值。
1.3.5 凝胶白度值的测定
根据Park[18]的方法测定凝胶亮度L*值、红度a*值和黄度b*值。白度值计算如式(1)所示:
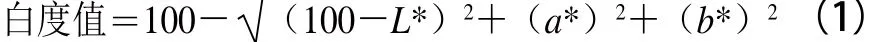
1.3.6 凝胶持水性的测定
MPI凝胶持水性的测定参考Salvador等[19]的方法。称取5 g蛋白凝胶置于50 mL离心管中,4 ℃、1 600×g离心10 min后除去离心出的水分,测定离心管中凝胶离心前后的质量。所有样品重复3 次取平均值。持水性按照公式(2)计算:
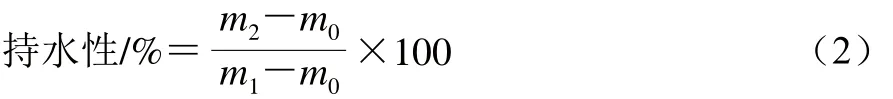
式中:m0为离心管质量;m1为离心前离心管和凝胶质量;m2为离心后离心管和凝胶质量。
1.3.7 凝胶流变学性质的测定
混合蛋白凝胶流变学特性的测定参考Niu Haili等[14]的方法并略作修改。使用配备有两个平行板(直径40 mm)的流变仪测量混合蛋白样品热凝胶化过程的流变性质,两平板间距为1 mm。通过1 ℃/min的升温速率将溶液从20 ℃加热至80 ℃生产凝胶。每个样品在固定频率0.1 Hz下以振荡模式连续剪切,最大应变为0.02,为防止脱水,在样品的暴露边缘涂上一薄层硅油。
1.3.8 蛋白质热稳定性的测定
SPI经过预热处理后按照不同添加比例与MPI混合,通过DSC测定混合蛋白稳定性的变化情况。精确称量MPI 10~15 mg放入样品池,放置DSC仪器的样品支持器上,调整好仪器,用空盒作对照。实验采用的测定温度范围为20~90 ℃,加热速率为10 ℃/min。采用pyris6.0软件进行数据记录和处理得到DSC曲线,峰值点温度为变性温度,曲线形成的峰面积理论上为蛋白质变性所吸收热量。每个样品重复3 次取平均结果。
1.4 统计分析
所得数据均为3 次重复的平均值,结果表示为 ±s。采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行数据统计分析,平均数之间显著性差异(P<0.05)分析使用Tukey HSD程序,采用Sigmaplot 12.5软件作图。
2 结果与分析
2.1 SPI对MPI凝胶硬度和弹性的影响
如图1A所示,纯MPI凝胶硬度为58.73 g,随着SPI-MPI比例1∶1~1∶4,蛋白凝胶强度显著增高(P<0.05),这是因为形成热诱导的凝胶网络结构与MPI有更大的关系,MPI占比越高,凝胶硬度相对越大。此外高质量浓度的SPI在加热时其本身的自缔合增加从而形成较弱的混合凝胶[14]。Jiang Jiang等[15]向MPI中添加天然SPI发现,在总蛋白含量相同的情况下,随着SPI添加量的增加蛋白凝胶强度显著降低,且天然SPI的亚基不参与MPI的凝胶化过程。另一方面,在SPI添加量相同时,经过较长时间预热处理的SPI(180 min预热),添加到MPI中获得的蛋白凝胶强度显著增大(P<0.05),且当SPI-MPI比例为1∶4,加热时间为180 min时蛋白凝胶强度达到最大值47.60 g,说明热处理后的SPI中β-伴大豆球蛋白的功能得到部分改善[9],从而具有增加肌肉蛋白凝胶强度的作用。此外SPI热处理后可能发生共价交联及疏水相互作用,从而提高了蛋白凝胶的强度。Liu Qian等[20]研究了pH值偏移结合热处理对SPI凝胶结构的影响,结果表明SPI在加热过程中形成二硫键。而O'Kane等[21]认为豆类蛋白凝胶网络的形成主要依靠氢键和疏水键,而预热处理可以增加这种作用力。
如图1B所示,添加SPI对MPI凝胶弹性影响的变化趋势与凝胶硬度一致。纯MPI凝胶弹性为0.96,在总蛋白含量相同的情况下,随着天然SPI-MPI比例1∶1~1∶4,混合蛋白的凝胶弹性分别下降了16.78%、15.22%、12.92%、10.79%(P<0.05),这可能是因为在SPI的含量相对较低时,MPI所占的比例较大,而MPI更有利于形成蛋白凝胶网络,进而增大了蛋白的凝胶弹性[22]。在相同的SPIMPI比例下,经过预热处理的SPI与MPI混合,其凝胶弹性显著高于添加天然SPI组(P<0.05)。经过较长时间预热处理SPI(180 min)与MPI混合后获得的凝胶的弹性值高于短时间预热处理的SPI(30 min)(P<0.05),且与单独由MPI形成的凝胶相比无显著差异。MPI中的肌球蛋白与易于与经过预热改性的SPI相互作用[7,9],并且热处理有利于SPI中的组分参与凝胶形成[11],增强了凝胶结构的形成。这一点也可以从下面实验结果中持水性的增强得到证实。
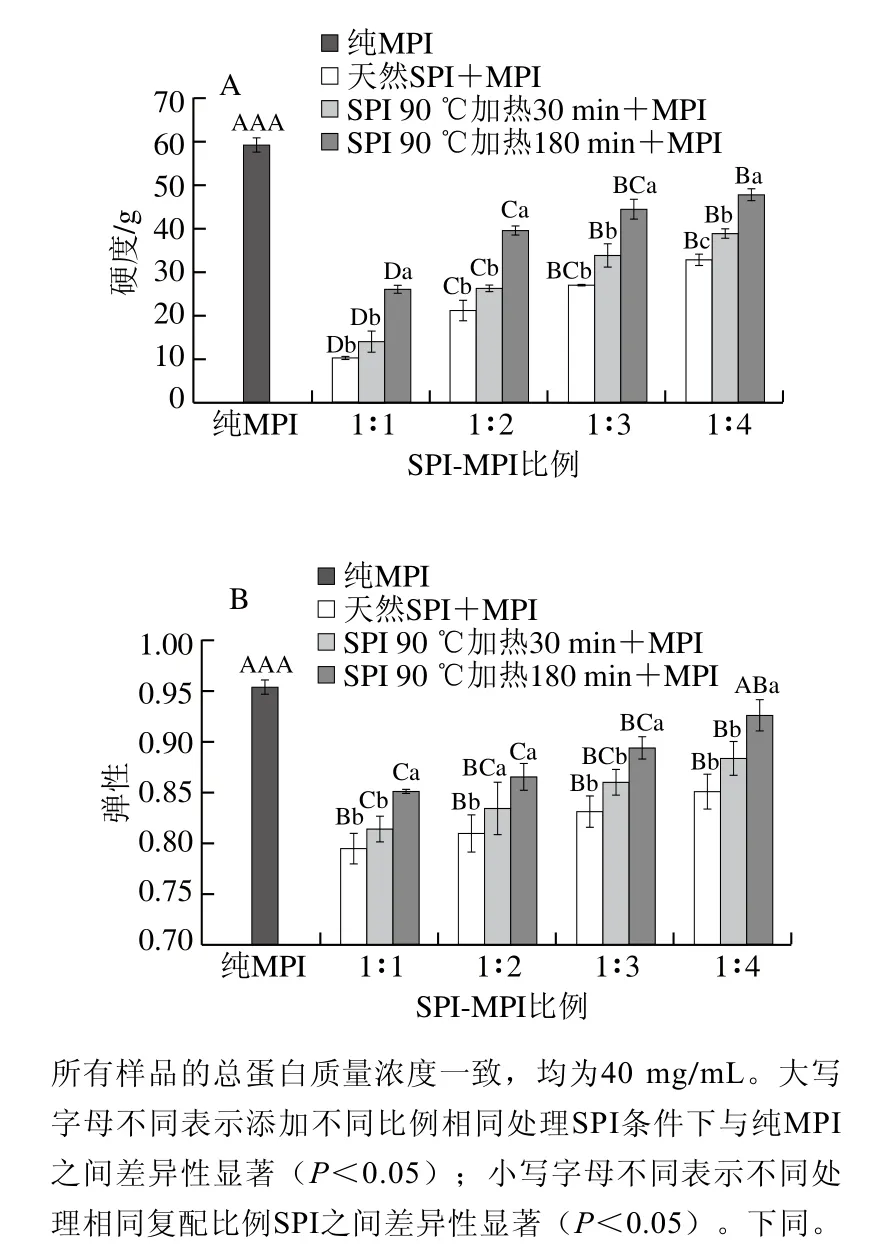
图1 SPI对MPI凝胶硬度(A)和弹性(B)的影响Fig. 1 Effect of SPI on hardness (A) and springiness (B) of common carp MPI gel
2.2 SPI对MPI凝胶白度值的影响
如图2所示,天然SPI与MPI混合后,蛋白凝胶白度值显著降低(P<0.05),随着SPI-MPI比例1∶1~1∶4,混合蛋白凝胶白度值显著增加(P<0.05)。这可能是因为SPI本身为淡黄色,与MPI混合后降低了混合蛋白的凝胶白度值,当MPI所占混合凝胶的占比增大时,SPI含量相对降低,使得凝胶白度值增加。而经过预热处理后的SPI与MPI混合所得到的蛋白凝胶白度值均高于天然SPI混合蛋白凝胶;经过较长时间预热处理SPI(180 min),其与MPI形成的混合蛋白的凝胶白度值显著高于短时间预热处理的SPI(30 min)(P<0.05),并且经过90 ℃热处理180 min的SPI-MPI比例为1∶4时,蛋白凝胶的白度值与纯MPI凝胶相比无显著差异(P>0.05)。这可能是因为经过热处理后7S和11S组分变性,导致混合蛋白凝胶光反射增强,从而增强了凝胶白度值。Saeed[23]和Niu Haili[24]等认为白度值降低可能是由于色素蛋白的变化引起的,特别是肌肉蛋白质氧化色素。
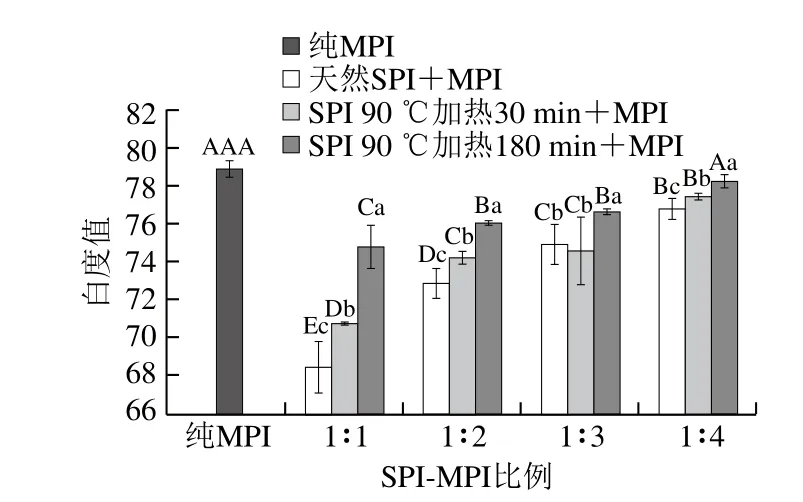
图2 SPI对MPI凝胶白度值的影响Fig. 2 Effect of SPI on whiteness of common carp MPI gel
2.3 SPI对MPI凝胶持水性的影响
凝胶的持水性是蛋白凝胶体系中最重要的功能特性之一[25]。不同SPI-MPI比例蛋白凝胶持水性如图3所示,纯MPI凝胶持水性为89.34%,当天然SPI与MPI混合后,蛋白凝胶持水性显著降低(P<0.05),而随着SPI-MPI比例由1∶1~1∶4,蛋白凝胶持水性显著增加(P<0.05)。当SPI-MPI比例为1∶1时形成的混合蛋白凝胶网络结构较差,这是由于SPI添加量过多时,两种蛋白质的疏水相互作用增强,凝胶网络束缚水分子的能力降低,在离心条件下,水分子很容易游离出来[26];当SPI添加量较小,也就是MPI比例增大时,会在一定程度上增强形成凝胶网络结构。这些结果与凝胶强度的变化趋势相似,它们都与蛋白质形成凝胶能力有关,而凝胶形成能力的增强与MPI中肌球蛋白有关,这些蛋白的利用效率增加便会强化热诱导形成致密的凝胶网络结构,不但提高了凝胶的强度,而且提高了凝胶的持水能力。当SPI经过热处理后与MPI按比例混合后,持水性显著高于天然SPI形成的凝胶(P<0.05),且热处理时间越长增加越明显。这可能是由于SPI经过热处理后,7S和11S组分结构发生改变,带电氨基酸残基数变多,水合能力增强。此外SPI热处理180 min后,随着MPI比例增加,呈现先增加后减小的趋势,且在SPI-MPI比例1∶3时凝胶持水性为91.02%,与纯MPI凝胶持水性差异不显著(P>0.05)。此时混合蛋白间的凝胶网络结构增强、空隙更加致密,通过虹吸截留的水分增多[27],从而提高了蛋白凝胶的持水性。
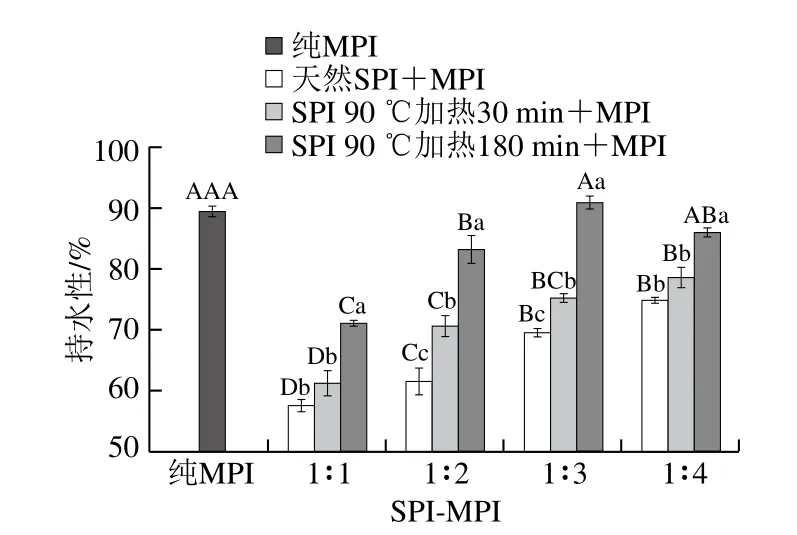
图3 SPI对MPI凝胶持水性的影响Fig. 3 Effect of SPI on WHC of common carp MPI gel
2.4 SPI对MPI凝胶流变学性质的影响
根据2.1节及2.3节等相关结果可知SPI-MPI比例为1∶3时混合蛋白硬度和持水性与纯MPI差异不显著(P>0.05)。因此选取SPI-MPI比例为1∶3的混合蛋白作为研究对象(下同),并与纯MPI溶液进行比较,研究混合蛋白热诱导凝胶流变性质(储能模量G’)的变化。如图4所示,纯MPI在初始阶段(20~30 ℃),G’随温度变化非常缓慢,说明此温度范围内蛋白间的相互作用比较弱,不足以形成预凝胶状态。当温度升至30 ℃以上时,G′迅速升高,43 ℃左右时达到第1个峰值,此时肌球蛋白头部区域展开形成头对头的疏水结构[28]。当温度继续升高至53 ℃左右时,G’曲线迅速下降,说明此时预凝胶状态形成,肌球蛋白尾结构发生改变,从而暴露了疏水性区域和特定的侧链基团[28]。Egelandsdal[29]和Liu Gang[30]等认为,当温度低于50 ℃时,重肌球蛋白变性(展开)及肌球蛋白细丝交联是导致G’初始增加的原因,而在温度升至50 ℃以上后,轻肌球蛋白的变性和细丝“流动性”增加导致G’下降。Wu Wei等[31]则认为G’的减少是由于形成凝胶网络速率常数的动力学限制造成的。随着温度的继续升高,G’又开始不断升高,说明此时更持久的不可逆的肌球蛋白丝或复合物的形成导致G’的稳定增加[11]。而Niu Haili等[14]认为是由于大部分肌球蛋白分子展开并形成无规卷曲结构,从而导致蛋白质聚集体之间的交联数量增加。
当SPI与MPI混合后,G’第1个峰值的出现温度与纯MPI相比升高了2~4 ℃。这是因为SPI的变性温度比MPI高,加入SPI相当于降低了MPI的含量从而导致G’峰值温度增加。这一点从蛋白热稳定性结果得到证实。此外,对于经过预热处理180 min的SPI组而言,G’第1个峰值由纯MPI的88.2 Pa降至70.6 Pa,而热处理30 min组和天然蛋白组则分别降至38.9 Pa和28.0 Pa。这是因为天然SPI中的β-伴大豆球蛋白能够减少从50 ℃加热到80 ℃期间肌球蛋白重链的自聚集,从而干扰MPI凝胶网络的形成;而预热处理实质上减少了11S酸性和碱性亚单位的聚集,使得碱性亚单位在随后的胶凝过程中保持解离形式与肌球蛋白相互作用[9]。另一方面,蛋白质凝胶的强度由掺入凝胶网络中的颗粒(聚集体)的量以及这些颗粒之间相互作用的强度决定[32]。SPI与MPI之间的相互作用不如MPI蛋白分子间的相互作用强,故而降低了G’峰值,但SPI通过预热处理改性后在一定程度上增强SPI与MPI之间的相互作用强度。
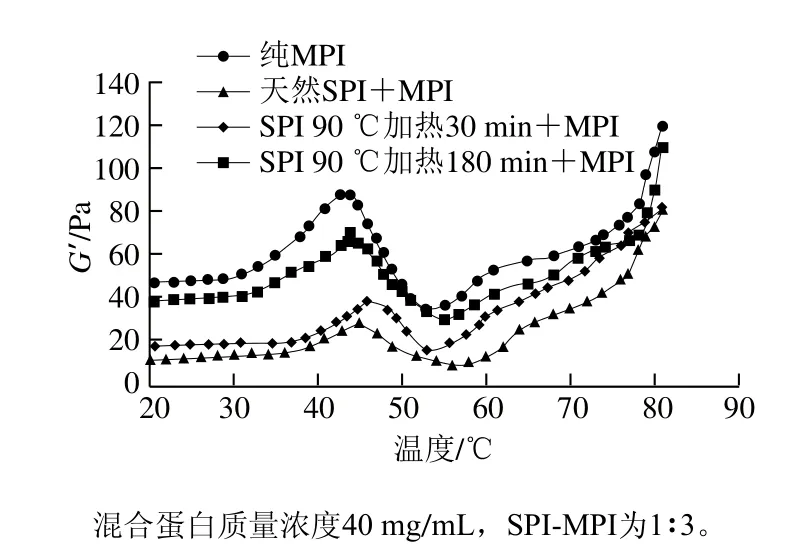
图4 SPI对MPI凝胶G’的影响Fig. 4 Effect of different types of SPI on storage modulus of common carp MPI
2.5 SPI对MPI热稳定性的影响
DSC技术适用于研究蛋白质的热变性[33]。如图5及表1所示,纯MPI的DSC扫描图谱呈现3 个主要峰值记为Tmax1(53.15 ℃)、Tmax2(63.48 ℃)和Tmax3(73.95 ℃),分别代表肌球蛋白重链、肌球蛋白轻链和肌动蛋白热变性温度。MPI中加入天然SPI后,Tmax1并没有显著改变(P>0.05);而加入热处理30 min和180 min的SPI后,Tmax1显著降低(P<0.05)。这可能是由于天然SPI与MPI之间不发生交联,而SPI分别热处理30 min和180 min后与肌球蛋白头部发生交联导致MPI凝胶热稳定性显著降低[34]。此外MPI中加入天然SPI后其DSC扫描图谱呈现4 个主要峰值Tmax1(53.30 ℃)、Tmax2(63.54 ℃)、Tmax3(71.60 ℃)和Tmax4(92.73 ℃),由图5可知,天然SPI组与纯MPI及热处理SPI组相比Tmax3峰较宽。这是由于7S和11S组分的变性温度分别在73~82 ℃和76~96 ℃之间[3],结合流变结果添加天然SPI后第1个峰值延后2~4 ℃可知,7S组分与肌动蛋白热变性温度较接近从而造成添加天然SPI组Tmax3峰较宽,而Tmax4对应SPI中11S组分变性温度。综合以上两点可知在混合蛋白中天然SPI与MPI分别独立存在。
当MPI中添加SPI后,Tmax2均无显著改变(P>0.05),说明肌球蛋白轻链与SPI间不发生交联或相互作用。而Niu Haili等[24]在极端酸性(pH 1.5)条件下结合适当加热(60 ℃)处理SPI 5 h,并将改性后的SPI与MPI复配也得到类似的结果。相反MPI中添加天然SPI和热处理30 min SPI后与纯MPI组相比Tmax3显著降低(P<0.05);而MPI中添加热处理180 min SPI后,Tmax3显著增大(P<0.05)。这是由于肌动蛋白与SPI发生交联,形成紧凑、有序构象的高分子质量生物聚合物,从而导致肌动蛋白变性温度升高[16]。另一方面,MPI中添加热处理30 min的SPI后,Tmax4显著降低(P<0.05),而添加热处理180 min的SPI后,Tmax4消失。从而进一步说明热处理有利于SPI与肌动蛋白之间发生交联,导致肌动蛋白的变性温度升高及Tmax4消失。
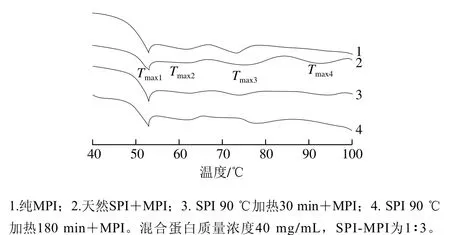
图5 SPI对MPI凝胶热稳定性的影响Fig. 5 Effect of different types of SPI on thermal stability of common carp MPI
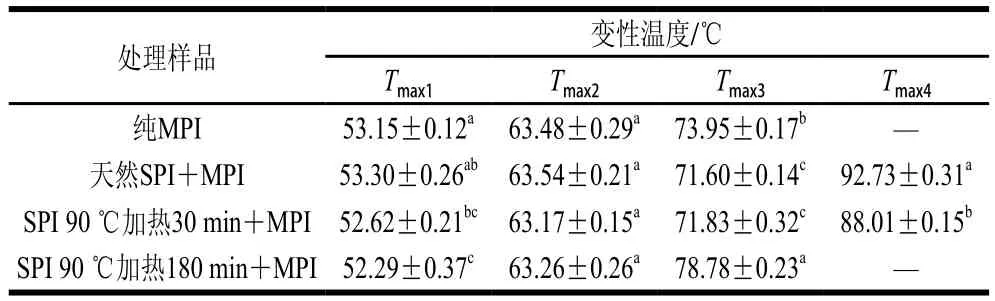
表1 SPI对MPI凝胶最大变性温度的影响Table 1 Effect of different types of SPI on maximum transition temperatures (Tmax) of common carp MPI
3 结 论
经过预热处理的SPI与MPI复配能够改进混合蛋白凝胶性和流变性。预热处理(90 ℃加热30 min和180 min)的SPI与MPI混合形成的凝胶,其硬度、弹性、白度和持水性显著高于天然SPI与MPI混合蛋白凝胶,这表明预热处理后的SPI在一定添加比例下具有改善蛋白凝胶特性的作用。流变学研究结果表明,添加SPI会提高蛋白变性温度。经过预热处理的SPI与MPI混合后,其G’尽管低于纯的MPI,但是显著高于未经过预热处理的SPI。热稳定性结果表明,天然SPI与MPI之间不发生交联而热处理能够促进SPI与MPI之间发生交联。以上结果表明,SPI经过预热处理后与鲤鱼MPI按一定比例复配能够显著改善混合蛋白质的凝胶性、流变性和热稳定性。综上,在鱼糜生产中,添加经过预热处理的SPI对于提高鱼糜制品的凝胶品质具有很大的应用潜力。
