氟尿嘧啶植入剂对宫颈癌Hela细胞增殖和凋亡的影响△
2019-07-01黄鹏翀李晨辉王焱
黄鹏翀,李晨辉,王焱
河南科技大学临床医学院,河南科技大学第一附属医院1妇科,2麻醉科,河南 洛阳4710000
宫颈癌是女性最常见的恶性肿瘤之一,在中国其发病率仅次于乳腺癌居第二位,且呈年轻化趋势,严重威胁患者的身心健康[1-2]。5-氟尿嘧啶(5-fluorouracil,5-FU)是一种临床常用的抗肿瘤药物,可通过抑制核酸的合成而干扰细胞的正常生长,但5-FU存在首过效应,且半衰期短、生物利用度低,易导致骨髓抑制,严重影响患者的疗效及预后[3-4]。为提高5-FU疗效,并降低其不良反应发生率,经过多年的研究,科研工作者终于研发一种缓释植入剂——氟尿嘧啶植入剂[5]。研究表明,氟尿嘧啶植入剂治疗宫颈癌疗效确切,且不良反应较轻,该药可局部缓慢释放5-FU,从而提高肿瘤组织中5-FU的浓度,在增强抗肿瘤疗效的同时,降低不良反应发生率[6-7]。B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2,Bcl-2)蛋白是Bcl-2原癌基因的编码产物,是一种抗凋亡蛋白,可抑制线粒体释放细胞色素c,从而抑制细胞凋亡。一般认为,caspase 3是细胞凋亡过程中最主要的终末剪切酶,也是细胞毒性T细胞(cytoxic T lymphocyte,CTL)杀伤机制的重要组成部分。目前,关于氟尿嘧啶植入剂治疗宫颈癌的研究较少,本研究拟通过观察氟尿嘧啶植入剂对宫颈癌Hela细胞增殖凋亡,以及对Bcl-2、caspase 3蛋白相对表达量的影响,为氟尿嘧啶植入剂治疗宫颈癌的应用提供理论依据,现报道如下。
1 材料与方法
1.1 细胞和主要试剂
人宫颈癌Hela细胞株购自美国模式菌种收集中心(American Type Culture Collection,ATCC)细胞库。青链霉素、DMEM培养基、胰蛋白酶和胎牛血清均购自美国Gibco公司,放射免疫沉淀(radioimmunoprecipitation assay,RIPA)裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶试剂、电化学发光(electrochemiluminescence,ECL)液、CCK8试剂盒和二喹啉甲酸(bicinchoninic acid,BCA)试剂盒均购自碧云天生物技术有限公司,膜联蛋白V(AnnexinⅤ)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡试剂盒购自美国Immunoway Technoloyg公司,鼠抗β-actin单克隆抗体、兔抗Bcl-2单克隆抗体和兔抗caspase 3单克隆抗体均购自美国Cell Signal Technology公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠免疫球蛋白G(immunoglobulin G,IgG)和HRP标记的山羊抗兔IgG均购自上海生物工程有限公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国MilliPore公司。
1.2 实验方法
1.2.1 细胞培养及分组宫颈癌Hela细胞在1%青霉素、1%链霉素和10%胎牛血清的DMEM培养基,37℃、5%CO2的恒温箱中培养。待细胞融合度为70%~80%时,采用0.25%的胰蛋白酶在37℃恒温箱中消化2~3 min,按照1∶4的比例传代培养。将对数生长期的Hela细胞以每孔5×103/ml的浓度接种于96孔培养板,将分别加入5-FU和氟尿嘧啶植入剂的细胞分别作为5-FU组和氟尿嘧啶组,未处理的细胞作为对照组,每组均设5个复孔。
1.2.2 CCK 8法检测细胞增殖能力根据预实验和参考文献[8-9]的结果,设定5-FU和氟尿嘧啶植入剂终浓度均为20.0 mg/L。5-FU组和氟尿嘧啶组细胞分别给予20.0 mg/L的5-FU和氟尿嘧啶植入剂,对照组细胞未处理,3组细胞干预1、2、3、5、7天后,每孔加入5%的CCK8溶液10 μl,继续培养箱孵育2 h。采用酶标仪于450 nm波长处检测吸光度(optical density,OD)值,比较3组细胞的增殖能力。实验重复3次,取均值。
1.2.3 流式细胞仪检测细胞凋亡情况取1×104/ml浓度的细胞悬液接种于12孔板,每孔1 ml,细胞贴壁后,5-FU组和氟尿嘧啶组细胞分别给予20.0 mg/L的5-FU和氟尿嘧啶植入剂,对照组细胞未处理,3组细胞孵育1、3、7天,胰蛋白酶消化后收集细胞。采用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤 3次,加入 500 μl的结合液悬浮细胞,然后暗室中加入5 μl的Annexin Ⅴ-FITC,然后加入5 μl的PI混匀,室温避光孵育15 min,采用流式细胞仪检测细胞凋亡情况。实验重复3次,取均值。
1.2.4 蛋白质印迹法(Western blot)检测Bcl- 2、caspase3蛋白的相对表达量 取3组细胞加入相应药物后孵育 1、3、7天,每孔加入 100 μl的 RIPA裂解液,冰浴30 min后,4℃低温12 000 r/min离心10 min,BCA法测定蛋白含量,每孔加入50 μg的蛋白样品,SDS-PAGE电泳80~120 V分离蛋白,150 mA的电流将蛋白转移至PVDF膜,10%脱脂奶粉室温封闭2 h,一抗(稀释浓度为1∶1000)4℃孵育过夜,二抗(稀释浓度为1∶5000)室温孵育2 h,ECL液显影,手动曝光。实验重复3次,取均值。
1.3 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,不同时间点比较采用重复测量方差分析,多组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞增殖情况的比较
3组细胞干预不同时间点(干预1、2、3、5、7天)的OD值比较,差异有统计学意义(F时间=356.324,P时间<0.01)。3组细胞OD值比较,差异有统计学意义(F组间=247.583,P组间<0.01),其中干预2、3、5、7天时,5-FU组细胞的OD值均低于对照组细胞,但仅干预5、7天时,氟尿嘧啶组细胞的OD值均低于对照组细胞,差异均有统计学意义(P<0.05);干预2、3、5天时,氟尿嘧啶组细胞OD值均高于5-FU组细胞,差异均有统计学意义(P<0.05),但干预7天时,氟尿嘧啶组细胞OD值与5-FU组细胞比较,差异无统计学意义(P>0.05)。3组细胞在组间及时间之间存在交互作用(F时间×组间=478.321,P时间×组间<0.01)。(表1)
表1 不同时间点 3组Hela细胞OD值的比较(±s)

表1 不同时间点 3组Hela细胞OD值的比较(±s)
注:a与对照组比较,P<0.05;b与5-FU组比较,P<0.05
时间干预1天干预2天干预3天干预5天干预7天对照组0.48±0.10 0.83±0.09 1.10±0.11 1.14±0.15 1.20±0.12 5-FU组0.44±0.07 0.65±0.08a 0.84±0.12a 0.82±0.09a 0.81±0.07a氟尿嘧啶组0.44±0.08 0.81±0.07b 1.02±0.15b 0.97±0.12a b 0.83±0.10a
2.2 细胞凋亡情况的比较
3组细胞干预不同时间点(干预1、3、7天)的凋亡率比较,差异有统计学意义(F时间=1453.567,P时间<0.01)。3组细胞凋亡率比较,差异有统计学意义(F组间=1125.628,P组间<0.01),其中干预3天时,氟尿嘧啶组细胞凋亡率低于5-FU组细胞和对照组细胞,但5-FU组细胞凋亡率高于对照组细胞,差异有统计学意义(P<0.05);干预7天时,氟尿嘧啶组和5-FU组细胞凋亡率均高于对照组细胞,差异均有统计学意义(P<0.05)。3组细胞在组间及时间之间存在交互作用(F时间×组间=889.674,P时间×组间<0.01)。(表2、图1)
表2 不同时间点 3组Hela细胞凋亡率的比较(%,±s)
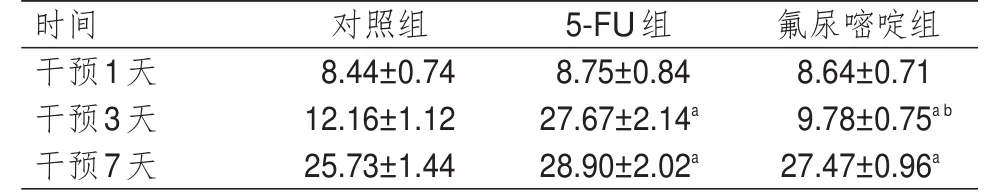
表2 不同时间点 3组Hela细胞凋亡率的比较(%,±s)
注:a与对照组比较,P<0.05;b与5-FU组比较,P<0.05
时间干预1天干预3天干预7天对照组8.44±0.74 12.16±1.12 25.73±1.44 5-FU组8.75±0.84 27.67±2.14a 28.90±2.02a氟尿嘧啶组8.64±0.71 9.78±0.75a b 27.47±0.96a
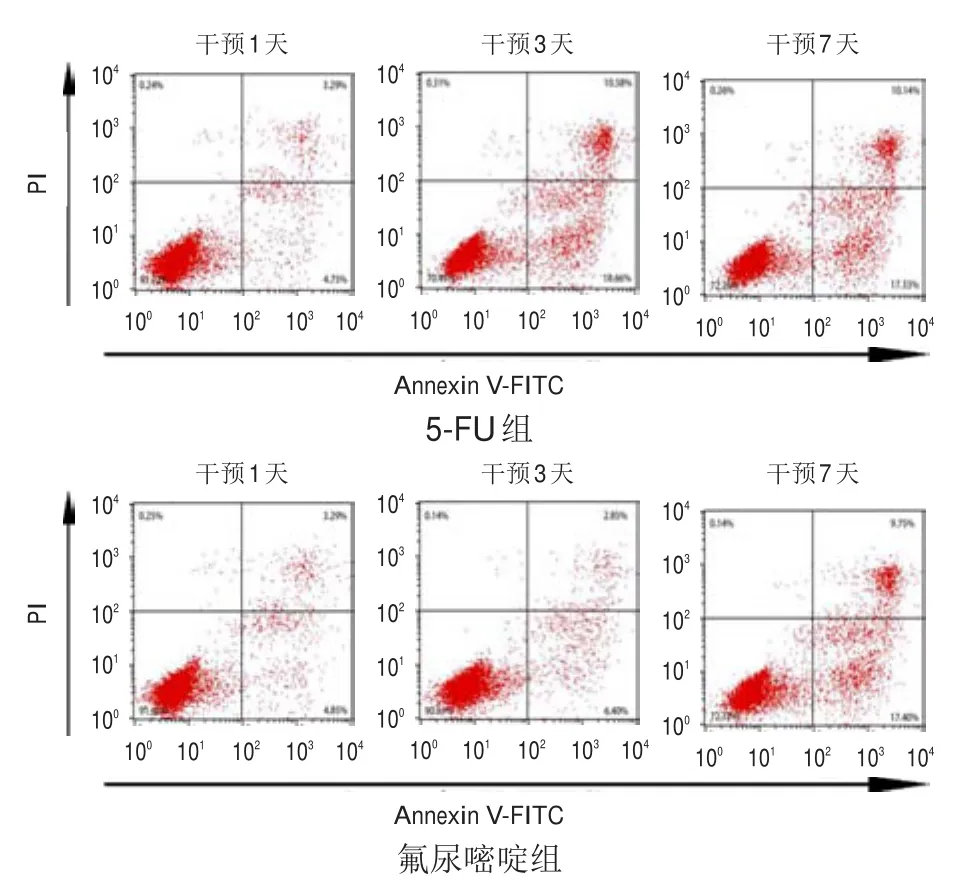
图1 流式细胞仪检测不同时间点5-FU组和氟尿嘧啶组Hela细胞凋亡情况
2.3 Bcl- 2、caspase 3蛋白相对表达量的比较
3组细胞干预不同时间点(干预1、3、7天)的Bcl-2、caspase 3蛋白相对表达量比较,差异均有统计学意义(F时间=385.427、257.634,P时间<0.01)。3组细胞Bcl-2、caspase 3蛋白相对表达量比较,差异均有统计学意义(F组间=245.63、329.116,P组间<0.01),其中干预3、7天,5-FU组和氟尿嘧啶组细胞Bcl-2蛋白相对表达量均低于对照组细胞,caspase 3蛋白相对表达量均高于对照组细胞,差异均有统计学意义(P<0.05)。3组细胞在组间及时间之间存在交互作用(F时间×组间=304.776、407.225,P时间×组间<0.01)。(表 3)
表3 不同时间点3组细胞Bcl- 2、caspase 3蛋白相对表达量的比较(±s)
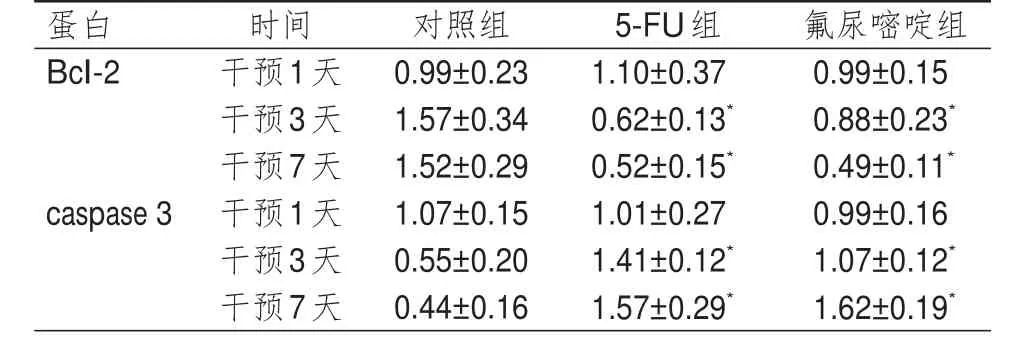
表3 不同时间点3组细胞Bcl- 2、caspase 3蛋白相对表达量的比较(±s)
注:*与对照组比较,P<0.05
蛋白Bcl-2 caspase 3时间干预1天干预3天干预7天干预1天干预3天干预7天对照组0.99±0.23 1.57±0.34 1.52±0.29 1.07±0.15 0.55±0.20 0.44±0.16 5-FU组1.10±0.37 0.62±0.13*0.52±0.15*1.01±0.27 1.41±0.12*1.57±0.29*氟尿嘧啶组0.99±0.15 0.88±0.23*0.49±0.11*0.99±0.16 1.07±0.12*1.62±0.19*
3 讨论
5-FU自1957年问世以来就已被广泛应用于食管癌、胃癌、卵巢癌、宫颈癌和乳腺癌等多种恶性肿瘤的临床治疗。5-FU可转化为氟尿嘧啶脱氧核苷酸,与胸腺嘧啶合成酶结合,抑制脱氧嘧啶核苷酸转化为胸腺嘧啶核苷酸,从而干扰DNA的正常合成,起到抑制肿瘤细胞生长的作用[10]。研究表明,5-FU抗肿瘤疗效确切,但存在生物利用度低、半衰期短、亲脂性弱、治疗窗窄等缺点,因此,通过对5-FU进行结构修饰或将5-FU包裹于特殊的载体材料中,可以延长5-FU的体内滞留时间,在增强药效的同时,最大限度地降低不良反应而成为研究热点[11-12]。
氟尿嘧啶植入剂是一种新型的5-FU制剂,该药物将5-FU包裹于高分子聚合物骨架中,通过膜层渗透、扩散原理调控5-FU的释放速度和作用时间。氟尿嘧啶植入剂进入特定部位后,可随体液缓慢释放,形成5-FU浓度梯度,具有达到靶向部位的药物浓度较高、药物持续时间长的优势,不仅可保证药物的有效性和稳定性,还能够使靶标之外部位的药物浓度处于较低水平,降低不良反应发生率[13-14]。目前,氟尿嘧啶植入剂已广泛应用于乳腺癌[15]、结直肠癌[16]、胃癌[17]等恶性肿瘤的临床治疗,临床疗效较好,不良反应程度较轻[18]。本研究为进一步巩固氟尿嘧啶植入剂治疗宫颈癌的理论基础,采用宫颈癌Hela细胞探讨氟尿嘧啶植入剂的抗肿瘤作用,并从细胞凋亡方面研究其分子作用机制。
在本研究中,采用CCK8法检测细胞增殖能力,结果表明,5-FU和氟尿嘧啶植入剂均可抑制细胞的增殖能力,但氟尿嘧啶植入剂起效时间较晚,这可能与氟尿嘧啶植入剂属于缓释制剂有关,其达到有效药物浓度需要一定时间。干预7天时,氟尿嘧啶植入剂抑制细胞增殖的能力与5-FU无明显差异,表明氟尿嘧啶植入剂作为5-FU的缓释制剂,该剂型本质上可延长5-FU的作用时间,且疗效确切。流式细胞仪检测细胞凋亡情况结果显示,5-FU和氟尿嘧啶植入剂导致的细胞凋亡率逐渐增加,但随着作用时间的延长,氟尿嘧啶植入剂诱导的细胞凋亡逐渐与5-FU趋于一致。研究显示,Bcl-2和caspase 3是细胞凋亡研究中的关键蛋白,Bcl-2可抑制细胞凋亡,caspase 3可促进细胞凋亡,且该过程可被Bcl-2阻断[19]。本研究结果显示,干预3、7天时,5-FU组和氟尿嘧啶组细胞Bcl-2蛋白相对表达量均低于对照组细胞,caspase 3蛋白相对表达量均高于对照组细胞,差异均有统计学意义(P<0.05)。表明氟尿嘧啶植入剂不仅可以上调caspase 3的表达,还可抑制Bcl-2蛋白的表达,具有启动Hela细胞凋亡程序的作用。
综上所述,氟尿嘧啶植入剂可能通过上调caspase 3的表达,下调Bcl-2的表达,从而抑制宫颈癌Hela细胞的增殖,与促进细胞凋亡有关。
