星点设计-效应面法优化复合酶解酪蛋白制备抗凝血肽的工艺研究
2019-07-01吴雄夏建开苗艳丽陈绍红张兆霞郭婉婷李棂灵
吴雄,夏建开,苗艳丽,陈绍红,张兆霞,郭婉婷,李棂灵
(1.广东海洋大学化学与环境学院,广东 湛江 524088;2.广东海洋大学食品科技学院现代生物化学实验中心,广东 湛江 524088)
心脑血管疾病已成为我国发病率、致死率最高的疾病,其中大部分疾病与血栓相关[1],而血管内血栓形成的主要因素是凝血酶诱发的血液凝固[2]。凝血酶分子表面有一个富含碱性氨基酸的活性部位(fibrinogen recognition site,FRS),能特异性与纤维蛋白原结合并将其裂解成为纤维蛋白,从而导致血液凝固[3]。天然水蛭素是从吸血水蛭唾液腺中分离出来的多肽[4],C 端为活性部位,含较多酸性氨基酸,具有强烈的抗凝血酶活力,对防治多种血栓性疾病以及溶解术后形成的血栓都有较好效果[5-6],国内外试图将其开发成新一代高效特异性抗凝、溶栓药物[1]。水蛭素 C 端与凝血酶分子FRS在一定pH条件下按1∶1结合,形成凝血酶-水蛭素复合物,抑制了凝血酶对纤维蛋白原的激活作用,从而避免了血液的凝固。根据该原理,利用凝血酶滴定改进法[7]可用水蛭素标准液测定凝血酶的浓度,从消耗的水蛭素量得知凝血酶的量;或者以凝血酶标准液测定水蛭素的浓度,根据消耗的凝血酶量得知水蛭素的量。
天然水蛭素的来源有限制约了其广泛使用。研究发现,酪蛋白分子中含有若干具有抗凝血酶活性的肽段[抗凝血肽(anticoagulant peptide,AP)、抗血栓肽][8-10],在合适的工艺条件下水解酪蛋白,可获得功能与水蛭素类似的AP,且六肽及以下的小肽能被肠道直接吸收[11]。前期我们已经利用木瓜蛋白酶、菠萝蛋白酶、中性蛋白酶和碱性蛋白酶进行酪蛋白多酶混合水解,发现水解后的产物具有较强的抗凝血酶活力[12]。本实验旨在通过星点设计-效应面法来优化复合酶解酪蛋白的工艺条件,运用凝血酶滴定改进法测定其体外抗凝血活性,并用活性最高的酪蛋白复合酶解液做体外溶栓和抗凝血实验,初步评价其体外抗凝血活性与溶栓效果,为日后开发以酪蛋白作原料的防治血栓性疾病的口服小肽类药物或功能性食品提供理论及实验依据。
1 材料与方法
1.1 材料与仪器 酪蛋白(上海源叶生物科技有限公司);胰蛋白酶(2.5×105U·g-1)、胰糜蛋白酶(1.5×106U·g-1)、木瓜蛋白酶(5×105U·g-1)、菠萝蛋白酶(3.2×105U·g-1)、凝血酶(1 000 U/瓶)购自上海源叶生物科技有限公司;纤维蛋白原(牛血纤维蛋白原,美国Biosharp公司);盐酸(广州化学试剂二厂);新西兰大白兔,两只,雌雄各一只,普通级,质量2.3~2.5 kg,广东省医学动物实验中心,生产证号:SCXX(粤)2017-0035。其他试剂均为分析纯。
恒温水浴振荡器(沈阳莱克斯仪器制造有限公司);MP200A型电子天平(上海精科电子有限公司);电热恒温水浴锅(沈阳莱克斯仪器制造有限公司);高速台式离心机(上海安亭科学仪器厂);TU-1901型双光束紫外可见光分光光度计(北京普析通用仪器有限责任公司);F100数码照相机(日本富士公司)。
1.2 实验方法
1.2.1 酪蛋白总氮含量的测定 本实验利用凯氏定氮法测定酪蛋白中的氮含量[13]。本实验测得酪蛋白的总氮含量为9.8%。
1.2.2 酶活力的测定 本实验用福林法和紫外分光光度法对4种蛋白酶(胰蛋白酶、胰糜蛋白酶、菠萝蛋白酶和木瓜蛋白酶)的实际活力进行测定。具体操作要求参考刘恭等[9,14]文献中的方法。对所用的4种蛋白酶的酶蛋白活力测定结果如表1所示。

表1 4种蛋白酶的活力
1.2.3 水解度的测定 在许多关于蛋白质的酶解过程研究中都是采用水解度(DH)来衡量反应进程的参量[14]。本试验利用甲醛滴定法来测定酪蛋白酶解液的水解度[15]。
1.2.4 单因素试验确定最佳料水比 取5个锥形瓶,分别称取5.0 g酪蛋白,制备成pH为8.0,料水比(m/V)分别为1∶3、1∶5、1∶7、1∶9、1∶11的酪蛋白溶液。然后加入酶用量为4 000.00 U/(g底物)的胰蛋白酶,并在50.00 ℃的恒温条件下水解3 h,水解完成后灭活10 min,冷却后再以5 000 rpm的速率离心10 min,最后定量量取离心后上层澄清液测定水解度。
1.2.5 星点设计-效应面法 星点设计-效应面法是先通过拟合效应变量对因变量的效应面,然后利用效应面的最佳效应区反推得到自变量最优值的优化法[16]。本文以A(pH)、B(水解温度)、C(酶用量)、D(水解时间)为自变量,以水解度(DH)为因变量,运用星点设计—效应面法进行预测和分析。
1.2.6 复合酶酶解酪蛋白制备酶解液 以“胰蛋白酶-胰糜蛋白酶”组合为例,取料水比为(m/V)1∶7的酪蛋白溶液20.0 mL于锥形瓶中,在胰蛋白酶的最佳条件下反应,反应结束后灭活10 min;冷却到预定温度后加入胰糜蛋白酶,在胰糜蛋白酶的最佳条件下反应,反应结束后取出并灭活,冷却至室温后以5 000 rpm转速离心10 min,取上清液来测定水解度。其他组合也同以上步骤。
1.2.7 酪蛋白酶解液抗凝血活性的测定[7]
1.2.7.1 配制不同浓度的凝血酶溶液 以20 NIH·mL-1的浓度作为一个基准浓度,即作为一倍。以5 μL该溶液作为一个滴定体积,相当于0.1 ATU酪蛋白活力肽:20 NIH/(1000 μL/5 μL)=20 NIH/200=0.1 NIH,因为1 NIH=1 ATU,所以0.1 ATU=0.1 NIH。配20 NIH·mL-1溶液(作为基准浓度,即为1倍),配40 NIH·mL-1溶液(即为2倍),配100 NIH·mL-1溶液(即为5倍),配400 NIH·mL-1溶液(即为20倍)。
1.2.7.2 配纤维蛋白原溶液 ①配0.2 mol·L-1的三羟甲基氨基甲烷溶液:用蒸馏水溶解1.214 g的三羟甲基氨基甲烷,然后置于50 mL的容量瓶中定容即可。②配制pH为7.40 的Tris-HCl溶液:量取0.2 mol·L-1三羟甲基氨基甲烷溶液25.0 mL,加入0.1 mol·L-1HCl溶液40.0 mL,然后用pH计将溶液的pH调到7.40即可。③配制含有0.05 mol·L-1NaCl的0.5 mol·L-1Tris-HCl溶液:量取pH为7.40的Tris-HCl溶液20.0 mL,然后加入氯化钠0.06 g即可。④配制0.5%的纤维蛋白原溶液:称取纤维蛋白原5.0 g,再用含0.05 mol·L-1氯化钠的0.5 mol·L-1Tris-HCl溶液稀释到0.5%即可。
1.2.7.3 抗凝血活性测试 取几支玻璃小试管,用移液枪移取200 μL 的0.5%纤维蛋白原于试管中,然后再加入50 μL样品液,于37.00 ℃恒温水浴锅中恒温保持5 min。
其中一支玻璃小试管滴加5 μL 五倍的凝血酶溶液,立即摇匀,如果1 min内凝固,表示50 μL酶解液中含有的抗凝血活性小于0.5 ATU。为了准确确定该酶解液的抗凝血活性,再取其中一支试管并加入5 μL 一倍凝血酶溶液,立即摇匀,如果1 min内凝固,表示50 μL酶解液中含有的抗凝血活性低于0.1 ATU;如果1 min内不凝固,表示其抗凝血活性高于0.1 ATU,再滴加5 μL 一倍凝血酶溶液,立即摇匀,如果1 min内凝固,表示其抗凝血活性低于0.2 ATU;如果1 min内不凝固,表示其抗凝血活性高于0.2 ATU,再滴加5 μL 一倍凝血酶溶液,立即摇匀,直至凝固出现,从而确定该酶解液的活性[12]。利用此原理,直至测出酶解液的活性。
2 结果与分析
2.1 单因素试验确定最佳料水比 按照“1.2.4”项下步骤进行试验。结果显示,料水比(m/V)分别为1∶3、1∶5、1∶7、1∶9、1∶11的酪蛋白溶液,在pH为8.00,水解温度为50.00 ℃,酶用量4 000.00 U/(g底物),水解时间为3 h的平行条件下测得的水解度分别为3.8%、5.0%、7.3%、5.4%、4.8%。可看出,随着料水比的增加,水解度先增大后减小。这是由于当加水量适宜时,酶与底物充分接触,有利于酶促反应。但随着加水量继续增加,酶浓度会降低,使得底物接触的单位酶量减少,不利于酶促反应。在料水比为1∶7(m/V)时,水解度达到最大值,因此胰蛋白酶酶解酪蛋白最佳料水比选1∶7(m/V)。
2.2 方案设计 胰蛋白酶酶解酪蛋白的星点设计见表2,试验结果见表3,方差分析见表4。

表2 胰蛋白酶酶解酪蛋白的星点设计表
由表4可知,4种因素对酪蛋白水解度都有显著的影响(P<0.05),显著性大小依次为:酶用量>水解温度>水解时间>pH。其中酶用量这一因素表现为极显著,对水解度的影响最大,而pH对水解度的影响最小。
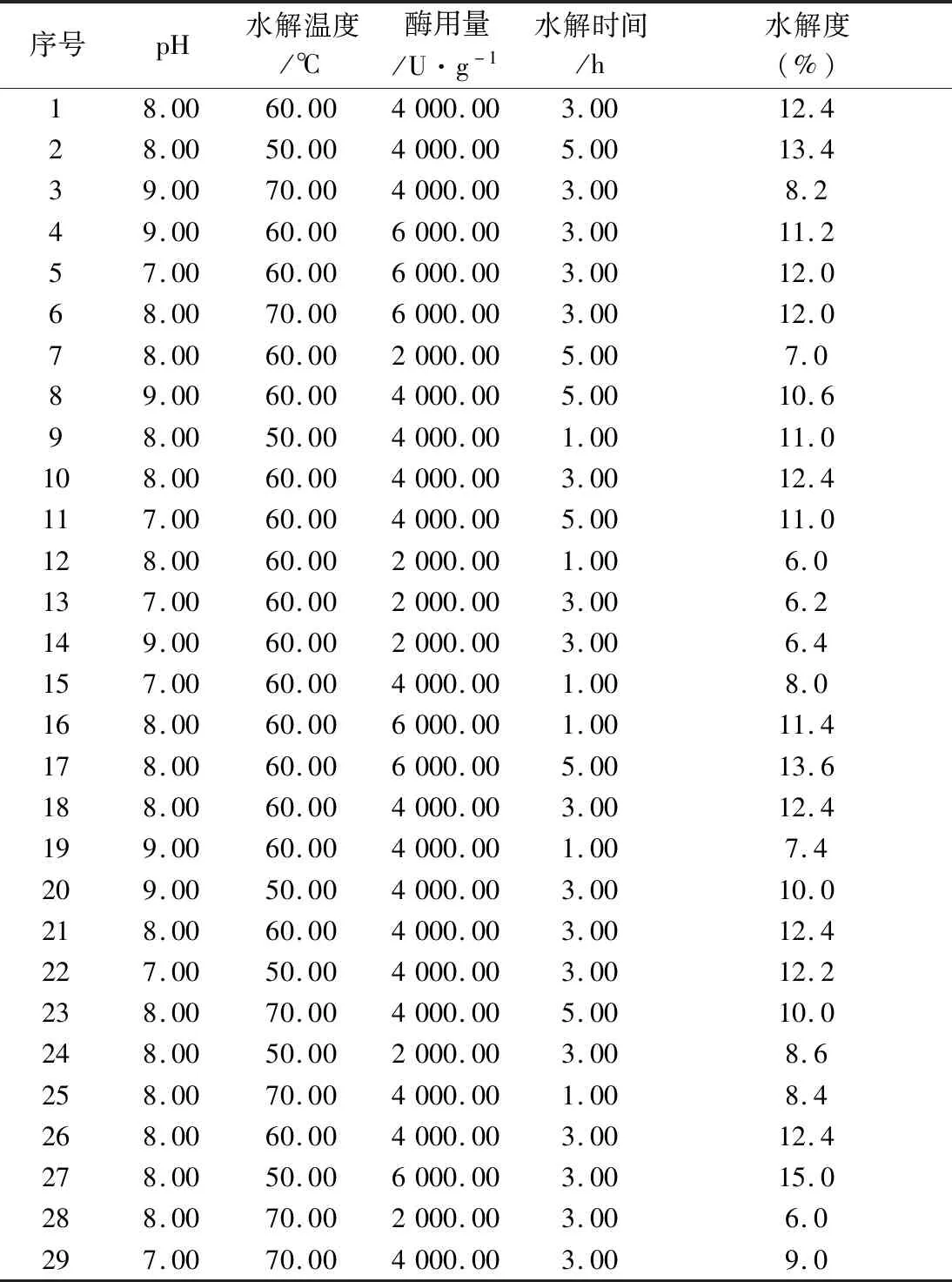
表3 星点设计胰蛋白酶酶解酪蛋白的试验结果

表4 效应面试验结果的方差分析
2.3 效应面分析 以因变量(水解度)拟合数学模型为基础来描绘效应面,效应面分析结果分别见图1~6。
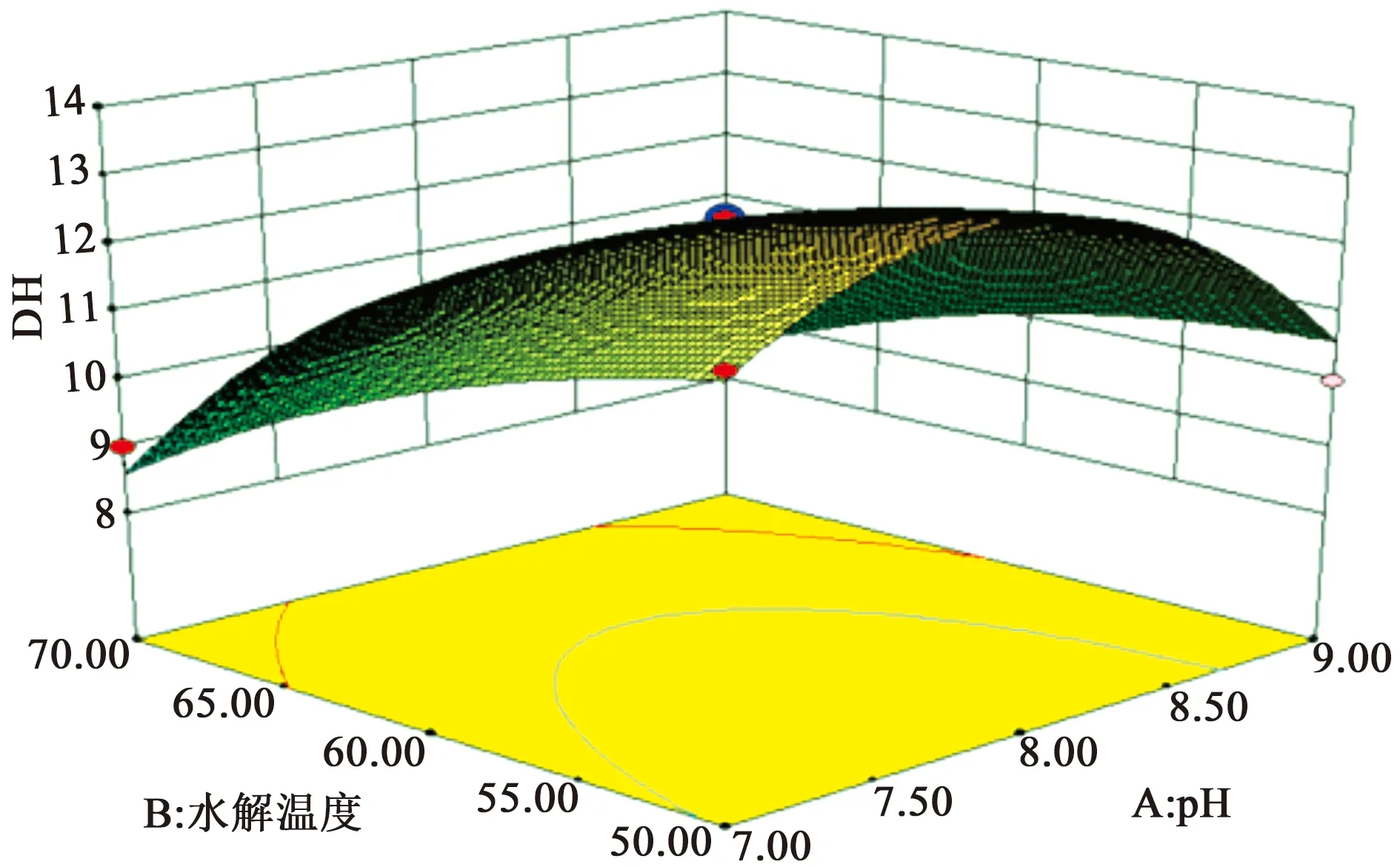
图1 pH和水解温度对酪蛋白水解度的响应面分析

图2 pH和酶用量对酪蛋白水解度的响应面分析
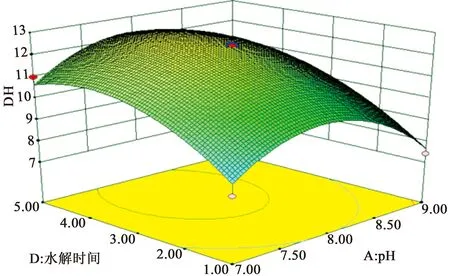
图3 pH和水解时间对酪蛋白水解度的响应面分析

图4 水解温度和酶用量对酪蛋白水解度的响应面分析

图5 水解温度和水解时间对酪蛋白水解度的响应面分析

图6 酶用量和水解时间对酪蛋白水解度的响应面分析
图1所示当pH从7.0逐渐增加到8.0的时候,水解度不断增加,在pH值8.0时水解度达到最大值,当pH值超过8.0后,水解度又逐渐下降,由此可知酶的最适pH为8.0。水解温度对酪蛋白水解度的影响成反比,由图可看出最佳水解温度为50 ℃,温度增加,水解度反而下降。酶的化学本质是蛋白质,温度过高可引起蛋白质变性,导致酶的失活。在相同的水解度下,随着pH增加,温度逐渐偏向最佳。
图2表明酶用量对酪蛋白水解度的影响成正比,由图可看出最佳酶用量为5 500.00 U/(g底物)。而且相对于pH,酶用量对酪蛋白水解度的影响比较大。在相同的酪蛋白水解度下,随着pH增加,酶用量逐渐偏向最佳。
图3和图5表明时间对酪蛋白水解度的影响成正比,从节约时间,提高生产效率和降低成本的角度出发,由图可看出最佳时间为3.80 h。在相同的水解度下,随着pH增加,时间逐渐偏向最佳。
图4表明相对于温度,酶用量对酪蛋白水解度的影响比较大。在相同的水解度下,随着温度增加,酶用量逐渐偏向最佳。
图6表明酶用量和时间对酪蛋白水解度的影响成正比,而且相对于时间,酶用量对酪蛋白水解度的影响比较大。在相同的水解度下,随着时间增加,酶用量逐渐偏向最佳。
根据试验结果和软件拟合的胰蛋白酶酶解酪蛋白最佳条件为:pH为8.00、温度为50.00 ℃、酶用量为6 000.00 U/(g底物)、时间为3 h,水解度预测为15.0%。3次试验验证结果,水解度分别为14.7%、14.9%、15.5%,平均水解度为15.0%。
另外,胰糜蛋白酶、菠萝蛋白酶和木瓜蛋白酶的最佳反应条件也运用星点设计-效应面法来预测分析,根据试验结果,3种蛋白酶酶解酪蛋白的最佳条件分别为:菠萝蛋白酶:pH为6.50、温度为60.00 ℃、酶用量为12 000.00 U/(g底物)、时间为3 h、料水比为1∶7(m/V);胰蛋白酶和胰糜蛋白酶:pH为8.00、温度为50.00 ℃、酶用量为6 000.00 U/(g底物)、时间为3 h、料水比为1∶7(m/V);木瓜蛋白酶:pH为6.50、温度为60.00 ℃、酶用量为4 000.00 U/(g底物)、时间为3 h、料水比为1∶7(m/V)。
2.4 复合酶解酪蛋白制备酶解液 按照“1.2.6”项下步骤进行试验。复合酶解酪蛋白制备酶解液的酶组合、水解度和抗凝血活性测试结果见表5。
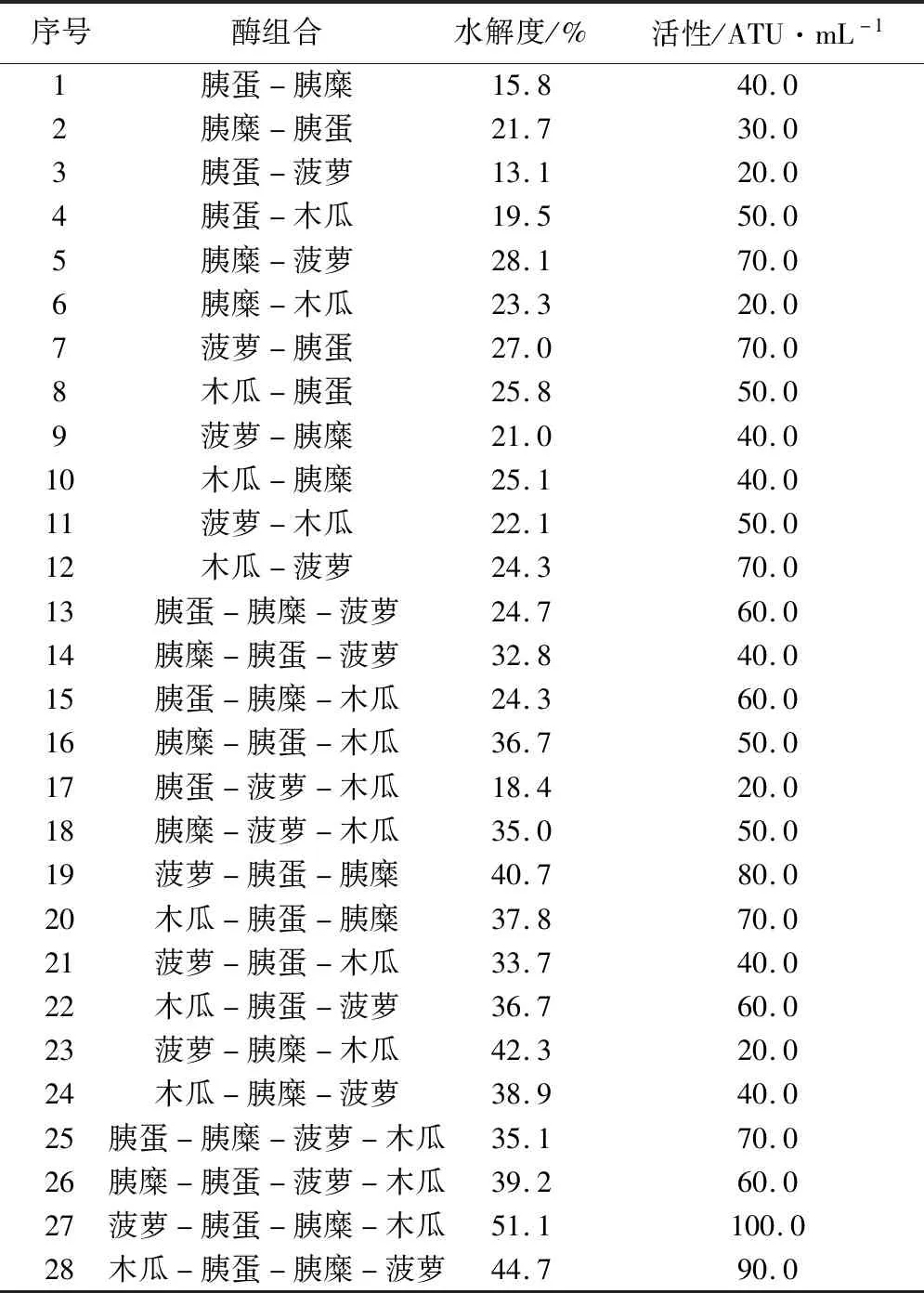
表5 酪蛋白酶解液的酶组合、水解度和抗凝血活性结果
注:“胰蛋”、“胰糜”、“菠萝”和“木瓜”分别指胰蛋白酶、胰糜蛋白酶、菠萝蛋白酶和木瓜蛋白酶
表5显示,“菠萝-胰蛋-胰糜-木瓜”4酶组合所制备的复合酶解液具有最高的抗凝血活性,为100.0 ATU·mL-1,其次是“木瓜-胰蛋-胰糜-菠萝”4酶组合的复合酶解液,其抗凝血活性为90.0 ATU·mL-1。由试验结果可看出,利用复合酶解的方法来水解酪蛋白,水解度更高且所制备的酪蛋白酶解液也具有较高的抗凝血活性。
2.5 酪蛋白抗凝血肽的体外溶栓与抗凝血作用实验
2.5.1 酪蛋白抗凝血肽(AP)的体外溶栓实验 新西兰大白兔耳朵静脉采血,滴在悬有棉线的小玻璃管中,静置15 min使兔血充分凝固后,将带血栓的棉线剪成约2 cm长,浸泡于100 ATU·mL-1的AP 溶液中。同时以生理盐水为阴性对照、4%(质量分数,后同)CATS为阳性对照。在 26 ℃下浸泡24 h,然后进行观察并拍照[17]。体外溶栓实验见图7,结果显示:兔血栓线在100 ATU·mL-1的AP 溶液中液中浸泡24 h后已经全部溶解,浸泡于4% CATS中的尚有部分未溶解,而溶解于生理盐水中的只有极少量。说明100 ATU·mL-1AP溶栓效果好于4% CATS。而后者又明显好于生理盐水。

a.浸泡于生理盐水;b.浸泡于4% CATS;c.浸泡于100 ATU·mL-1 AP 1.开始时的状态;2.结束时的状态图7 体外溶栓实验
2.5.2 酪蛋白凝血肽(AP)体外抗凝血实验 体外抗凝血实验参照文献方法[17]。样品液为100 ATU·mL-1的AP溶液,取6支试管,按照以下比例加入兔血:新西兰大兔血1 mL(空白组);新西兰大兔血∶4%柠檬酸钠溶液(V/V)=1∶1(对照组);新西兰大兔血∶样品液(V/V)分别为9∶1、8∶2、6∶4、1∶1(样品组①、②、③、④);然后把6支试管分别置于37 ℃水浴3 min后,开始观察血液凝固时间(试管倒置时血液不流动)。
实验结果见图8。空白组(1 mL兔血)约30 s凝固;对照组(兔血∶4%柠檬酸钠溶液(V/V)=1∶1)48 h后凝固;样品组①(兔血∶酪蛋白酶解液(V/V)=9∶1)5 min后半凝固;样品组②(兔血∶酪蛋白酶解液(V/V)=8∶2)10 min后半凝固;样品组[③和④(兔血∶酪蛋白酶解液(V/V)=6∶4和1∶1)]48 h后仍然不凝固。实验结果显示,空白组兔血很快就凝固、酪蛋白酶解液所占体积较小的样品组兔血也较快凝固,而对照组及酪蛋白酶解液所占体积较高的样品组都可以有效延长凝血时间,说明按照该实验条件复合酶解酪蛋白所制备的酶解液中含抗凝血活性物质,具有较强的体外抗凝血作用。
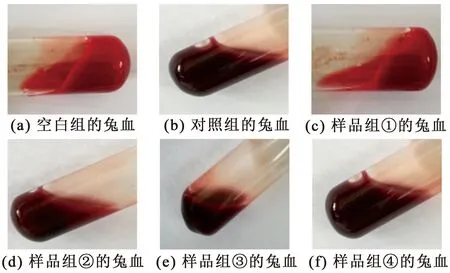
图8 体外抗凝血实验
3 结论
本实验运用星点设计-效应面法分别确定了菠萝蛋白酶、胰蛋白酶、胰糜蛋白酶和木瓜蛋白酶酶解酪蛋白的最佳反应条件,并利用这4种蛋白酶对酪蛋白进行复合酶解,然后测定酪蛋白酶解液的水解度和抗凝血活性。实验结果表明,按照本实验条件“菠萝蛋白酶-胰蛋白酶-胰糜蛋白酶-木瓜蛋白酶”4酶组合复合酶解酪蛋白,所制备的酶解液具有最高的抗凝血活性值,为100.0 ATU·mL-1。选用100.0 ATU·mL-1的AP溶液对新西兰大白兔血进行体外溶栓和抗凝血作用的实验,结果表明其在体外具有明显的溶栓效果和抗凝血作用。后续正在进行该抗凝血肽的分离和纯化工作。
