麦克尔/环化串联反应高效合成多官能团的3,4-二氢-2H-硫吡喃[2,3-b]喹啉*
2019-06-27高志坚王梦雪谢建武
高志坚, 王梦雪, 王 经, 谢建武
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
喹啉杂环是较为重要的有机合成中间体,同时也是众多具有生理活性的天然产物和医药农药化合物中普遍存在的骨架结构,含有该骨架的化合物大部分具有抗菌、抗肿瘤等生理活性[1].喹啉的化学性质活泼,其苯环上可以发生亲电取代反应,吡啶环上可以发生亲核取代反应,因此结构多变,容易被修饰形成多种衍生物,形成的衍生物在有机合成领域也是一类重要的配体[2].因此,如何构造喹啉杂环化合物是有机化学的研究热点.其中,喹啉并硫吡喃衍生物由于存在喹啉杂环单元及硫吡喃杂环单元,使其更具有广泛的生物活性和药理活性,如抗真菌、消炎、抗肿瘤、抗血吸虫等[3-4];除此之外,喹啉并硫吡喃衍生物也是构造其他重要化合物的有用前体[5-6].但是有关于喹啉并硫吡喃衍生物在医药、农药方面应用的相关文献报道还非常少.最近,Wu[7],Arai[8]和Dodda[9]课题组分别报道了有机催化剂催化硝基烯烃与2-巯基-3-喹啉甲醛的串联反应,构建了喹啉并硫吡喃衍生物.本课题组长期以来基于串联反应,合成了一系列杂环化合物,取得了较好的成果[10-15].特别是,本课题组于2017年通过手性有机催化剂,非对映选择性合成了具有光学活性的喹啉并硫吡喃衍生物[10].基于已经取得的一些成果,以邻异硫氰酸酯肉桂醛为底物,通过两步反应,构造了一系列喹啉并硫吡喃衍生物.该方法具有条件温和、收率高、底物适用范围广等优点.
以邻异硫氰酸酯肉桂醛与溴代1,3-二羰基化合物为原料,高效合成了一系列喹啉并噻吩或喹啉并二氢噻吩类化合物(见图1).由于喹啉并硫吡喃衍生物中的羟基、硝基、溴、氯、腈基等官能团广泛存在于天然产物和医药中,通过一些简单的反应,可以构造其他一些有用的化合物[15].并且,以邻异硫氰酸酯肉桂醛为起始原料,在脯氨酸的催化下,首先生成了2-巯基-3-喹啉甲醛,然后在催化剂的作用下,与缺电子烯烃发生麦克尔/环化串联反应,可以获得多取代的喹啉并硫吡喃衍生物,这些化合物本身可能具有潜在的药用价值,由于其结构中具有多个可修饰的官能团,可以根据需要进一步构造其他结构复杂的化合物(见图1).

图1 喹啉类衍生物的合成路线
1 实验部分
1.1 试剂与仪器
WRS-1B 数字熔点仪(温度计未经校正);Bruker Avance 400型或600型核磁共振波谱仪(DMSO或CDCl3为溶剂,TMS为基准物质);有机反应用薄层硅胶板(TLC)跟踪监测.德国Bruker高分辨质谱仪(BioTOFⅢQ).
1.2 底物2-巯基-3-喹啉甲醛合成的一般步骤[10]
在250 mL的圆底烧瓶中,依次加入邻异硫氰酸酯肉桂醛9.5 g(0.05 mol),脯氨酸2.9 g(0.025 mol)和30 mL甲醇,室温下搅拌2 h,减压过滤,少量无水乙醇洗涤,干燥得到纯的黄色固体产物1a.母液浓缩后柱层析,得到剩余产物.产物合并产率为91%.
1.3 麦克尔/环化串联反应合成喹啉并硫吡喃衍生物的一般步骤
在反应试管中依次加入2-巯基-3-喹啉甲醛(0.1 mmol),1 mL丙酮和缺电子烯烃(0.15 mmol),再加入DBU(0.02 mmol),搅拌反应10 min后,用柱层析纯化(V二氯甲烷/V乙酸乙酯=8/1)后得到喹啉并硫吡喃衍生物.
2 结果与讨论
2.1 底物2-巯基-3-喹啉甲醛的合成
首先,对底物2-巯基-3-喹啉甲醛进行合成.根据之前的报道[15],2-巯基-3-喹啉甲醛在脯氨酸的催化下,经过一个分子内的森田-贝利斯-希尔曼反应,可以得到2-巯基-3-喹啉甲醛.如图2所示,芳环上为拉电子基团和供电子基团时,都可以获得很好的收率.此外,芳环上取代基的位置对产率没有明显的影响(1a:R=H,89%;1b:R=6-Me,83%;1c:R=7-Me,90%;1d:R=6-Br,86%;1e:R=5-NO2,88%).
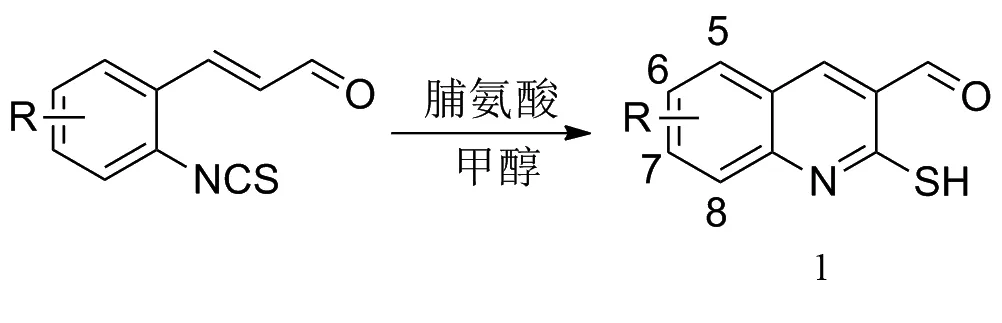
图2 不同取代基的2-巯基-3-喹啉甲醛1的合成
2.2 麦克尔/环化串联反应合成喹啉并硫吡喃衍生物
在顺利获得底物2-巯基-3-喹啉甲醛1a—1e后,为了获得喹啉并硫吡喃衍生物,首先以2-巯基-3-喹啉甲醛和2-溴代硝基苯乙烯为模板底物,对麦克尔/环化串联反应条件进行了优化,如图3和表1所示.以四氢呋喃为溶剂,对一些常用的碱进行了筛选.不论是无机碱还是有机碱,反应都能顺利进行,并且获得目标产物的非对映选择性非常高.对于无机碱,Na2CO3反应10 min后即可获得61%的产率;而使用较弱的碱如NaHCO3,反应则变得非常缓慢,即使反应3 d,收率也只有47%;使用强碱NaOH时,反应产率降低,原因可能是2-溴代硝基烯烃发生了聚合.对于有机碱,其中1,8-二氮杂二环十一碳-7-烯(DBU)表现最好,反应10 min后即可获得78%的产率;1,4-二氮杂二环[2.2.2]辛烷(DABCO)和三乙胺(Et3N)表现稍差.因此,选用DBU催化该反应.实验还对常用的溶剂进行了筛选,所用的溶剂中,丙酮表现最为优秀,反应10 min后可以获得89%产率.经过筛选,麦克尔/环化串联反应的优化条件是:在DBU催化下,以丙酮为溶剂,2-巯基-3-喹啉甲醛和2-溴代硝基苯乙烯反应10 min.

图3 麦克尔/环化串联反应的条件优化
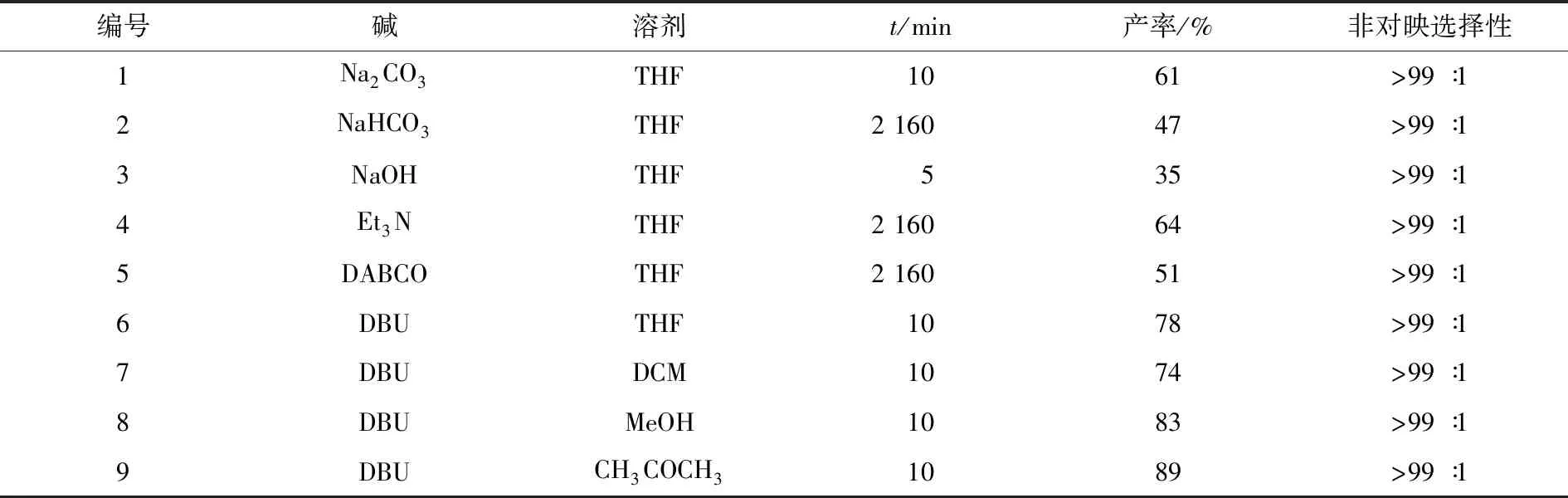
编号碱溶剂t/min产率/%非对映选择性1Na2CO3THF1061>99∶12NaHCO3THF2 16047>99∶13NaOHTHF535>99∶14Et3NTHF2 16064>99∶15DABCOTHF2 16051>99∶16DBUTHF1078>99∶17DBUDCM1074>99∶18DBUMeOH1083>99∶19DBUCH3COCH31089>99∶1
注:非对映选择性测定通过核磁共振氢谱测定.
在确定了麦克尔/环化串联反应的优化条件后,为了获得更多的喹啉并硫吡喃衍生物,对多种取代的2-巯基-3-喹啉甲醛1和缺电子烯烃2进行了扩展,以研究该方法的适用性,如图4和表2所示.首先,以2-溴代硝基烯烃2a为基准底物,分别与不同取代基的2-巯基-3-喹啉甲醛1a—1e进行反应,以研究2-巯基-3-喹啉甲醛芳环上取代基的电子效应对该串联反应的影响(编号1—5).很明显,2-巯基-3-喹啉甲醛1b—1c芳环上如果有供电子基团时,反应活性较高,而且收率很好;相反,2-巯基-3-喹啉甲醛1d—1e由于有拉电子基团,反应活性有所降低,收率也随之下降.不论2-巯基-3-喹啉甲醛芳环上的取代基是拉电子还是供电子基团,非对映选择性都非常好,大于99∶1.其次,以2-巯基-3-喹啉甲醛1a为基准底物,对芳环上有其他取代基的缺电子烯烃1进行了底物扩展(编号6—9).很明显,2-溴代硝基烯烃的苯环上的取代基对反应活性没有特别影响,基本上都可以获得优秀的产率,而且非对映选择性同样优秀,都大于99∶1.为了进一步研究该串联反应的适用性,以缺电子烯烃为2-氯代丙烯腈2f代替2-溴代硝基烯烃,该反应同样可以顺利进行,有着良好的产率(编号10—14).然而,产物的非对映选择性却明显下降.这可能是由于2-氯代丙烯腈2f相对于2-溴代硝基烯烃2a—2e的空间位阻比较小,导致非对映选择性降低.

图4 不同取代基的喹啉并硫吡喃衍生物合成

编号R1 1R2R3EWG23产率/%非对映选择性1 H1aC6H5BrNO22a3aa89>99∶126-CH31bC6H5BrNO22a3ba91>99∶137-CH31cC6H5BrNO22a3ca96>99∶146-Br1dC6H5BrNO22a3da73>99∶155-NO21eC6H5BrNO22a3ea86>99∶16H1ap-MeC6H4BrNO22b3ab93>99∶17H1ap-MeOC6H4BrNO22c3ac96>99∶18H1ap-ClC6H4BrNO22d3ad94>99∶19H1ap-BrC6H4BrNO22e3ae89>99∶110H1aHClCN2f3af88>99∶1116-CH31bHClCN2f3bf9083∶17127-CH31cHClCN2f3cf8885∶15136-Br1dHClCN2f3df8685∶15145-NO21eHClCN2f3ef8992∶8
注:非对映选择性测定通过核磁共振氢谱测定.
2.3 产物的表征数据如下:
1)1a 淡黄色固体;熔点304~305 ℃(文献值:>193 ℃)[16];1H NMR(600 MHz;DMSO)δ:13.98(s;1H),10.72(s,1H),8.36(s,1H),8.01(d,J=7.9 Hz,1H),7.76(t,J=7.7 Hz,1H),7.65(d,J=8.3 Hz,1H),7.41(t,J=7.5 Hz,1H).高分辨质谱m/z:计算值C10H7NOS+[M+H+]190.032 7,测量值190.032 3.
2)1b 淡黄色固体;熔点 281~283 ℃(文献值:>213 ℃)[16];1H NMR(600 MHz,DMSO)δ:13.94(s,1H),10.72(s,1H),8.25(s,1H),7.77(s,1H),7.58(dd,J=30.1,8.5 Hz,2H),2.37(s,3H).高分辨质谱m/z:计算值C11H9NOS+[M+H+]204.048 3,测量值204.048 0.
3)1c 淡黄色固体;熔点 287~288 ℃;1H NMR(600 MHz,DMSO)δ:13.86(s,1H),10.71(s,1H),8.29(s,1H),7.87(d,J=8.1 Hz,1H),7.41(s,1H),7.24(d,J=8.1 Hz,1H),2.45(s,3H).高分辨质谱m/z:计算值C11H9NOS+[M+H+]204.048 3,测量值204.048 1.
4)1d 淡黄色固体;熔点228~273 ℃(文献值:>243 ℃)[16];1H NMR(600 MHz,DMSO)δ:14.08(s,1H),10.70(s,1H),8.30(d,J=14.0 Hz,2H),7.90(d,J=7.8 Hz,1H),7.57(d,J=8.5 Hz,1H).高分辨质谱m/z:计算值C10H6BrNOS+[M+H+]269.137 7,测量值269.940 6.
5)1e 淡黄色固体;熔点 255~257 ℃;1H NMR(400 MHz,DMSO)δ:10.71(s,1H),8.60(s,1H),8.15(d,J=7.2 Hz,1H),8.01~7.88(m,2H).高分辨质谱m/z:计算值C10H6N2O3S+[M+H+]235.017 7,测量值235.015 5.
关于在中小城市开展历史文化街区划定工作的实践与思考……………………………………………………… 张经纬(11-33)
6)3aa 白色固体;熔点 211~212 ℃;1H NMR(400 MHz,DMSO)δ:8.43(s,1H),8.04(d,J=8.0 Hz,1H),7.88(d,J=8.4 Hz,1H),7.77(t,J=7.4 Hz,1H),7.62~7.49(m,6H),6.28(s,1H),6.00(d,J=7.2 Hz,1H).13C NMR(101 MHz,DMSO)δ:156.2,146.9,135.3,134.8,131.7,131.7,131.4,131.2,131.1,129.4,129.4,128.7,127.3,126.6,125.7,110.5,75.0,50.3.高分辨质谱m/z:计算值C18H12BrN2O3S+[M+H+]416.990 3,测量值416.991 8.
7)3ba 白色固体;熔点 225~230 ℃;1H NMR(400 MHz,DMSO)δ:8.33(s,1H),7.79(d,J=8.4 Hz,2H),7.66~7.45(m,6H),6.27(s,1H),5.99(d,J=7.1 Hz,1H),2.50(s,3H).13C NMR(101 MHz,DMSO)δ:155.0,145.5,136.1,135.3,134.2,133.2,131.7,131.7,131.3,131.2,129.4,129.4,127.3,127.1,125.7,110.7,75.0,50.2,21.5.高分辨质谱m/z:计算值C19H15BrN2O3S+[M+H+]431.006 0,测量值431.010 8.
8)3ca 黄色固体;熔点 157~158 ℃;1H NMR(600 MHz,DMSO)δ:8.38(s,1H),7.95(d,J=8.3 Hz,1H),7.68(s,1H),7.58(q,J=8.6 Hz,4H),7.49(d,J=7.4 Hz,1H),7.43(d,J=8.3 Hz,1H),6.28(s,1H),5.99(d,J=7.3 Hz,1H),2.53(s,3H).13C NMR(151 MHz,DMSO)δ:156.0,147.1,141.3,135.3,134.6,131.7,131.7,131.2,130.4,129.4,129.4,128.7,128.4,126.3,123.8,110.7,75.0,50.2,21.9.高分辨质谱m/z:计算值C19H15BrN2O3S+[M+H+]431.006 0,测量值431.007 8.
9)3da 黄色固体;熔点 218~219 ℃;1H NMR(600 MHz,DMSO)δ:8.44(s,1H),8.37(d,J=2.0 Hz,1H),7.87(dd,J=9.0,2.1 Hz,1H),7.82(d,J=8.9 Hz,1H),7.61~7.53(m,5H),6.28(s,1H),6.01(d,J=5.9 Hz,1H).13C NMR(151 MHz,DMSO)δ:157.2,145.4,135.4,134.1,134.1,132.4,132.4,131.7,130.9,130.7,129.5,129.5,127.1,127.1 119.3,110.2,75.0,50.3.高分辨质谱m/z:计算值C18H12Br2N2O3S+[M+H+]494.900 8,测量值494.902 3.
10)3ea 黄色固体;熔点 214~215 ℃;1H NMR(400 MHz,DMSO)δ:8.97(s,1H),8.42(d,J=7.7 Hz,1H),8.29(d,J=8.4 Hz,1H),7.96(t,J=8.1 Hz,1H),7.76(d,J=7.2 Hz,1H),7.62~7.49(m,4H),6.36(s,1H),6.08(d,J=7.1 Hz,1H).13C NMR(101 MHz,DMSO)δ:158.7,146.7,145.6,135.5,134.5,131.7,131.7,130.6,130.0,129.5,129.5,124.6,118.1,109.6,99.9,74.9,55.3,50.3.高分辨质谱m/z:计算值C18H12BrN2O3S+[M+H+]416.990 3,测量值416.991 3.
11)3ab 黄色固体;熔点 197~201 ℃;1H NMR(600 MHz,DMSO)δ:8.40(s,1H),8.03(d,J=8.0 Hz,1H),7.87(d,J=8.4 Hz,1H),7.76(t,J=7.5 Hz,1H),7.55(t,J=7.4 Hz,1H),7.49~7.39(m,3H),7.25(d,J=7.9 Hz,2H),6.17(s,1H),6.00(d,J=7.2 Hz,1H),2.32(s,3H).13C NMR(151 MHz,DMSO)δ:156.7,146.9,140.2,134.7,131.5,131.1,129.9,129.8,129.0,128.7,127.3,127.3,126.5,125.7,110.9,75.1,55.3,50.8,21.2.高分辨质谱m/z:计算值 C19H15BrN2O3S+[M+H+]431.006 0,测量值431.007 1.
12)3ac 白色固体;熔点 197~198 ℃;1H NMR(400 MHz,DMSO)δ:8.40(s,1H),8.03(d,J=8.0 Hz,1H),7.87(d,J=8.3 Hz,1H),7.75(dd,J=8.7,5.3 Hz,1H),7.58~7.52(m,1H),7.46(dd,J=15.2,8.1 Hz,3H),7.00(d,J=8.8 Hz,2H),6.15(s,1H),5.99(d,J=7.3 Hz,1H),3.78(s,3H).13C NMR(101 MHz,DMSO)δ:160.8,156.8, 146.8,134.7,131.5,131.2,131.2,131.1,128.7,127.3,126.5,125.7,125.7,123.6,114.6,111.2,75.1,55.7,49.0.高分辨质谱m/z:计算值C19H15BrN2O4S+[M+H+]447.000 9,测量值447.004 1.
14)3ae 黄色固体;熔点 194~198 ℃;1H NMR(600 MHz,DMSO)δ:8.37(s,1H),7.98(d,J=8.0 Hz,1H),7.85(t,J=8.2 Hz,1H),7.75(dd,J=14.9,7.3 Hz,1H),7.64(d,J=8.4 Hz,2H),7.54(t,J=7.4 Hz,1H),7.49(d,J=8.4 Hz,2H),6.17(s,1H),5.94(d,J=11.3 Hz,1H).13C NMR(151 MHz,DMSO)δ:156.1,146.8,134.9,132.3,132.1,132.0,131.3,131.3,131.2,128.7,127.1,127.1,126.8,125.7,124.1,110.4,75.0,50.4.高分辨质谱m/z:计算值C18H12Br2N2O3S+[M+H+]494.900 8,测量值494.901 8.
15)3af 黄色固体;熔点 206~207 ℃;1H NMR(600 MHz,DMSO)δ:8.43(s,1H),8.00(d,J=8.1 Hz,1H),7.84(d,J=8.4 Hz,1H),7.77~7.73(m,1H),7.64(d,J=6.5 Hz,1H),7.54(t,J=7.4 Hz,1H),5.25(d,J=6.4 Hz,1H),4.15(d,J=13.2 Hz,1H),4.05(d,J=13.2 Hz,1H).13C NMR(151 MHz,DMSO)δ:155.1,147.4,137.5,131.4,128.7,128.6,127.2,126.5,125.8,117.2,73.3,59.7,33.3.高分辨质谱m/z:计算值C13H9ClN2OS+[M+H+]277.019 7,测量值277.019 7.
16)3bf 黄色固体;熔点 200~201 ℃;80∶20 dr.1H NMR(600 MHz,DMSO)δ:8.32(s,1H),7.74(d,J=8.2 Hz,2H),7.60~7.57(m,2H),5.24(d,J=6.3 Hz,1H),4.20(d,J=13.1 Hz,0.26H),4.12(d,J=13.3 Hz,1H),4.04(d,J=13.2 Hz,1H),2.47(s,3H).13C NMR(151 MHz,DMSO)δ:153.8,146.0,136.9,136.0,133.5,128.5,127.3,127.0,125.8,117.3,73.3,55.3,33.3,21.5.高分辨质谱m/z:计算值C14H12ClN2OS+[M+H+]291.035 3,测量值291.035 6.
17)3cf 黄色固体;熔点 203~205 ℃;54∶46 dr.1H NMR(600 MHz,DMSO)δ:8.33(d,J=30.1 Hz,1H),7.82~7.72(m,2H),7.68~7.37(m,2H),5.35(d,J=98.6 Hz,1H),4.19(dd,J=46.6,13.2 Hz,1H),4.08(d,J=13.2 Hz,0.54H),3.98(d,J=13.0 Hz,0.46H),2.50(s,3H).13C NMR(151 MHz,CDCl3)δ:158.8,158.5,150.9,150.8,141.6,141.3,140.7,140.7,138.2,133.3,133.2,132.1,132.0,131.8,130.6,130.5,122.6,122.0,78.1,76.5,64.5,64.4,38.0,37.7,26.2,26.2.高分辨质谱m/z:计算值C14H12ClN2OS+[M+H+]291.035 3,测量值291.035 7.
18)3df 黄色固体;熔点 199~201 ℃;78∶22 dr.1H NMR(600 MHz,DMSO)δ:8.49(s,1H),8.37(d,J=2.1 Hz,1H),7.91(dt,J=8.8,2.2 Hz,1H),7.85-7.82(m,1H),7.73(t,J=21.5 Hz,1H),5.30(s,1H),4.34(d,J=13.2 Hz,0.29H),4.22(d,J=13.2 Hz,1H),4.11(d,J=13.2 Hz,1H).13C NMR(151 MHz,DMSO)δ:156.1,145.9,136.5,134.3,130.6,129.7,129.4,127.1,119.1,117.0,73.3,59.6,33.4.高分辨质谱m/z:计算值C13H8BrClN2OS+[M+H+]354.930 2,测量值354.930 3.
19)3ef 黄色固体;熔点 206~207 ℃;90∶10 dr.1H NMR(600 MHz,DMSO)δ:8.99(s,1H),8.40(d,J=7.7 Hz,1H),8.26(d,J=8.4 Hz,1H),7.95(t,J=8.1 Hz,1H),7.87(d,J=6.3 Hz,1H),5.38(d,J=5.2 Hz,1H),4.40(d,J=13.2 Hz,0.12H),4.25(d,J=13.2 Hz,1H),4.14(d,J=13.2 Hz,1H).13C NMR(151 MHz,DMSO)δ:157.8,147.1,145.6,134.4,132.5,131.8,130.1,124.4,118.2,116.9,73.2,59.3,33.3.高分辨质谱m/z:计算值C13H8ClN3O3S+[M+H+]322.004 8,测量值322.004 8.
3 结 论
以新型底物2-异硫氰酸酯肉桂醛为起始原料,经过一个分子内森田-贝利斯-希尔曼反应,高收率地得到了2-巯基-3-喹啉甲醛,随后与一系列的缺电子烯烃发生串联反应.2-巯基-3-喹啉甲醛与2-溴代硝基烯烃发生麦克尔/亨利串联反应,高收率得到了一系列的喹啉并硫吡喃衍生物,非对映选择性都大于99∶1.当缺电子烯烃为氯代丙烯腈时,反应活性也很好,但是非对映选择性有所降低.该方法具有条件温和、收率高、非对映选择性好的特点,是一条构造喹啉并硫吡喃的有效方法.同时,实验所合成的喹啉并硫吡喃衍生物具有多个取代基,如羟基、硝基、腈基、溴或者氯,这些官能团都容易进行修饰,因此,该类化合物在有机合成、医药开发上具有较好的应用前景.
